
胎盘母体血管灌注不良(maternal vascular malperfusion,MVM)包括一系列在母体蜕膜血管中所表现的病理改变,其本质是妊娠过程中子宫螺旋动脉重塑异常导致的绒毛间隙氧合和血流动力学的异常。MVM在胎盘病理检查中是很容易被识别的一系列病理表现,但是国内病理医师对胎盘病理诊断的重视程度不够。该文就MVM的大体表现、镜下表现和临床意义做一介绍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人类胎盘是一个存在时间非常短的特殊器官,是拥有独立血液循环的两套系统的交汇处。正常母体血液的畅通对胎盘的功能至关重要,母体血液的流动为胎儿提供氧气和营养,所有影响母体血管和循环的病理改变都会对胎儿的生长发育产生不利影响。对母体血管和胎盘血液循环的研究有很多推测病因和机制的术语如胎盘缺血、缺氧、胎盘功能不全、胎盘浅着床、母体血管灌注不足等。2016年阿姆斯特丹国际胎盘工作小组共识中[1],将这些术语统一为母体血管灌注不良(maternal vascular malperfusion,MVM)。
MVM的确切病因目前仍不清楚,但是妊娠过程中母体子宫螺旋动脉重塑异常是其重要的病理生理学表现。正常的子宫内膜螺旋动脉是厚壁的肌性小动脉,管腔较小。这些动脉是妊娠早期胎儿绒毛外滋养细胞(extravillous trophoblast,EVT)的初始靶点。EVT从锚定绒毛处增殖、分化,有2种侵袭途径[2]:一种是直接浸润蜕膜间质和子宫浅肌层,另一种是直接侵入螺旋动脉管腔,与自然杀伤细胞、巨噬细胞结合,降解螺旋动脉壁内的平滑肌和弹力纤维层。EVT及其分泌的基质型纤维素样物质完全取代血管内皮细胞及管壁,形成扩张的血管腔,将母体血液输送到发育中的胎盘陷窝[3]。在妊娠早期,螺旋动脉的EVT重塑过程非常剧烈,甚至会形成栓子暂时堵塞远端血管腔,限制母体血液过多流经发育中的胎盘,此时流经胎盘中的血氧分压<20 mmHg(1 mmHg=0.133 kPa),而蜕膜血液中的氧分压约为60 mmHg。这一明显的低氧水平实际上是妊娠的生理学特征,子宫内膜腺体的分泌物和缓慢流动的血液在营养早期胚胎的同时最大限度地减少胚胎发育关键点的氧化损伤[4,5]。在妊娠早期接近尾声时,随着螺旋动脉管腔内的EVT栓子的溶解,真正的子宫胎盘血液循环建立,此时绒毛间隙的血氧分压上升至40~80 mmHg,第二波EVT介导的血管重塑开始,并通过蜕膜延伸至子宫浅肌层(内1/3肌层,有时称交界区)[6,7]。这一区域的重塑非常重要,螺旋动脉的血管平滑括约肌可能位于蜕膜和肌层的交界处。螺旋小动脉的重塑并不完全均匀一致,在胎盘种植部位的中心,EVT对血管的重塑最深、最彻底[3]。新改建好的血管管腔直径比未改建的大5~10倍[5],其总体效果是为胎盘绒毛间隙提供高容低阻的血流,并且重塑的血管对母亲及胎儿的血管活性物质的刺激无反应能力。最终胎盘绒毛间隙的血氧分压维持在60 mmHg,但它仍低于母体正常的动脉血氧分压值90 mmHg。
子宫蜕膜和浅肌层区的螺旋动脉重塑异常可以导致胎盘MVM[3],血管重塑异常的机制目前仍不完全清楚,可能的原因包括EVT功能先天缺陷或母体不能免疫耐受父系来源的EVT,导致EVT侵袭能力下降,子宫螺旋动脉重塑减少,引起子宫胎盘血液循环功能障碍(高压低容)[2]。与其他器官一样,血管血容量减少或血管闭塞引起的血流减少可导致缺氧缺血性损伤,而螺旋动脉重塑异常可导致管腔狭窄甚至闭塞,引起相应区域胎盘缺氧缺血及绒毛梗死[8],但除缺氧相关损伤外,胎盘组织氧化损伤[9]及与其相似的缺氧再灌注损伤可能与胎盘绒毛间隙血流异常高速、湍流有关,高氧环境下绒毛结构将发生氧化损伤[5]。
MVM的病理表现可以在胎盘病理检查中很容易被识别。但它绝不是一种特定的病理形态学改变,而是涉及母体蜕膜血管和胎盘绒毛实质的一系列病变。MVM的大体病理表现主要包括胎盘发育不良、胎盘梗死和胎盘后出血。
胎盘重量(新鲜标本去除胎膜和脐带的重量)低于相应孕周预期值的第10百分位数和/或脐带直径小于8 mm。目前中国所能参考的妊娠期预期胎盘重量和脐带直径均为欧美国家的数据[10,11],国内的数据尚需进一步收集、研究。
在大体检查时通常表现为白色或苍白色区域,但由于梗死性病变持续的时间及严重程度不同,其大体组织学外观也各不相同。急性梗死呈红色,界限不清,与周围正常组织相比颜色稍有变化,很容易在大体检查中被忽略,但经甲醛固定后,这些病变将更容易识别[1]。亚急性梗死表现为棕褐色,而陈旧性梗死表现为典型的白色或苍白色,多靠近母面的楔形或矩形病变,切面边界清晰,均匀一致。因此应对所有可疑区域进行病变大体描述和取材,包括病变的位置(中心或边缘)、形状、颜色、大小等。当病变多发并严重时,应估计并记录所占胎盘实质的百分比。胎盘梗死必须经镜下组织学确认方可作出诊断。有些胎盘梗死可能包含中心出血,可诊断为梗死血肿[1,12],也有类似病变被描述为"圆形胎盘内血肿",并与MVM组织学相关[13]。需要指出的是,在足月胎盘中,梗死超过胎盘实质的5%才有临床意义,对早产儿胎盘而言,任何的梗死均为MVM的表现[1]。
与胎盘早剥的临床诊断相关的病理诊断。然而,并非所有胎盘早剥的病例都会有胎盘后血肿,也不是所有病理检查发现胎盘后血肿的病例临床诊断为胎盘早剥。胎盘后血肿的大体表现可随血肿持续的时间而变化。早期新鲜血液松散的聚集在胎盘母面,随着出血/血肿持续时间增加,其将压迫胎盘母面,附着更加牢固,最终血肿可能压迫母面邻近组织,并引起邻近绒毛梗死。陈旧性胎盘后血肿会呈现出灰褐色,因为某些血液成分已被分解。
大体检查时应描述胎盘后血肿的颜色、大小、有没有胎盘母面的压痕,如果有应测量其面积。血肿的取材应包括相邻的胎盘底板组织,如果送检有单独的凝血块,还应测量其体积和重量[1]。
MVM的病理组织学损伤包括母体蜕膜血管和绒毛。阿姆斯特丹国际胎盘工作小组共识中没有对MVM进行分级和分类。但是,在一些研究中作者将MVM的严重程度分为轻、中、重度[14],其中轻至中度病例为1级,胎盘重量通常在正常范围,病变实质受累较少(<30%),且不超过1个边缘区梗死灶。重度病例为2级,胎盘重量低于相应孕周预期值的第10百分位数,病变受累实质更加广泛,并且有多发性非边缘区胎盘实质的梗死。根据母体蜕膜血管不同的病理生理紊乱特征,MVM可以分为2大类[15]:(1)弥漫性/部分性MVM,主要特征是绒毛加速成熟和终末绒毛发育不全,大多数母体蜕膜血管有病理改变,但血管仅部分闭塞;(2)节段性/完全性MVM,表现为绒毛梗死,表明梗死区的螺旋动脉完全闭塞。很多MVM病例可以同时发现这2种类型的病理改变,特别是早产儿胎盘中。
主要累及胎盘中央部分母面的底蜕膜的母体血管和胎膜的壁蜕膜,包括4种不同但相关的病变:底蜕膜螺旋动脉持续肌化、壁蜕膜动脉壁肥厚、血管壁纤维素性坏死和急性动脉粥样硬化。底蜕膜血管的病理改变反映了螺旋动脉的异常重塑,其特征是螺旋小动脉的血管平滑肌降解不充分,在妊娠过程中持续存在,导致管腔直径减小,血管阻力增加。正常重塑的螺旋动脉管壁主要为纤维蛋白样物和EVT,无平滑肌,管腔扩张变大且不规则,内衬扁平内皮细胞(有人认为EVT也会替代内皮细胞)。病理表现为底蜕膜内小动脉持续肌化,血管壁内无EVT侵犯,平滑肌持续存在(图1),至少累及1条胎盘底板的螺旋动脉[7]。在观察血管变化时应谨慎,对早产儿胎盘而言,其螺旋动脉重塑过程不会完全完成。但是,位于底板蜕膜内的螺旋动脉应在妊娠前3个月的末期或第4个月的早期完全重建。因此,比较有价值的评估是在妊娠20周以后,在胎盘中央部分的底板蜕膜内发现重塑异常的血管[2]。壁蜕膜内的动脉血管主要表现为管壁肥厚。由于这些血管不在胎盘下,其经历的血管重塑程度较低,在这个位置的血管壁内发现平滑肌不代表病理改变,但血管平滑肌细胞增生肥大是病理性改变,其可能是对母体高血压的反应。管壁肥厚的定义为血管壁的平均厚度大于血管周径的30%[16]。一个标准的快速估计是病变血管的管腔直径小于该血管总截面直径的1/3(图2)。血管壁纤维素性坏死常位于血管壁中膜,呈粉红色到红色,致密、玻璃样或蜡状改变,是MVM的特征性病变之一(图3),但需注意与正常的螺旋动脉重塑鉴别,纤维素性坏死的血管壁通常红色较深。有时管壁增厚,壁内可见大量泡沫样吞噬细胞,在这些病变血管的周围可以见到淋巴细胞呈袖套样聚集,称为"急性动脉粥样硬化"。高血压和其他潜在的因素可能导致母体血管壁损伤,最终发展为急性动脉粥样硬化,血管壁的纤维素样坏死可能是急性动脉粥样硬化的早期表现,严重的蜕膜炎性病变也可能是引起这种病变的主要因素,其他变化包括血栓形成和/或管壁破裂导致胎盘后血肿。蜕膜血管病的诊断有很多局限性。在较深的底蜕膜和胎盘种植部位的子宫浅肌层中的血管病变更有意义。在20世纪50年代,针对胎盘种植部位组织的活检研究发现,先兆子痫患者子宫浅肌层螺旋动脉的重塑比率约为25%,而正常妊娠的比率接近90%[7]。目前在绝大多数医院,胎盘是唯一可用的病理检查组织,其仅保留一层极薄的底蜕膜,而较浅的螺旋动脉更容易被EVT侵犯和重塑。另外,螺旋动脉的重塑是不均匀的,位于胎盘周围的螺旋动脉重塑不完全,容易被误认为是蜕膜血管病。最后,蜕膜血管病的病变可能是局灶的,阅片不仔细可能会漏诊。
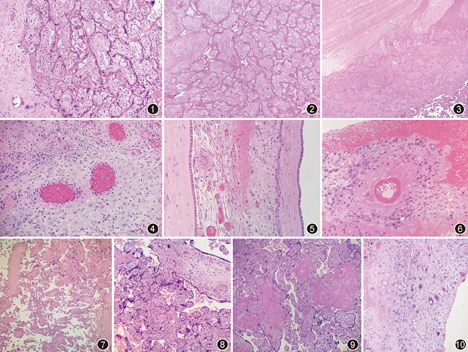

阿姆斯特丹国际胎盘工作小组共识认为MVM最重要的病理组织学改变是绒毛发育不良,特别是终末绒毛发育不良和绒毛成熟加速[1]。绒毛发育不良是绒毛组织对母体血管灌注异常和绒毛间缺氧的直接反应。绒毛发育成熟度的评价应在胎盘实质的中央部分,距母面近1/3的非梗死区域进行。
终末绒毛发育不良是MVM的另一个特征性病变,通常出现在已经进展为舒张末期脐动脉无血流或血流逆转的妊娠中,镜下特征是干绒毛分支减少,末端绒毛的数量和直径减少,绒毛间隙明显,弥漫/局灶绒毛纤细(呈笔杆状,图4)。上述表现在一张切片上累计大于30%的胎盘实质即可诊断局灶性终末绒毛发育不良;若在1张以上切片上均有此表现,即可诊断弥漫性终末绒毛发育不良[15,16]。
绒毛加速成熟是指绒毛形态学比相应孕周更加提前,对36周以下的胎盘诊断较困难。镜下可见绒毛加速成熟与绒毛稀少的区域交替出现。绒毛加速成熟的区域绒毛密集,合体结节增多(图5),绒毛间隙纤维蛋白样物沉积增加,绒毛凝聚。在实际工作中,对绒毛加速成熟的评估可能显得有些主观,正常成熟的胎盘,成熟绒毛数量增多,绒毛直径变小,合体结节相对稍多,绒毛血管横截面积增大,血管集中在绒毛周围,血管合体膜形成,绒毛间质更致密。并且绒毛形态在胎盘小叶上不均匀,距螺旋动脉开口近的绒毛成熟度低,周围区域的绒毛成熟度高。合体结节被认为是合体滋养细胞的衰老和退化,合体结节增多是绒毛加速/过度成熟的一个表现,合体结节数目的增多有一评价指标[17]:34周之前的胎盘,有合体结节的绒毛>20%即为增多;38周以后的胎盘,有合体结节的绒毛>30%即为增多。
绒毛梗死是螺旋动脉阻塞、母体血运的局部停止,导致绒毛间隙收缩,绒毛在螺旋动脉闭塞处呈楔形或矩形塌陷,绒毛拥挤,继而出现绒毛间血流量减少及绒毛凝固性坏死,镜下超过5个相邻绒毛(通常更多)有此表现即可诊断。急性梗死常表现为充血/出血性绒毛拥挤,细胞核的嗜碱性开始降低,出现核碎裂和中性粒细胞浸润(图6)。随着缺血时间的持续,绒毛间质和滋养层中细胞核碎裂更加严重,直到最终所有的细胞核溶解消失,只剩下绒毛"鬼影"(图7)。
胎盘后出血镜下可见凝血块附着在胎盘底板上。在急性病例中,血液可能会分散在蜕膜中(急性蜕膜出血),并可能出现早期急性炎性反应(急性蜕膜炎)[18]。体积较大、持续时间长的病变会导致邻近胎盘实质受压并最终导致胎盘梗死(图8)。
其他一些胎盘病理表现如绒毛间隙纤维蛋白样物沉积增多、绒毛凝集、胎盘部位滋养巨细胞增生、未成熟中间滋养细胞增生及绒毛外滋养细胞假囊肿等,在过去被认为与母体血管病变相关,但阿姆斯特丹国际胎盘工作小组共识认为没有足够证据表明这些表现是诊断MVM的指标[1,16]。绒毛间隙纤维蛋白样物沉积会阻塞母体血液在胎盘内的流动,大量的纤维蛋白样物沉积在绒毛间隙(图9),不仅影响胎儿与母体的物质交换,而且对母体血循环造成障碍,但它并不仅在MVM的情况下出现。绒毛凝集是指相邻的终末绒毛(2~20个)被纤维蛋白样物黏附,导致绒毛间隙消失,血液灌注减少,绒毛表面滋养细胞退化,绒毛间质纤维化或细胞核碎裂,该病变被认为是绒毛滋养细胞的局部缺血性坏死(早期梗死)。胎盘部位滋养巨细胞增生和未成熟中间滋养细胞增生在先兆子痫的胎盘可被发现。胎盘部位滋养巨细胞增生是指底蜕膜中出现合体滋养细胞,可能是EVT的早衰表现(图10)。由于没有明确的正常参考值,因此很难客观诊断。未成熟中间型滋养细胞增生是指表层底蜕膜中出现10~20个未成熟中间滋养细胞(胞质嗜酸性或空泡状,成熟型胞质为深紫色)。另外,严重的MVM病例可能导致胎儿肾灌注不足,引起胎儿尿量较少和羊水过少,对胎膜的检查可以发现羊膜结节。
MVM与先兆子痫和胎儿宫内生长受限(fetal growth restriction,FGR)关系密切。严重的MVM患者在随后的妊娠中有10%~25%的复发风险[15]。
MVM最常见的临床表现是先兆子痫[15],其特征是妊娠期伴或不伴有蛋白尿的高血压[19]。但是,并非所有先兆子痫患者的胎盘都有MVM。重度先兆子痫患者的MVM发生率高于足月先兆子痫患者,提示晚发型先兆子痫可能存在不同的病理生理机制[20]。MVM与其他妊娠期疾病也相关,比如慢性高血压、子痫、溶血、肝酶升高、HELLP综合征[21,22,23]。此外,与MVM相关的另一个重要表现是自发性早产。新近的研究发现早产儿中MVM的发生率接近50%,高于早产儿炎性病变/感染的发生率[24,25]。与MVM相关的其他临床综合征还包括系统性红斑狼疮和抗磷脂抗体综合征[3]。新近的研究还表明在人类免疫缺陷病毒(HIV)感染的足月胎盘中MVM的发生率也很高[26]。
MVM是涉及胎盘实质和母体血管异常的一系列病理表现。MVM组织学病理变化既代表了由妊娠早期EVT重塑螺旋动脉异常引起的原发性血管病理改变(蜕膜血管病),也反映了由于缺氧和氧化应激损伤引起的胎盘绒毛病理改变(绒毛梗死、绒毛加速成熟及终末绒毛发育不良)。目前我们无法确定MVM的确切病因,探索潜在的多种病因机制[8,19],如蜕膜化受损、子宫内膜腺分泌不足、血管生长因子调节异常、免疫耐受异常和内皮细胞功能异常将非常有意义。MVM对导致胎盘终末绒毛发育不良的病理生理过程仍不清楚,新近研究发现发育不良的终末绒毛更复杂的立体结构减少,进一步的研究可能会产生促绒毛生长相关的干预治疗。严重的MVM与FGR关系密切,但胎盘的病理表现与成人期健康问题之间的联系仍不清楚。另外,EVT功能异常和母体组织相互作用的确切分子机制仍是研究热点。MVM的诊断不仅要对病变定性,更取决于病变的数量。定性容易,定量困难,这就造成MVM的诊断主观因素较多,可重复性差。
所有作者均声明不存在利益冲突
1.胎盘发育不良是指胎盘重量(新鲜标本)低于相应孕周期值的第( )百分位数。
A. 10 B. 20 C. 30 D. 40
2.( )血管的病理改变反映了螺旋动脉的异常重塑。
A.壁蜕膜 B.包蜕膜 C.底蜕膜 D.胎膜
3.血管壁纤维素性坏死常位于血管( )。
A.外膜 B.中膜 C.内膜 D.管腔
4.MVM最重要的病例改变是( )。
A.绒毛发育不良 B.绒毛梗死 C.绒毛成熟延迟 D.无血管绒毛
5.壁蜕膜内的蜕膜血管病主要表现为( )。
A.血管增生 B.血管重塑异常 C.管壁肥厚 D.管壁平滑肌持续存在




























经全国继续医学教育委员会批准,本刊开设继教专栏,今年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。