
CD34是一种单链跨膜蛋白,主要用作内皮细胞及造血干/祖细胞标志物。近年研究发现,除血管源性肿瘤、胃肠道间质瘤、孤立性纤维性肿瘤等表达CD34的经典肿瘤外,其在多种软组织肿瘤中均有表达,且衍生了一些新的肿瘤定义,如“浅表性CD34阳性的纤维母细胞肿瘤”。该文重点阐述了CD34在各类软组织肿瘤中的表达情况及其在实际鉴别诊断中的应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,今年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
CD34是一种单链跨膜蛋白,作为一种内皮细胞及造血干/祖细胞标志物,在病理诊断中,CD34主要用于血管源性肿瘤、孤立性纤维性肿瘤、隆突性皮肤纤维肉瘤、胃肠道间质瘤等的辅助诊断[1]。但是,研究发现,CD34在许多软组织肿瘤中均有不同程度的表达[2]。我们就CD34在主要软组织肿瘤中的表达及其对诊断及鉴别诊断的应用进行了综述。
1.主要临床特点:患者常表现为缓慢生长的无痛性肿块,少数累及神经时可伴运动或感觉障碍。发病部位广泛,四肢、胸背、头颈部均可发生,可为多灶。肿瘤多位于皮下,部分病例可位于真皮或肌间。恶性肿瘤体积常较大,或有短期内迅速生长病史。
2.组织学及病理学:正常脂肪组织的脂肪细胞间散在CD34阳性的间质细胞,并可随着肿瘤的形成而增殖。在脂肪细胞肿瘤中,CD34主要表达于梭形细胞及部分脂母细胞,既包括良性肿瘤如脂肪母细胞瘤(脂肪细胞,100%)、梭形细胞/多形性脂肪瘤(梭形细胞及多核巨细胞,95%~100%)、冬眠瘤(梭形细胞亚型),又包括恶性潜能不确定的肿瘤(不典型脂肪瘤样肿瘤,64%)及恶性肿瘤如去分化脂肪肉瘤(高分化成分及部分去分化成分的梭形细胞)、多形性脂肪肉瘤(非脂源性区域,50%)[2, 3, 4, 5, 6]。CD34在良性脂肪细胞肿瘤中的表达率较高,而在恶性脂肪细胞肿瘤中,CD34灵敏度及特异度均较低,需要与一组标志物共同使用以除外其他来源肿瘤。
1.主要临床特点:纤维母细胞/肌纤维母细胞肿瘤是软组织肿瘤中最复杂的一组病变。患者临床症状不特异,常表现为局部肿块,可伴疼痛或触痛,部分患者有外伤史。
2.组织学及病理学(表1):CD34在纤维母细胞/肌纤维母细胞来源的多种肿瘤中非特异性表达,除内皮细胞外,主要为纤维母细胞[1, 2, 4, 7, 8, 9, 10]。CD34常弥漫阳性的肿瘤包括隆突性皮肤纤维肉瘤及孤立性纤维性肿瘤。国外一项研究比较了CD34在隆突性皮肤纤维肉瘤及真皮纤维瘤中的表达情况,其中前者弥漫阳性率为93.3%,局灶阳性率为6.7%,而后者无弥漫阳性表达,局灶阳性率为23.4%[10]。此外,2014年,Carter等[11]提出“浅表性CD34阳性的纤维母细胞肿瘤(superficial CD34-positive fibroblastic tumor, SCPFT)”这一概念,其主要特点为:好发于肢体皮下组织及筋膜,呈浅表浸润性生长,由梭形细胞或上皮样细胞构成,瘤细胞核多形性显著,核仁明显,常见核内假包涵体,但核分裂象极罕见,背景中可见炎性细胞及肥大细胞浸润,不具有隆突性皮肤纤维肉瘤的典型特点。免疫组织化学CD34弥漫强阳性,细胞角蛋白部分病例阳性,不表达结蛋白、ERG、Fli-1、平滑肌肌动蛋白(SMA)、S-100蛋白,生物学行为呈交界性表现[12, 13]。遇到CD34强阳性病例时应注意将SCPFT纳入考虑范围。此外,SCPFT的鉴别诊断包括:(1)黏液性纤维肉瘤,尽管CD34、细胞角蛋白共同阳性较少见,但双阳性时容易造成误诊,此时应注意观察其细胞核不具有SCPFT的典型形态,并寻找黏液样间质。(2)黏液样炎性纤维母细胞肉瘤:与SCPFT类似,具有奇异形核,核仁明显,核分裂象罕见,背景有炎性基本浸润,但含有黏液样成分,CD34通常阴性,且好发于肢端。

CD34在主要纤维母细胞/肌纤维母细胞肿瘤中的表达
CD34在主要纤维母细胞/肌纤维母细胞肿瘤中的表达
| 纤维母细胞/肌纤维母细胞肿瘤 | CD34阳性细胞 | CD34阳性率 |
|---|---|---|
| 结节性筋膜炎 | - | 0 |
| 缺血性筋膜炎 | 增大的奇异型纤维母细胞 | >50% |
| 弹力纤维瘤 | 梭形细胞 | 约50% |
| 婴儿纤维性错构瘤 | 原始间叶细胞 | 约100% |
| 腱鞘纤维瘤 | 裂隙状腔隙衬覆的扁平细胞 | 不详 |
| 乳腺型肌纤维母细胞瘤 | 梭形细胞 | 90% |
| 钙化性腱膜纤维瘤 | 肿瘤细胞 | 不详 |
| 血管肌纤维母细胞瘤 | 部分梭形细胞 | 罕见 |
| 细胞性血管纤维瘤 | 梭形细胞 | 30%~60% |
| 项型纤维瘤 | 纤维母细胞 | 不详 |
| Gardner纤维瘤 | 梭形细胞(纤维母细胞) | 不详 |
| 钙化性纤维性肿瘤 | 梭形细胞(纤维母细胞) | 36%~100% |
| 巨细胞纤维母细胞瘤 | 梭形细胞、巨细胞 | 多数,具体不详 |
| 隆突性皮肤纤维肉瘤 | 梭形细胞 | 100%(纤维肉瘤样区可以失表达) |
| 胸膜外孤立性纤维性肿瘤 | 梭形细胞 | 90%~95% |
| 低级别肌纤维母细胞肉瘤 | 部分梭形细胞 | 不详 |
| 黏液样炎性纤维母细胞肉瘤 | 瘤细胞 | 30% |
| 婴儿纤维肉瘤 | 梭形细胞 | <20% |
| 成人纤维肉瘤 | 梭形细胞a | 不详 |
| 黏液性纤维肉瘤 | 梭形/星型/多形性瘤细胞 | 20%~38% |
注:a可能来源于隆突性皮肤纤维肉瘤或孤立性纤维性肿瘤的肉瘤成分
1.主要临床特点:好发于中青年。多数位于四肢及手足。影像学上腱鞘巨细胞瘤(局限型及弥漫型)可见邻近病变的骨不同程度退变。
2.组织学及病理学:与真皮纤维瘤不同,40%的深部良性纤维组织细胞瘤可以表达CD34,需与孤立性纤维性肿瘤鉴别[2]。此外应注意,部分良性纤维组织细胞瘤周边可见CD34阳性的纤维母细胞,不应判读为肿瘤CD34阳性。在腱鞘巨细胞肿瘤(局限型及弥漫型)中CD34阴性或仅局灶阳性[14, 15]。丛状纤维组织细胞瘤及软组织巨细胞瘤不表达CD34[15]。
1.主要临床特点:好发于中年人。血管球瘤及血管平滑肌瘤患者的典型症状为阵发性疼痛,受冷刺激可引起疼痛发作。血管周细胞肿瘤多位于肢端,其中血管球瘤最常见于甲床下。
2.组织学及病理学:CD34可以标记血管周细胞肿瘤(血管球瘤细胞、肌周细胞瘤、肌纤维瘤、肌纤维瘤病)中的血管内皮细胞,但肿瘤细胞通常阴性,仅有个别肿瘤细胞阳性的病例报道[16]。
1.主要临床特点:不同血管性肿瘤的临床特点差异较大。良性血管瘤多发生于婴幼儿及儿童,好发于躯体表浅部位。中间型血管性肿瘤,如卡波西型血管内皮瘤,几乎全部发生于儿童,尤其是1岁以内的婴儿,好发于四肢软组织。良性及中间性血管性肿瘤常表现为缓慢生长的无痛性斑块或肿块,可能呈红色或紫色。恶性血管性肿瘤,如上皮样血管内皮瘤及卡波西肉瘤,常发生于成年人,前者中青年居多,后者发病年龄因病因不同有所差异。上皮样血管内皮瘤可表现为起源于血管腔的坚实肿块,呈浸润性生长。
2.组织学及病理学:绝大多数血管性肿瘤表达CD34,阳性细胞包括内皮细胞及上皮样或梭形肿瘤细胞。文献报道的卡波西型血管内皮瘤、卡波西肉瘤、上皮样血管内皮瘤的CD34阳性率均接近100%[17, 18, 19]。其他肿瘤,包括上皮样血管瘤、淋巴管瘤、网状血管内皮瘤、淋巴管内乳头状血管内皮瘤,CD34阳性率不等,且与其他血管标记物相比强弱程度不一[2, 18]。血管肉瘤中,高分化成分的CD34表达强于低分化成分[9]。值得注意的是,假肌源性血管内皮瘤CD34几乎均阴性,且镜下细胞形态呈胖梭状,胞质嗜酸性,类似横纹肌母细胞,容易被误诊为横纹肌母细胞瘤,此时应注意与Fli-1、ERG及CD31(阳性率约50%)联用,且通过肌源性标志物结蛋白、Myogenin、MyoD1阴性共同明确诊断[2, 20]。
1.主要临床特点:胃肠道间质瘤是最常见的胃肠道原发间叶源性肿瘤。患者常因腹部不适或内镜偶然发现,肿瘤较大时可出现溃疡、出血、穿孔、梗阻等症状。大体形态呈结节状,切面可伴出血及囊性变。
2.组织学及病理学:70%~80%的胃肠道间质瘤CD34阳性,其中食管及直肠95%~100%,胃80%~85%,小肠约50%[21]。镜下梭形细胞型的CD34阳性率高于上皮样细胞型[2]。目前胃肠道间质瘤的免疫组织化学更倾向于CD117与DOG1联用,而CD34在明确诊断方面的价值偏低。不同危险度的CD34阳性率无明显差异。部分研究显示不同部位CD34表达程度不同可能与其甲基化状态及突变情况相关,但尚需更多研究结果支持[22]。
1.主要临床特点:神经鞘瘤及神经纤维瘤多发生于中青年,与遗传性疾病相关的人群起病更早。病变可以单发或多发,常表现为质地坚实、缓慢生长的肿块,多数病例无症状。恶性外周神经鞘膜瘤常见于20~50岁人群,好发于肢体,其次为躯干,体积常大于5 cm。
2.组织学及病理学:在正常神经组织中,CD34可以标记神经内膜的部分纤维母细胞样细胞。所有外周神经鞘膜肿瘤中均存在CD34阳性细胞,这些细胞S-100蛋白、上皮细胞膜抗原(EMA)、Glut1阴性,可能为神经内膜的纤维母细胞[9]。在经典型神经鞘瘤及其变异型中,CD34阳性率报道差异很大,肿瘤包膜处及antoni B区域的部分梭形或星型细胞CD34阳性,S-100蛋白阴性,antoni A区域表达模式则相反,目前研究认为这些细胞属于神经内膜的纤维母细胞,不同于经典的纤维母细胞及施旺细胞;色素性神经鞘瘤中,antoni A及antoni B区域不明显,多数病例肿瘤细胞CD34阴性,但有2例肿瘤细胞CD34弥漫强阳性的报道[2, 23]。神经纤维瘤中,CD34阳性成分明显多于神经鞘瘤,且阳性模式可呈“指纹状”,有助于与促纤维组织增生性黑色素瘤鉴别,部分研究认为CD34用于辅助诊断神经纤维瘤的灵敏度高于神经鞘瘤[24, 25, 26]。神经束膜瘤中,CD34阳性率约60%,部分病例CD34阳性模式为“指纹状”,与SMA阳性模式一致,而与Claudin-1和EMA模式明显不同[26]。以上均证实周围神经肿瘤中存在不同于施旺细胞、神经束膜细胞,而更接近于纤维母细胞的特殊细胞。皮肤神经鞘黏液瘤中,纤维母细胞可以CD34阳性,但其阳性率不详[27]。孤立性局限性神经瘤亦存在CD34阳性成分,可能为神经内膜及神经束膜的纤维母细胞,阳性率不详[2]。混杂性神经鞘肿瘤的梭形细胞几乎均表达CD34(阳性率98%)[28]。恶性外周神经鞘膜瘤的CD34阳性率为14%~57%,阳性成分主要为良性成分中的梭形细胞。总体上讲,单独应用CD34对于区分不同的良性周围神经肿瘤、区分周围神经肿瘤与其他来源肿瘤的价值有限[29]。在恶性外周神经鞘膜瘤中,CD34可有弱-中度阳性,且强度与podoplanin负相关,有助于与滑膜肉瘤鉴别。
组织学及病理学:CD34在多种不能确定分化的肿瘤中均有不同程度的表达,诊断价值不大[30, 31, 32, 33, 34, 35, 36, 37]。临床上可能用到的鉴别诊断包括:多形性透明变性血管扩张性肿瘤CD34常阳性,有助于与未分化多形性肉瘤(CD34常阴性)鉴别;≥50%的上皮样肉瘤表达CD34,有助于与癌(CD34几乎均阴性)鉴别[13, 30]。其余不能确定分化的肿瘤CD34表达情况见表2。
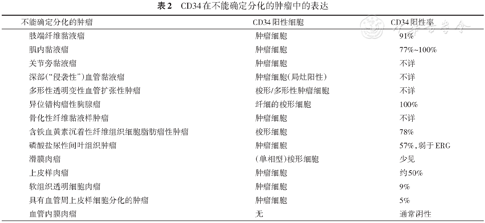
CD34在不能确定分化的肿瘤中的表达
CD34在不能确定分化的肿瘤中的表达
| 不能确定分化的肿瘤 | CD34阳性细胞 | CD34阳性率 |
|---|---|---|
| 肢端纤维黏液瘤 | 肿瘤细胞 | 91% |
| 肌内黏液瘤 | 肿瘤细胞 | 77%~100% |
| 关节旁黏液瘤 | 肿瘤细胞 | 不详 |
| 深部(“侵袭性”)血管黏液瘤 | 肿瘤细胞(局灶阳性) | 不详 |
| 多形性透明变性血管扩张性肿瘤 | 梭形/多形性肿瘤细胞 | 不详 |
| 异位错构瘤性胸腺瘤 | 纤细的梭形细胞 | 100% |
| 骨化性纤维黏液样肿瘤 | 肿瘤细胞 | 不详 |
| 含铁血黄素沉着性纤维组织细胞脂肪瘤性肿瘤 | 梭形细胞 | 78% |
| 磷酸盐尿性间叶组织肿瘤 | 肿瘤细胞 | 57%,弱于ERG |
| 滑膜肉瘤 | (单相型)梭形细胞 | 少见 |
| 上皮样肉瘤 | 肿瘤细胞 | 约50% |
| 软组织透明细胞肉瘤 | 肿瘤细胞 | 9% |
| 具有血管周上皮样细胞分化的肿瘤 | 肿瘤细胞 | 5% |
| 血管内膜肉瘤 | 无 | 通常阴性 |
平滑肌肿瘤中,深部平滑肌瘤一般不表达CD34,平滑肌肉瘤可以局灶表达,但诊断多依赖于形态学及2种或以上的肌源性标志物阳性[2, 38]。软组织软骨瘤及骨外骨肉瘤中,CD34仅标记血管内皮细胞。未分化/不能分类的肉瘤是一组无法确定分类的恶性肿瘤,属于排除性诊断,根据细胞形态可分为未分化圆细胞肉瘤、未分化梭形细胞肉瘤、未分化多形性肉瘤、未分化上皮样肉瘤等。本类肿瘤几乎没有固定的免疫组织化学染色模式,无法判断细胞来源。未分化肉瘤CD34可能阳性,但诊断价值很小;actin、结蛋白、EMA及角蛋白可以部分阳性[2]。
总之,软组织肿瘤的诊断与鉴别诊断除根据病史、大体、光镜下形态,还包括一组基本的免疫组织化学标志物:CD34、结蛋白、EMA、广谱细胞角蛋白、S-100蛋白、SMA[1]。CD34在梭形细胞脂肪瘤、孤立性纤维性肿瘤、胃肠道间质瘤、血管性肿瘤等常呈阳性,灵敏度较高,反之则不然,除内皮细胞及造血干/祖细胞外,CD34亦可表达于上皮祖细胞、纤维母细胞、Cajal间质细胞等,因此多种不同来源的软组织肿瘤中CD34均有不同程度的表达。临床诊断中,除根据光镜及免疫组织化学判断其大类之外,CD34阳性的病变及诊断难点常见于梭形细胞病变,其来源多为纤维母细胞,鉴别诊断主要包括纤维母细胞/肌纤维母细胞肿瘤、周围神经肿瘤、脂肪细胞肿瘤及不能确定分化的肿瘤。诊断时应注意:(1)CD34的染色模式为定位于细胞膜或胞质的棕黄色颗粒,特殊的染色模式如“指纹状”阳性可能为诊断提供线索。(2)由于其染色范围较广,判读时应注意区分背景中CD34阳性的细胞与真正肿瘤细胞。(3)肿瘤的去分化成分CD34强度可能弱于高分化成分。(4)单独应用CD34的诊断价值很有限,必须结合病史及镜下形态,联合其他血管内皮标志物、其他来源的多种标志物,甚至分子检测才能明确诊断。
所有作者均声明不存在利益冲突
1.以下哪项不是浅表性CD34阳性的纤维母细胞肿瘤的特点()
A.CD34弥漫强阳性表达
B.肿瘤细胞核具有明显多形性,常见核内假包涵体
C.肿瘤排列形式类似隆突性皮肤纤维肉瘤
2.以下肿瘤中CD34常阴性的是()
A.假肌源性血管内皮瘤
B.上皮样血管内皮瘤
C.多形性透明变性血管扩张性肿瘤
3.CD34可以阳性的细胞包括()
A.Cajal间质细胞
B.神经内膜的纤维母细胞样细胞
C.以上均是
4.CD34可帮助以下哪组肿瘤的鉴别()
A.上皮样肉瘤与癌
B.神经鞘瘤与神经纤维瘤
C.隆突性皮肤纤维肉瘤与浅表性CD34阳性的纤维母细胞肿瘤
5.关于胃肠道间质瘤,下列说法错误的是()
A.不同部位CD34阳性率不同
B.CD34阳性率高于CD117
C.梭形细胞型的CD34阳性率高于上皮样细胞型



























