
患者女,37岁。体检发现肺部病变,CT示右下肺多发实性结节状、团状影,行胸腔镜下右下肺楔形切除术。镜下示肿瘤组织由上皮及间叶成分构成,上皮成分主要为类似涎腺的浆黏液性腺泡以及衬覆呼吸上皮的腺体,间叶成分为一致的纤维性间质,无脂肪、平滑肌及软骨成分,细胞无异型性。免疫组织化学显示浆黏液性腺泡甲状腺转录因子1(TTF1)弱表达,未表达Napsin A,而衬覆呼吸上皮的腺体TTF1及Napsin A呈强表达;腺泡周围表达肌上皮标志物平滑肌肌动蛋白、S-100蛋白、Calponin及p63。间质成分表达雌激素受体及孕激素受体。病理诊断:肺浆黏液性错构瘤。发生于肺内的浆黏液性错构瘤非常罕见,具有独特的临床病理特点,需与其他良、恶性肺肿瘤鉴别。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,37岁。因检查发现肺部病变2周于2019年7月入院。无明显咳嗽咳痰、胸闷气促,无发热,无胸痛、咯血。胸部CT示右肺下叶前基底段见多发实性结节状、团状影,边缘光整,增强后强化不明显,考虑良性病变(图1)。入院后行胸腔镜下右下肺楔形切除术,术中探查示右胸腔内无明显粘连,无明显积液,肿块位于右下肺,呈串珠结节状,最大直径约3 cm,质偏硬。
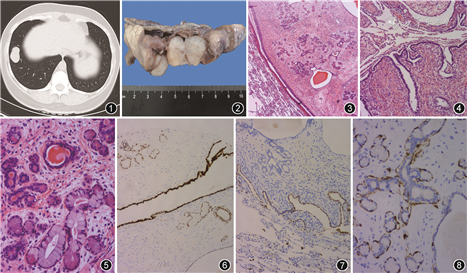

病理检查:楔形切除部分肺组织一块,大小9 cm×4 cm×3 cm,切面见一不规则结节状肿块,大小约3.5 cm×3.0 cm×2.0 cm,肿块切面灰白实性,质中,局部呈微囊状,与周围组织界限清,紧贴肺膜及断端(图2)。镜下观察:肿瘤与周围肺组织边界清楚,无包膜。肿瘤组织包含上皮及间叶成分,上皮成分为陷入的呼吸道上皮、浆液性腺泡、黏液性腺泡及导管上皮,浆黏液性腺体围绕小导管呈小叶状分布,部分腺体或导管扩张成小囊状,腔内可见红染的分泌物。间叶成分为纤维性间质,细胞形态为卵圆形或短梭形,并混杂少量炎性细胞。上皮及间叶细胞均无异型性,核分裂象罕见。肿瘤组织内未见软骨、平滑肌、脂肪等其他间叶成分(图3, 4, 5)。免疫表型:呼吸道上皮腺体、浆黏液性腺泡及导管均表达甲状腺转录因子1(TTF1,呼吸道上皮成分强表达,腺泡及导管成分弱表达),仅内陷的呼吸道上皮成分表达Napsin A,浆黏液性腺泡周围表达肌上皮标志物平滑肌肌动蛋白(SMA)、S-100蛋白、Calponin及p63。间质细胞表达雌激素受体(ER)及孕激素受体(PR),不表达SMA、S-100蛋白、Calponin及H-caldesmon(图6~8)。特殊染色:过碘酸-雪夫(PAS)染色提示部分腺泡阳性表达。
病理诊断:(右下肺)浆黏液性错构瘤。
肺内存在一大类良性腺瘤及错构瘤,对于含有黏液上皮成分的良性肿瘤有时与肺黏液腺癌鉴别较为棘手,尤其是在术中冷冻切片检查时极易误诊为恶性病变。浆黏液性错构瘤(seromucinous hamartoma)是2017年第4版《WHO头颈部肿瘤分类》新增加的一类良性肿瘤[1],是从以往的呼吸道上皮腺瘤样错构瘤(respiratory epithelial adenomatoid hamartoma)中独立出来的一类疾病,由Baillie和Batsakis[2]于1974年首次报道,是一类罕见的疾病,绝大多数发生在鼻腔及鼻咽部,而发生在肺内的浆黏液性错构瘤更为罕见,查阅国外文献目前仅检索到有2例[3, 4]。
呼吸道上皮腺瘤性错构瘤被认为是一类源自表面上皮呼吸道固有腺体的良性过度增生,其特点是小到中等大小的腺体增生,被一些间质所分隔,腺体与表面上皮相连,由复层纤毛呼吸上皮混合黏液细胞构成,部分腺体萎缩,被覆扁平及立方上皮,特征性的改变是腺体周围存在厚的嗜酸性基底膜,偶尔可见一些小的反应性的浆黏液性腺体。
浆黏液性错构瘤与呼吸道上皮腺瘤性错构瘤同属于呼吸道上皮性错构瘤范畴,不同于间叶组织起源的错构瘤如软骨间叶性错构瘤(chondromesenchymal hamartoma),以及混合性上皮间叶起源的错构瘤如软骨-骨和呼吸道上皮错构瘤(chondro-osseous and respiratory epithelial hamartoma)。浆黏液性错构瘤是一种固有浆黏液性腺体过度增生的良性肿瘤,组织学上肿瘤被覆呼吸道上皮,增生的浆黏液性腺体及导管呈小叶状或杂乱排列,腺体及导管被覆单层立方或扁平上皮,可形成扩张的小囊状结构,囊内可见红染的分泌物。往往在浆黏液性错构瘤中也可见到类似呼吸道上皮腺瘤性错构瘤的区域,表明两者可能属于同一谱系[5]。两者的主要区别在于呼吸道上皮腺瘤性错构瘤中的上皮是多层的,增生的腺管往往较拥挤,呈背靠背排列,表达基底细胞标志物。而浆黏液性错构瘤中的上皮是单层的,呈小叶状或杂乱排列,不表达或局灶表达基底细胞标志物。本例肿瘤组织与周围肺组织界限清楚,无包膜,由上皮及间质成分组成,上皮成分包括内陷呼吸上皮形成的腺体及拉长的裂隙结构,无腔内容物,表达Napsin A。浆黏液性腺泡围绕小导管呈小叶状增生或杂乱排列,部分呈扩张的小囊状结构,腔内可见红染的分泌物,不表达Napsin A。TTF1及Napsin A的表达证实存在陷入的呼吸道上皮成分,肌上皮标志物SMA、S-100蛋白、Calponin及p63的表达以及PAS染色阳性表明增生成分为浆黏液性腺体。间质成分为纤维性间质,表达ER及PR,而不表达S-100蛋白、SMA及H-caldesmon,这也提示间质内无软骨、脂肪和平滑肌组织,以上特点表明该肿瘤为一种发生在肺内类似鼻腔及鼻咽的浆黏液性错构瘤。
目前文献报道发生于肺的2例浆黏液性错构瘤具有相似的病理学特征[3, 4],其中1例为中年女性,肿瘤位于右主支气管内,呈息肉状生长,镜下表现为增生的浆黏液性腺体,表面被覆呼吸道上皮,细胞无异型性。另1例为老年男性,肿瘤位于右中叶支气管,呈息肉状生长,HE形态学表现为浆黏液性腺体及导管呈小叶状增生,表面被覆假复层呼吸道上皮,细胞无异型性,浆黏液性腺体周围表达肌上皮标志物S-100蛋白、Calponin及SMA,而间质成分表达PR。而本例肿瘤位于肺内呈结节状生长,呼吸道上皮成分与增生的浆黏液性腺体混杂在一起。这几例病例共性为肿瘤模拟呼吸道上皮及上皮下浆黏液性腺体的生长方式,是一种错构瘤。
由于该肿瘤发生率极低,目前对其认识有限,需要与发生于肺内的多种肿瘤或先天性畸形病变进行鉴别。(1)肺软骨瘤型错构瘤:是最常见的肺良性肿瘤。由占主要成分的软骨或软骨黏液样组织混杂其他不同比例的间叶成分,如结缔组织、平滑肌组织及脂肪组织,以及陷入的呼吸道上皮构成,上皮成分通常不明显,无浆黏液性腺体增生。有时软骨成分完全缺如,由立方状上皮、平滑肌组织及纤维组织构成,称之为纤维平滑肌瘤样错构瘤[6]。(2)先天性肺囊性腺瘤样畸形:是一种局限性先天性肺发育畸形,主要特征是细支气管特别是终末细支气管增生,组织学特点为大小不等的囊性结构,内衬呼吸上皮呈腺瘤样,间质内常可见横纹肌、平滑肌、软骨等成熟成分。分为1型(巨囊型,占50%~70%)、2型(微囊型,占20%~40%)和3型(实体型,约占10%)。1型包含单个或多个大的囊肿(直径常大于2 cm),囊壁被覆假复层纤毛柱状上皮,以及明显的平滑肌及弹性组织,三分之一的病例可见产黏液细胞。2型包含多个小的囊肿(直径小于1 cm),被覆纤毛立方及柱状上皮,少量不规则的平滑肌及弹力纤维,无软骨及黏液细胞。3型由实性成分构成,其内为毛细支气管样小囊(直径小于0.5 cm)和不规则的细支气管样结构,被覆立方或柱状上皮[7, 8]。(3)间叶性囊性错构瘤:肺间叶性囊性错构瘤是以多中心发生的囊肿和结节性病变为特征的一类罕见的肺疾病,囊壁表面大部分被覆正常呼吸上皮,上皮下为密集的原始间叶细胞,间叶细胞为短梭形或卵圆形,细胞核深染,胞质较少,核分裂象罕见。理论上,结节和囊肿代表同一疾病的不同阶段,结节最先出现,随着结节变大,尤其是在直径大于1 cm后,结节转变为囊肿,囊壁及结节部分区域可见成熟的脂肪细胞,囊壁内可见到厚的供血动脉[9]。(4)肺纤维腺瘤:又名肺腺纤维瘤,形态与乳腺纤维腺瘤十分相似,组织学上表现为境界清楚无包膜的双相肿瘤形态,由单一的上皮及间质成分混杂构成,上皮为立方或柱状上皮,间质为硬化的纤维母细胞样梭形细胞[10]。(5)叶内型支气管肺隔离症:是一种肺先天性发育异常,由异常体循环动脉供血的部分肺组织形成实性或囊性肿块,镜下常出现慢性炎、纤维化及血管闭塞性改变。(6)细支气管腺瘤:是组织学上与细支气管黏膜上皮相对应的一种良性肿瘤,具有以下病理特征:由含有连续基底细胞层的温和的双层细支气管型上皮的结节状增生。腔面细胞层则由黏液细胞、纤毛细胞、Clara细胞及肺泡细胞构成,根据黏液细胞和纤毛细胞所占腔面细胞的比例,将细支气管腺瘤分为近端型(proximal-type)和远端型(distal-type),远端型的腔面细胞中可缺乏黏液和纤毛细胞,甚至仅为Clara细胞或肺泡细胞。以往的纤毛黏液结节乳头状肿瘤被认为是近端型细支气管腺瘤的一种亚型[11]。(7)肺黏液腺腺瘤:一种起源于支气管黏液分泌细胞的良性肿瘤,主要发生在中央区支气管周围或支气管内,肿瘤境界清楚,常表现为高出支气管壁软骨板的外生性结节,镜下以富于黏液的囊腺性结构为主,囊腔被覆柱状、立方状或扁平的黏液分泌细胞,有时可见嗜酸细胞、透明细胞或纤毛上皮细胞,细胞形态温和,核常位于基底,梭形细胞丰富的间质带可伴有透明变性或明显的淋巴细胞、浆细胞浸润,肿瘤细胞表达广谱细胞角蛋白或上皮细胞膜抗原,而TTF1为阴性。(8)肺黏液腺癌:肿瘤细胞具有细胞内黏液(杯状和/或柱状细胞形态),细胞外黏液可有或无,常沿肺泡壁生长,也可表现为与非黏液腺癌类似的腺泡、乳头及微乳头等形态,细胞角蛋白(CK)7、CK20常阳性表达,而TTF1及Napsin A不表达。
尽管浆黏液性错构瘤极其罕见,但重要的是这是一种良性肿瘤,单纯性手术切除即可,预后极好。本例患者经随访12个月,身体状况良好,未出现复发及转移等情况。
所有作者均声明不存在利益冲突



























