
女性生殖道血管周上皮样细胞肿瘤(PEComa)近年来逐渐成为妇科病理学中的研究热点,其在组织学、免疫表型以及分子遗传学特点上均具有明显的异质性,且鉴别诊断谱系宽阔,诊断误区和陷阱也较多,准确的诊断和预后评估具有重要的临床病理意义。女性生殖道PEComa的诊断需要具有典型的组织学和免疫表型特征,而整合分子遗传学检测手段将有助于进一步精准区分PEComa与其他具有黑色素分化的女性生殖道间叶性肿瘤。结合近年来的相关文献以及日常诊断经验,该文简要介绍女性生殖道PEComa的临床病理新进展,着重强调其组织学诊断和鉴别诊断,分子遗传学特征以及生物学行为的评估,以期加深国内病理医师对该肿瘤的认识。

血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)是一种组织来源尚不明确的间叶性肿瘤,形态学上主要由与血管壁关系密切的血管周上皮样细胞组成,免疫组织化学染色显示特征性的共表达黑色素细胞和平滑肌细胞分化标志物[1, 2]。PEComa的发病部位宽广,几乎全身各处均可发生,女性生殖道等器官是其相对较为好发的部位之一[3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13]。随着对该肿瘤瘤谱认识的不断深入,女性生殖道PEComa近年来逐渐成为妇科病理学中的研究热点,新近第5版WHO软组织肿瘤和女性生殖系统肿瘤分类均对PEComa的相关内容做了较大幅度的更新[1, 2]。女性生殖道PEComa的组织学表现和免疫表型变化多端,分子遗传学上存在明显的异质性,鉴别诊断谱系宽阔,生物学行为难以预测,因此经常容易导致诊断和鉴别诊断的困惑。结合近年来的相关文献以及日常诊断经验,本文简要介绍女性生殖道PEComa的临床病理新进展,着重强调其组织学诊断和鉴别诊断,分子遗传学特征以及生物学行为的评估,以期对国内病理医师深入认识该肿瘤有所帮助。
女性生殖道PEComa约占所有PEComa的25%,其中子宫体是最常见的部位(约72%),其次为宫颈(约11%),其他少见部位包括女性附件、阴道、阔韧带以及外阴等[4, 5, 6, 7, 8]。发病年龄6~79岁,高峰年龄在50~70岁,而发生在阴道、外阴以及阔韧带的PEComa往往发病年龄较轻,中位年龄20~28岁[4, 5]。临床表现非特异,包括异常子宫出血、腹部盆腔肿块以及影像学上诊断为“子宫肌瘤”等,偶尔可表现为子宫破裂,尤其是与妊娠相关者。约10%与结节性硬化症(TSC综合征)有关,尤其是当累及生殖道和盆腹腔多个器官时,又称为PEComa瘤病(PEComatosis)[6]。肿瘤最大径0.2~25.0 cm(平均约6.5 cm),大体上边界通常清楚,无包膜,偶尔可表现为明显的浸润;质地通常较软而易碎,少数病例因富于胶原性间质而质地较硬;切面灰白、灰黄或灰褐,可见出血和坏死[4, 5, 6, 7, 8](图1)。子宫的PEComa通常位于肌壁间,部分病例可表现为带蒂或宽基的息肉样肿物凸入宫腔[10,13]。PEComa瘤病的主瘤体通常位于子宫,常累及的部位包括卵巢、淋巴结、阔韧带、网膜、腹膜以及小肠壁等[6]。
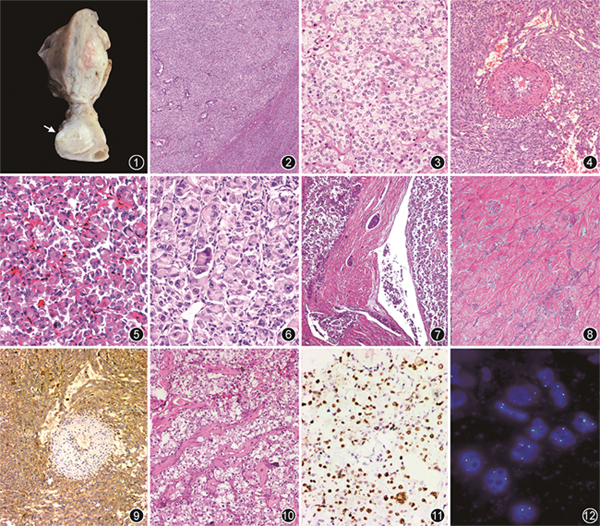

镜下,肿瘤可呈现界限清楚的推挤状边界(图2)或类似于低级别子宫内膜间质肉瘤的舌状侵蚀状边界,常见收缩裂隙[2,4, 5, 6, 7, 8, 9, 10, 11, 12, 13]。瘤组织呈实性片状、模糊的巢状、假腺泡状、束状或少见的梁状、索状以及旋涡状排列,间质通常可见丰富的薄壁血管网(图3),部分病例可见血管外皮瘤样以及淋巴管平滑肌瘤样结构,厚壁血管相对不常见,出现时多位于肿瘤的周边[8, 9, 10, 11, 12, 13],约25%的病例显示PEComa特征性的瘤细胞围绕畸形厚壁血管呈放射状排列的生长方式[4](图4)。肿瘤细胞以上皮样形态为主伴有多少不等的梭形细胞,上皮样瘤细胞胞界较清,胞质丰富嗜酸性或浅染、透明,仔细观察常见局灶的胞质朝向细胞核皱缩(“蜘蛛样”细胞),少数瘤细胞可见深而嗜酸性的胞质、偏位的核伴显著的核仁,类似于横纹肌样细胞,偶尔可见泡沫状胞质或胞质内黑色素沉积[8, 9, 10, 11, 12, 13](图5,6)。瘤细胞异型性通常较轻微,核圆形或卵圆形,染色质开放,可见小核仁,核分裂象多少不等;部分病例可见显著异型的核、多核伴有大而嗜酸性的核仁,类似于黑色素瘤所见的核仁(图6),少数病例可见杜顿型巨细胞以及核内包涵体等。部分病例可见肿瘤性坏死以及淋巴管和血管内瘤栓(图7)。瘤细胞间质常见多少不等的胶原沉积伴或不伴有玻璃样变性,当肿瘤显示广泛的间质硬化、瘤细胞呈条索状排列时,称之为硬化性PEComa(图8),该型PEComa多见于后腹膜,但亦可见于子宫和附件[13, 14]。
PEComa显示特征性的共表达黑色素和肌源性分化标志物,但不同标志物的表达灵敏度、特异度以及范围和强度均有差异。通常来说,以上皮样瘤细胞为主的PEComa常更强且弥漫的表达黑色素标志物而肌源性标志物表达相对较弱或局灶,以梭形细胞形态为主者表达肌源性的标志物较黑色素标志物更强而广泛[3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13]。PEComa常表达的黑色素标志物包括组织蛋白酶K(CathespinK)、HMB45、Melan A、小眼转录因子(MiTF)以及PLN2等[3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15](图9),肌源性标志物包括平滑肌肌动蛋白(SMA)、结蛋白以及h-caldesmon等。黑色素标志物中以CathepsinK和HMB45的表达比例最高(灵敏度最高)[10, 11, 12, 13],CathepsinK在几乎所有的女性生殖道PEComa中均表达,通常为弥漫而强的胞质表达,HMB45在90%以上的病例中表达,但染色范围差异较大,有时仅有局灶或单个散在的瘤细胞表达[10, 11, 12, 13]。虽然MelanA在仅约2/3的女性生殖道PEComa中表达,且染色通常较HMB45弱而局灶,但其诊断的特异度较高[2,10, 11, 12, 13]。MiTF在女性生殖道PEComa中的表达率约83%,但常较弱或局灶,缺乏足够的灵敏度和特异度[5]。PLN2是新近认识的一种与黑色素细胞或MiTF相关肿瘤的标志物,其在约86%的子宫PEComa中显示不同比例的胞质表达[15]。需要注意的是,黑色素标志物并非PEComa所特有,少数平滑肌源性肿瘤亦可表达,但通常局灶表达且仅表达1个黑色素标志物。因此,在组织学特征模棱两可的情况下,明确诊断PEComa通常需要至少表达2个黑色素的标志物,尤其是在仅为局灶表达的情况下更是如此[4,16]。
约35%的子宫PEComa表达TFE3蛋白,可从局灶弱表达至弥漫强表达不等;其中仅少数病例与TFE3基因重排相关,通常显示强而弥漫表达TFE3表达[12]。PEComa通常至少表达SMA、结蛋白和H-caldesmon等3个肌源性标志物中的1个,染色强度通常较弥漫,表达比例分别为90%(SMA)、76%(结蛋白)和75%(h-caldesmon),而与TFE3基因重排相关的PEComa通常不表达上述肌源性标志物[2,4,12]。约50%的女生生殖道PEComa表达雌激素受体(ER),85%表达孕激素受体(PR),PR较ER表达通常更强而弥漫。PEComa罕见可局灶表达细胞角蛋白(CK)、CD10和S-100蛋白,一般不表达PAX8和SOX10[4,10, 11, 12, 13]。
分子生物学分析证实PEComa是一种遗传学异质性的肿瘤,不同遗传学特征的肿瘤具有明显不同的临床病理特点和预后,目前主要分为3种类型:(1)结节性硬化复合体(TSC)异常;(2)TFE3基因重排;(3)RAD51B基因重排及其他罕见的基因融合[17]。
大多数的PEComa表现为TSC的失活突变,TSC是一种肿瘤抑制基因,包括TSC1(位于9q34)和TSC2(位于16p13),失活的TSC通过活化PI3K/AKT/mTOR信号路径从而发挥其促进肿瘤发生的功能[4, 5,17, 18]。TSC基因突变既可发生在与TSC综合征相关的PEComa中,亦可发生于散发性病例,其中以TSC2突变为主,TSC1突变罕见[4, 5]。Pan等[18]通过比较基因组学分析发现,PEComa中存在TSC2基因所在的第16号染色体短臂(16p)缺失以及TSC2基因杂合性缺失和mTOR激活。Agaram等[17]应用多重分子检测平台发现,总体上约62%的PEComa显示TSC2基因突变,在除去伴有TFE3基因重排的PEComa之后,TSC2的突变率可达80%,突变的形式包括无义突变、错义突变、框码易位以及缺失突变等,TSC2突变的PEComa中约63%共存有TP53突变。比较基因组学分析同样发现PEComa中存在TP53所在的第17号染色体短臂(17p)缺失,此外在肾脏的PEComa中,p53过表达和TP53突变通常见于具有纯的上皮样形态的病例中而罕见于经典的血管平滑肌脂肪瘤中,上述证据提示TSC2缺失似乎是PEComa家族肿瘤中的一种早期分子改变,而其他的分子异常(如TP53突变等)是决定肿瘤生物学行为的更重要原因。而涉及TFE3基因重排的PEComa中均未见TSC基因突变,提示TSC基因突变与TFE3基因重排在PEComa中是相互排斥的分子遗传学事件[17]。
TFE3(Xp11.2)基因重排最初认为是腺泡状软组织肉瘤(ASPS)以及Xp11.2易位性肾细胞癌特征性的驱动分子事件,后来发现该基因重排可出现在14%~24%的PEComa中[12,17,19]。如前所述,TFE3基因重排的PEComa具有独特的临床病理特征和分子遗传学特征,组织学上绝大多数由纯的上皮样细胞组成,偶尔混有少量梭形细胞,瘤细胞胞质丰富,浅染或透明,常见局灶的黑色素沉积,以巢状或假腺泡状排列为主,无明显的血管周上皮样细胞聚集趋势,无显著的核多形性,核分裂象通常较少,偶尔可较活跃[12,17,19](图10)。免疫组织化学染色通常弥漫强表达CathepsinK、TFE3(图11)和HMB45,局灶或不表达Melan A,往往不表达MiTF以及肌源性标志物[2,12,17,19]。明确诊断TFE3基因重排的PEComa需要借助分子遗传学手段,尤其是荧光原位杂交(FISH)证实存在TFE3基因断裂[12](图12)。靶向外显子测序以及DNA、RNA基因表达谱分析发现TFE3基因重排的PEComa均未见TSC1/2和TP53基因突变,提示TSC1/2突变与TFE3基因重排在PEComa中是相互排斥的分子遗传学事件,揭示TFE3基因重排的PEComa可能是不同于传统PEComa的一种独特类型[17]。新近,Wang等[20]应用多重分子遗传学技术、基因表达谱分析、聚类分析以及随访分析表明TFE3基因重排的PEComa与ASPS存在明显的相似性,提示两者可能是同一瘤谱的不同表现形式,并建议将TFE3基因重排的PEComa命名为色素性Xp11.2易位性肿瘤[20, 21]。在TFE3基因重排的PEComa中,TFE3基因最常见的融合伴侣基因为SFPQ/PSF(约占80%)[20, 21]。
此外,在PEComa中新近发现少数病例存在重现性的RAD51B基因重排,该基因位于14q23-24.2,融合的伴侣基因包括OPHN1(位于Xq12)以及RRAGB(位于Xp11.21)[13,17]。到目前为止,文献中所报道的4例伴有RAD51B基因重排的PEComa均发生于子宫,尽管其组织学表现各异,但均可见活跃的核分裂象以及呈现出侵袭性的生物学行为[13,17]。部分病例同时存在TP53和TSC2突变,提示与TFE3基因重排不同,RAD51B基因重排与TSC突变不是互相排斥的分子事件[17]。对于RAD51B基因重排的PEComa尚需要积累更多的病例来准确的阐述其临床病理和分子遗传学特征。
女性生殖道PEComa的鉴别诊断谱系宽阔,诊断误区和陷阱较多。取决于瘤细胞的构成以及生长方式的不同,其鉴别诊断主要包括:(1)平滑肌源性肿瘤:组织学上,平滑肌瘤的瘤细胞胞质呈致密的嗜酸性而非颗粒状,常见核端空泡,间质可见弥漫散在分布的厚壁血管,而厚壁血管在PEComa中多位于肿瘤的周边,平滑肌瘤无PEComa特征性的薄壁血窦样血管。如前所述少数平滑肌源性肿瘤(包括平滑肌和平滑肌肉瘤)可表达前述的黑色素标志物,但通常较局灶和弱,且一般仅表达1个黑色素标志物[4,22, 23, 24]。分子遗传学上子宫平滑肌瘤常见的遗传学异常包括MED12基因突变,HMGA1/2基因重排,COL4A5/6缺失以及FH基因突变等[25],而子宫平滑肌肉瘤常见MED12、ATRX以及TP53基因突变等[26]。新近描述了一种伴有PRG基因重排、以上皮样细胞为主的平滑肌肉瘤,组织学上常见横纹肌样细胞,与恶性PEComa存在一定的重叠性,但免疫组织化学染色常弥漫表达ER和PR,不表达HMB45可资鉴别[27]。新近,Selenica等[16]报道了15例至少表达1个黑色素分化(HMB45、Melan A、MiFT)的高级别子宫间叶性肿瘤,其中大多数(76%)亦表达平滑肌源性标志物(SMA和结蛋白),通过综合性的临床病理分析并结合FISH、RNA测序以及DNA测序分析发现,15例肿瘤可分为4个类型:恶性PEComa(4例),平滑肌肉瘤(6例),具有杂合性PEComa和其他肉瘤(包括平滑肌肉瘤和子宫内膜间质肉瘤)特征的肿瘤(3例)以及非特殊类型肉瘤(2例)。因此,具有黑色素细胞分化的子宫间叶性肿瘤具有明显的异质性,子宫PEComa的诊断需要典型的组织学特征和免疫表型特征,在此前提条件下,分子遗传学特征(包括TSC2突变、TFE3基因重排及RAD51B基因重排等)可帮助进一步明确诊断。在组织学和免疫表型特征诊断均不足以诊断为PEComa但又不能明确为其他类型的肿瘤时,可诊断为“伴有黑色素细胞分化的子宫间叶性肿瘤,建议进行分子遗传学检测予以明确诊断”[16]。(2)ASPS:女性生殖道是ASPS好发的部位之一,子宫体、宫颈、阴道和外阴等部位均可发生。与TFE3基因重排的PEComa不同,ASPS通常无梭形细胞,瘤细胞胞质内可见PAS染色阳性的棒状结晶,无黑色素沉积。免疫组织化学染色弥漫强表达TFE3蛋白,不表达黑色素分化和肌源性标志物,遗传学上显示TFE3基因重排,TFE3的融合伴侣基因多为ASPSCR1[20, 21,28]。(3)黑色素瘤:女性生殖道原发或转移的黑色素瘤可与PEComa混淆。黑色素瘤由黏附性差的上皮样或致密的梭形细胞组成,常见胞质内色素沉积,瘤细胞具有大而嗜酸性的核仁,核分裂象活跃,免疫组织化学染色除了表达黑色素标志物之外,通常弥漫表达S-100蛋白和SOX10,罕见表达肌源性标志物。
2020年WHO女性生殖系统肿瘤分类[2]提出预测PEComa生物学行为的临床病理变量主要有5个:肿瘤直径≥5 cm,高核级别,核分裂象>1个/50 HPF,存在肿瘤性坏死、存在淋巴管或血管浸润。当肿瘤存在3个或3个以上上述特征时,生物学行为为恶性;当肿瘤仅有2个或2个以下特征时,生物学行为为恶性潜能未定(UMP);应避免诊断“良性”PEComa[2,13]。迄今为止有限的数据表明,具有TFE3基因重排和RAD51B基因重排的PEComa,无论组织学类型,往往倾向于显示侵袭性的生物学行为[12, 13,17,20]。对于局限性的PEComa,手术完整切除是主要的治疗手段。对于恶性、复发或手术不可完整切除的病例,基于PEComa中常见的mTOR信号通路的活化,因而提出了mTOR抑制剂靶向治疗的可能性,并且在临床上显示了一定程度的疗效反应,常用的mTOR抑制剂包括西罗莫司(sirolimus)、依维莫司(everolimus)等[2,4, 5,29]。
女性生殖道PEComa的诊断需要具有典型的组织学和免疫表型特征,而整合分子遗传学检测手段将有助于进一步精准区分PEComa与其他具有黑色素分化的女性生殖道间叶性肿瘤[16]。而对于PEComa与平滑肌源性肿瘤的确切关系、涉及TFE3基因重排以及RAD51B基因重排的PEComa的预后和治疗意义尚需积累更多的研究经验[12, 13,17,20]。
所有作者均声明不存在利益冲突



























