
甲状腺原发性鳞状细胞癌临床少见,而甲状腺低分化癌合并鳞状细胞癌极罕见,此例患者肿瘤具有甲状腺低分化癌及鳞状细胞癌组织学特点,且两种肿瘤存在相互过渡、移行现象,提示可能存在甲状腺滤泡上皮鳞状化生、癌变过程。PAX8免疫组织化学标记有助于原发性甲状腺鳞状细胞癌的诊断。

患者女,76岁。因“发现颈部包块10余年,声嘶3个多月,吞咽困难1个月余”于2020年6月2日就诊于贵州省毕节市第一人民医院。既往于当地医院治疗无好转(具体不详)。查体:甲状腺右侧叶触及大小6 cm×5 cm×3 cm包块,质稍硬、边缘不清,形态不规则,随吞咽上下活动;CT示甲状腺双侧叶混杂密度结节,考虑恶性可能性大;其余检查结果阴性。术中探及右侧甲状腺被6 cm×5 cm×5 cm巨大质硬包块占据,横跨峡部、界欠清、活动度差。探及甲状腺左侧叶2 cm×2 cm×2 cm实性包块,质韧、界欠清、活动度差。术中冷冻切片诊断:(右侧及峡部)甲状腺滤泡癌合并鳞状细胞癌;(左侧)结节性甲状腺肿伴钙化,未见肿瘤累及。遂切除肿物送病理。
病理检查:灰褐肿块一个,大小7 cm×7 cm×4 cm,切面黄褐实性、质脆,部分区域可见出血坏死。镜下观察见肿瘤由2种成分组成:(1)肿瘤细胞以实性、岛状排列为主,部分区域呈小梁状排列(图1),瘤细胞大小形态一致,圆形或卵圆形,核中等大,无核沟及核内假包涵体,灶状区域细胞核大,异型性明显,部分细胞巢内可见小滤泡结构,可见肿瘤性坏死及包膜侵犯(图2);(2)鳞状细胞癌区域(约占肿瘤的20%)癌细胞大,胞质丰富,核大深染,核质比增大,核分裂象多见,可见细胞间桥、角化珠和不全角化细胞(图3)。经充分取材、制片,可见两种癌相互过渡移行区域,分界不清(图4)。免疫表型上,实性、岛状、梁状排列的肿瘤细胞甲状腺球蛋白(Tg)、甲状腺转录因子(TTF)1、PAX8、bcl-2、E-cadherin均阳性,细胞角蛋白(CK)19部分细胞阳性,降钙素、嗜铬粒素A(CgA)、突触素、癌胚抗原(CEA)、白细胞共同抗原(LCA)、p53均阴性,Ki-67阳性指数约15%,肿瘤细胞巢之间的纤维血管间隔CD34阳性(图5)。鳞状细胞癌肿瘤细胞CK5/6、p40、p63、CK19、p53、PAX8(图6)阳性,Tg、TTF1、CD5、CD117阴性,Ki-67阳性指数约35%。
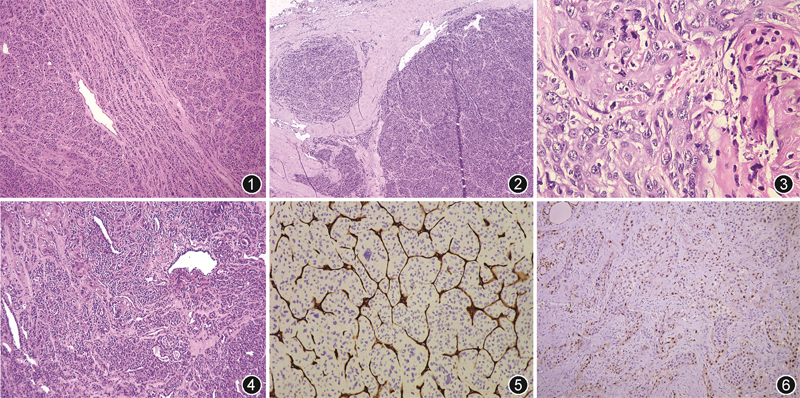

病理诊断:(右侧甲状腺及峡部)原发性甲状腺低分化癌合并鳞状细胞癌。
讨论:甲状腺低分化癌是一种显示滤泡细胞分化,系统性和生物学行为介于分化性癌(甲状腺乳头状癌及滤泡癌)和未分化癌(间变性癌)之间的甲状腺癌[1]。临床少见,男女之比约1.0∶1.5,患者大多>50岁,平均年龄55~63岁。临床表现为孤立性大的甲状腺肿块,瘤体较大时可出现吞咽及呼吸困难,一般无声音嘶哑;B超和CT检查对判断肿瘤良恶性及观察肿瘤与周围组织关系有一定帮助;大体观肿瘤较大,中位直径5 cm,实性,切面浅棕色或灰色、质软、可见出血坏死;镜下主要表现为3种组织学形态,即岛状、梁状和实体性,或在乳头状结构或滤泡结构背景中出现岛状、实体性成分(即使出现10%的甲状腺低分化癌成分也需要发病理诊断报告)[2]。岛状形态为境界清楚的肿瘤细胞巢被薄层纤维血管间隔围绕;梁状形态为癌细胞排列成索状或缎带状;实体形态则为大片块肿瘤细胞,偶尔可见小滤泡。除上述结构,肿瘤还可见包膜血管侵犯、出血坏死。免疫表型:无特异标志物,癌细胞主要表达CKpan、PAX8、TTF1、Tg。本例冷冻切片下见肿瘤细胞呈实性片状、巢团状分布,细胞巢间可见小滤泡结构,间质纤维血管显示不清,肿瘤侵犯包膜,误诊为甲状腺滤泡癌合并鳞癌。廖谦和和安慧敏[3]报道1例甲状腺岛状癌冷冻切片病理误诊为髓样癌,文献报道的甲状腺低分化癌也较少,可能与大家对其认识不够有关。
目前国际公认的甲状腺低分化癌Turin(2007)诊断标准[4]如下:(1)实体性/小梁状/岛状生长模式;(2)无甲状腺乳头状癌的核特征;(3)具备以下3个特点之一:卷曲核、肿瘤性坏死、核分裂数≥3个/10 HPF。本例镜下形态符合以上标准,结合免疫组织化学表型,甲状腺低分化癌诊断成立。
主要鉴别诊断:(1)甲状腺髓样癌:肿瘤细胞可呈实性巢状、岛状排列,细胞较小且较一致,易与低分化癌混淆,但髓样癌的肿瘤组织中淀粉样物刚果红染色阳性,肿瘤细胞降钙素、CgA、突触素、CEA阳性,Tg阴性。(2)甲状腺滤泡癌:滤泡癌多见滤泡状结构,可见甲状腺胶质,但无低分化癌的“岛状”结构。(3)实性甲状腺乳头状癌:主要由实性片状排列的肿瘤细胞构成,具有乳头状癌典型的核特征。(4)甲状腺未分化癌:肿瘤分化差,瘤细胞呈梭形、上皮样、多形性,可见瘤巨细胞、破骨细胞样巨细胞,核分裂象多,肿瘤细胞CKpan、波形蛋白、p53阳性,Tg阴性。(5)甲状腺转移癌:可根据Tg免疫组织化学结果鉴别,转移癌Tg阴性,低分化癌Tg阳性。
本例合并甲状腺鳞状细胞癌,临床罕见。原发性甲状腺鳞状细胞癌患者发病年龄一般为50岁以上,发病率占所有甲状腺恶性肿瘤的1%左右,男女比例相当[5],临床主要表现为颈部肿块、声嘶、呼吸及吞咽困难,进展快,预后差,患者中位生存期为6~9个月[6]。正常甲状腺组织内无鳞状上皮成分,关于原发性甲状腺鳞状细胞癌组织起源主要有以下2种假说:(1)由胚胎发育过程中残留的后腮体、鳃弓或甲状舌管组织残留的鳞状细胞癌变而成。(2)由慢性炎性病变刺激引起甲状腺滤泡上皮鳞状化生、癌变所致。此外,有学者认为可能是甲状腺滤泡上皮失分化的结果[7]。本例甲状腺低分化癌与鳞状细胞癌存在相互过渡、移行现象,提示可能存在甲状腺滤泡上皮鳞状化生、癌变过程。
诊断原发性甲状腺低分化癌合并鳞状细胞癌首先需排除其他部位鳞状细胞癌转移至甲状腺。Suzuki等[8]认为PAX8免疫组织化学标记有助于原发性甲状腺鳞状细胞癌的诊断,Koyama等[9]研究发现,甲状腺原发性纯鳞状细胞癌不表达PAX8,当合并其他癌成分时,PAX8阳性表达。本例未发现甲状腺外鳞状细胞癌,肿瘤细胞PAX8阳性,支持上述观点。其次鳞状细胞癌区域需与甲状腺呈胸腺样分化癌鉴别:肿瘤以鳞状细胞样或合体样细胞及淡嗜酸性胞质为特点[10]。核椭圆形、空泡状,可见明显小核仁;肿瘤细胞巢和间质常见不等量小淋巴细胞和浆细胞浸润;肿瘤细胞CD5、CD117阳性。
原发性甲状腺鳞状细胞癌对放、化疗不敏感,恶性度高,疗效差,积极彻底的手术治疗能使患者获益,术后分子靶向治疗及免疫治疗可能是其未来发展方向[11]。本例根据患者病情及诉求,术后给予左甲状腺素片内分泌抑制治疗,随访2个月死亡。甲状腺低分化癌合并鳞状细胞癌总体进展快、预后差,临床及病理医师应提高对其认识,总结更多经验。
所有作者均声明不存在利益冲突



























