
颅内黏液样间叶性肿瘤是一种罕见的肿瘤,分子遗传学伴EWSR1与CREB家族基因融合。本文报道1例9岁男性患儿,小脑占位性病变,肿瘤结节状生长,界限清楚,肿瘤细胞椭圆形、梭形或星芒状,疏密不等,大部分呈条索状或疏松网状分布于黏液性间质中,间质内可见“石棉样”纤维,局灶细胞较丰富,呈片状排列。免疫组织化学结果:波形蛋白阳性,结蛋白及CD68部分阳性,上皮细胞膜抗原及CD99弱阳性,胶质纤维酸性蛋白、Olig2、S-100蛋白、平滑肌肌动蛋白、p63、CD34等均阴性,p53野生型表达,热点区Ki-67阳性指数约20%。分子表型:荧光原位杂交检测到EWSR1基因分离,二代测序检测出EWSR1-CREB1及SELENOW-EWSR1融合基因。病理诊断为伴EWSR1-CREB1融合的颅内黏液样间叶性肿瘤。术后7个月,患者状态良好,无复发及转移。诊断时应与脑膜瘤、胶质瘤、伴EWSR1-CREB家族基因融合的其他肿瘤及骨外黏液样软骨肉瘤等形态相似的肿瘤鉴别。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患儿男,9岁。无明显诱因出现恶心、呕吐1个月余,当地以“胃肠道疾病”治疗,恶心呕吐稍好转,但仍间断出现,同时出现低热。家属发现其无意识的颈左偏,患儿自诉无颈部不适。为进一步治疗于2020年12月就诊于北京大学国际医院。头部CT、磁共振成像显示右侧小脑半球、桥臂占位性病变,肿瘤边界清晰,大小约3.5 cm×2.5 cm,增强扫描显示明显强化(图1)。临床行后正中入路颅内占位切除术,术中见肿瘤位于小脑、脑桥处,分离肿瘤边界后分块全切肿瘤。
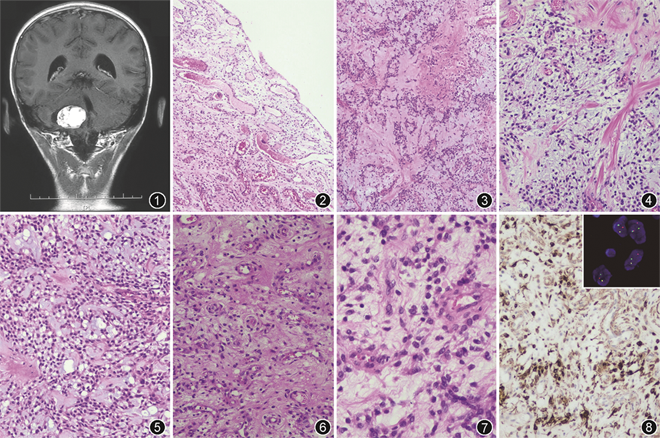

病理检查:送检灰白、灰粉色不整形组织一堆,体积约3.5 cm×2.5 cm×1.5 cm,部分似有包膜,切面灰白实性质稍韧、部分半透明。镜下观察:低倍镜下肿瘤呈模糊的结节状,有纤细的纤维包膜,包膜内未见淋巴细胞鞘(图2),肿瘤细胞疏密不等,大部分区域较稀疏,呈网状或索条状分布于富含黏液的间质中(图3),间质内可见“石棉样”纤维(图4);部分区域细胞较丰富,呈巢片状排列(图5),局灶血管丰富(图6)。高倍镜下肿瘤细胞呈椭圆形、短梭形或星芒状,形态温和,胞质淡嗜酸性,胞核圆形、卵圆形,无明显异型性,核分裂象罕见(图7)。免疫组织化学:波形蛋白阳性,结蛋白(图8)及CD68部分阳性,上皮细胞膜抗原(EMA)及CD99弱阳性,CD34血管阳性,ATRX无缺失,p53野生型表达,胶质纤维酸性蛋白(GFAP)、Olig2、IDH1R132H、NeuN、突触素、S-100蛋白、广谱细胞角蛋白(CKpan)、p63、平滑肌肌动蛋白(SMA)、Myogenin、MyoD1、STAT6、brachyury阴性,热点区Ki-67阳性指数约20%。荧光原位杂交(FISH)检测结果:EWSR1基因分离探针检测到红、绿信号分离(图8右上角),提示存在EWSR1基因重排。分子检测结果:对808个肿瘤相关热点基因及114个遗传性肿瘤基因进行二代测序,检测到EWSR1-CREB1(E7:E6)融合基因及SELENOW-EWSR1(E1:E8)融合基因。
病理诊断:伴EWSR1-CREB1融合的颅内黏液样间叶性肿瘤。
随访:患者术后行放疗25次,未行化疗,随访7个月,状态良好,无复发及转移。
讨论:软组织肿瘤中,大部分融合基因和某种特定的肿瘤类型相关,可以作为辅助诊断的分子标志物。但也有一些融合基因可以存在于不同组织学形态的肿瘤中,比较著名的就是EWSR1与CREB家族的基因融合。CREB家族是碱性亮氨酸拉链(bZIP)转录因子超家族的亚家族,包括3个基因:CREB1、ATF1和CREM[1]。伴EWSR1-CREB家族基因融合的肿瘤主要有以下几种类型:(1)血管瘤样纤维组织细胞瘤(AFH):形态学表现为厚的纤维包膜、淋巴细胞鞘,梭形或组织细胞样的肿瘤细胞呈结节状或片状排列,肿瘤内常有不规则假血管腔隙,间质慢性炎性细胞浸润。当AFH中黏液样区域占60%以上时称为黏液型AFH[2],黏液样背景中可见梭形及星芒状的肿瘤细胞呈网状或条索状排列[3]。(2)原发性肺黏液样肉瘤:形态与黏液型AFH极为相似。(3)软组织透明细胞肉瘤与胃肠道透明细胞肉瘤样肿瘤:二者形态相似,肿瘤细胞排列成束状、巢状或片状,细胞多边形、卵圆形或胖梭形,胞质嗜酸性、少数透明,核圆形、卵圆形,可见明显的核仁,部分软组织透明细胞肉瘤瘤细胞内可见色素,而胃肠道透明细胞肉瘤样肿瘤瘤细胞内无色素[4, 5]。(4)涎腺玻璃样变透明细胞癌:单一的胞质透明的多边形肿瘤细胞,核圆形、偏位,常见小核仁,肿瘤细胞排列成片状、巢状或条索状,间质由粗的胶原纤维带构成[5]。
2017年Kao等[1]首次描述了4例发生于颅内的伴EWSR1-CREB家族基因融合的肿瘤,镜下呈结节状生长,边界清楚,广泛的黏液背景中可见肿瘤细胞呈网状或条索状排列,间质可见“石棉样”纤维,肿瘤细胞梭形、星芒状,形态温和,表达结蛋白和EMA,与上文中已报道的伴EWSR1-CREB家族基因融合的肿瘤具有不同的形态。建议作为一个独立的肿瘤实体命名为“伴EWSR1-CREB家族基因融合的颅内黏液样间叶性肿瘤(IMMT)”。随后几年,不同学者陆续报道了十余例颅内类似的肿瘤,发现其好发于儿童和青少年,少数发生于成人,可位于颅底、小脑、脑室、大脑凸面等部位。影像学MRI显示肿瘤境界清楚,T1低信号,T2高信号,均匀或混杂密度,部分病例伴囊性变,增强扫描显示明显强化,部分病例肿瘤周边脑水肿明显,影像学需要与脑膜瘤、毛细胞星形细胞瘤、室管膜瘤、转移瘤等鉴别[6]。组织形态与黏液型AFH有部分重叠,但不具有厚的纤维包膜、淋巴细胞鞘及假血管样含血腔隙等AFH的一般特征,免疫组织化学波形蛋白弥漫强阳性,多数病例表达结蛋白、EMA、CD99和CD68,不表达GFAP、Olig2、SSTR2、孕激素受体及其他肌源性标志物,不同病例间增殖指数和核分裂象差异较为明显,但一般较低。因病例较少,尚不能得出准确的长期预后数据。手术切除是首选的治疗方法,术后可辅以放疗。是否切除完整和肿瘤生长速度是影响预后的因素,文献报道生存期最短的患者术后1个月因肿瘤进展死亡,最长随访13年仍无复发[6, 7]。
鉴别诊断:(1)脑膜瘤:IMMT与脑膜瘤的发病部位和影像学特征有部分重叠,组织学上微囊型脑膜瘤伴黏液变性和脊索样脑膜瘤,可见肿瘤细胞在黏液背景中呈条索状排列,与IMMT有一定相似性。脑膜瘤表达SSTR2、孕激素受体等免疫标志物,而无EWSR1基因易位可与之鉴别。(2)胶质瘤:小脑易发生低级别胶质瘤或混合性胶质神经元肿瘤,肿瘤境界较清楚,间质可黏液变性,GFAP、Olig2、突触素等免疫标志物阳性及EWSR1融合基因阴性可与IMMT鉴别。(3)骨外黏液样软骨肉瘤(EMC):多数位于深部软组织,好发于肢体近端,特别是下肢,偶有发生于手指、颅内、腹膜后或盆腔的报道。镜下呈多结节状生长,可有纤维性包膜,黏液背景,肿瘤细胞条索状排列,无特异性免疫组织化学标志物,EMC不表达结蛋白和EMA,NR4A3基因易位是其特征性的分子遗传学标志物[5,8]。(4)原发性肺黏液样肉瘤(PPMS)转移:PPMS好发于年轻成年女性,低倍镜下呈分叶状,肿瘤与支气管关系密切,可向周围肺实质浸润。组织学形态与IMMT及黏液型AFH极为相似。目前报道的PPMS仅发现EWSR1与CREB1形成融合基因,免疫组织化学表达波形蛋白,部分病例表达EMA,不表达CKpan及结蛋白[9]。PPMS罕见,呈低度恶性,有发生脑转移的病例报道[9],诊断时需要结合影像学及临床病史综合分析。
对于IMMT是一种新的肿瘤实体还是发生于颅内的黏液型AFH尚存在一定的争议[8,10, 11]。鉴于组织形态、免疫表型和分子遗传学的相似性,有学者将IMMT与颅内发生的AFH样肿瘤(包括经典型AFH及其他亚型),统称为“颅内间叶性肿瘤,FET-CREB融合阳性”[6]。这一疾病名称已作为一种新的暂定分类被2021年第5版WHO中枢神经系统肿瘤分类收录[12]。
IMMT是罕见肿瘤,需要结合影像学、组织形态、免疫组织化学及分子改变进行综合分析,以作出正确的诊断。分子遗传学是重要的诊断依据,但EWSR1与CREB家族中的不同基因发生融合的临床意义尚不明确,本病例检测到EWSR1基因的不同外显子分别与CREB1和SELENOW基因融合,其临床病理意义需要更加深入的研究。
所有作者声明无利益冲突



























