
报道1例侵袭性系统性肥大细胞增生症累及胃、腹膜后淋巴结,并探讨其临床病理学特征、鉴别诊断及相关治疗。患者男,42岁,骨髓活检示骨小梁旁见成片分布的梭形细胞。胃角黏膜活检示黏膜固有层见散在分布、胞质透亮的肥大细胞。腹膜后淋巴结活检示肥大细胞紧密聚集、弥漫浸润。免疫组织化学示肥大细胞及梭形细胞均阳性表达CD117、CD2及CD25。分子检测:KIT D816V 突变。病理诊断为侵袭性系统性肥大细胞增生症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,42岁。半个月前无明显诱因出现乏力、低热、腹胀、腹泻,体重下降5 kg于2021年1月来院检查,门诊拟淋巴结肿大,淋巴瘤待排除收入院。患者既往患有色素性荨麻疹14年。曾在外院行正电子发射计算机断层显像(PET)/CT检查,示腹盆腔积液,脾大,小网膜囊、腹膜后、肠系膜区、盆腔及两侧腹股沟区多发肿大淋巴结影;全身骨骼骨质密度不均匀增高伴多发局限性低密度骨质破坏及致密影,考虑造血系统或代谢系统病变可能性大;贲门部胃壁结节状增厚;结肠部分肠管节段性氟代脱氧葡萄糖FDG增高,考虑肠道炎性病变;双肾结石,左侧输尿管下段结石伴其上段肾盂输尿管梗阻性扩张积水。体格检查:患者全身多处皮肤黏膜色素沉着,有皮疹;颈部、腹股沟多发淋巴结肿大,最大径约2 cm;肝脏未触及;脾脏肿大,肋下5 cm。实验室检查:白细胞5.88×109/L,血红蛋白114 g/L,超敏C反应蛋白47.3 mg/L;肿瘤标志物CA125 88.4 U/ml;肾功能示尿素24.85 mmol/L,肌酐212.5 μmol/L,尿酸618 μmol/L。胃镜示胃底、胃体、胃角、胃窦、十二指肠球部及降段黏膜粗糙不平。
病理检查:患者入院后共行3次活检,1次骨髓涂片。骨髓活检示骨髓组织内见少量造血成分,局部骨小梁旁见梭形细胞呈流水样排列,肿瘤细胞呈梭形,胞质嗜碱,细胞核呈梭形或卵圆形伴有不典型性(图1)。网状纤维染色示伴有骨髓纤维化。胃角黏膜活检示黏膜内腺上皮尚存,部分固有层间质增宽,间质内可见少量胞质透亮的细胞散在分布,细胞核为卵圆形伴有不典型性,背景中还可见淋巴细胞、浆细胞及灶状嗜酸性粒细胞浸润(图2)。腹膜后淋巴结活检示胞质透明的细胞紧密聚集、弥漫浸润,可见纤维血管分隔,肿瘤细胞胞质丰富、透亮,内可见脱颗粒现象,细胞核呈圆形或卵圆形伴有不典型性(图3)。免疫组织化学结果显示肿瘤细胞均阳性表达CD117(图4)、CD2(图5)及CD25(图6),阴性表达髓过氧化物酶(MPO),Ki-67阳性指数约10%。骨髓涂片示骨髓增生明显活跃,原始细胞约2%,其余未见异常。后患者于外院再次行骨髓活检示骨髓增生大致正常,可见异常细胞灶性增生,胞体大,胞质丰富,核为圆形或椭圆形,核染色质较粗,未见核仁,约占有核细胞30%;免疫组织化学结果显示CD117、CD34、CD2、类胰蛋白酶及类糜蛋白酶均阳性;流式细胞结果示异常细胞占47%,表达CD117及CD25。骨髓涂片显示骨髓增生尚活跃,易见组织嗜碱细胞(约2%)。分子检测示KIT D816V突变。
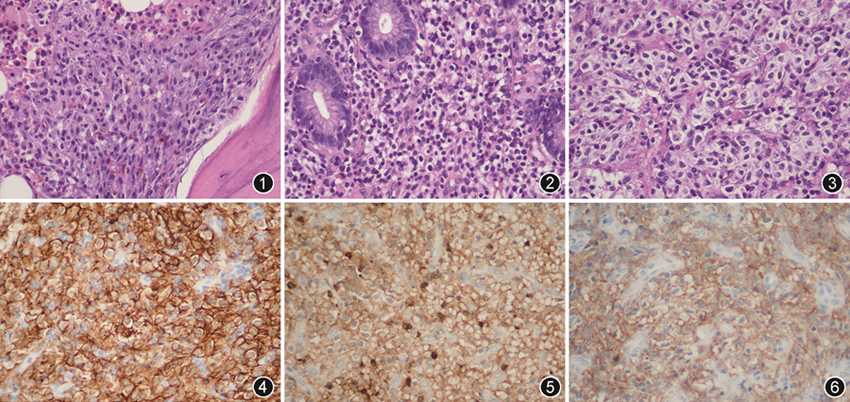

病理诊断:侵袭性系统性肥大细胞增生症。
治疗:患者先行左侧输尿管镜下激光碎石术,术后予解痉、补液等对症处理。侵袭性系统性肥大细胞增生症确诊后使用氢化泼尼松龙及干扰素派罗欣联合治疗,同时给予保肝、护胃、保肾、调节免疫、水化、碱化、降尿酸、利尿、补钙、补充维生素、补充白蛋白等支持治疗。
随访:随访7个月患者一般情况尚好,腹部切口有感染。
讨论:肥大细胞增生症是肥大细胞克隆性、肿瘤性增殖的一类肿瘤,其特征为异常肥大细胞多灶性聚集或浸润,可表现为自发消退的皮肤病变到具有高度侵袭性的系统性病变[1]。根据2016年WHO造血与淋巴组织肿瘤分类可分为:(1)皮肤肥大细胞增生症(cutaneous mastocytosis,CM);(2)系统性肥大细胞增生症(systemic mastocytosis,SM);(3)肥大细胞肉瘤(mast cell sarcoma,MCS)[1]。根据临床特征不同,SM进一步分为4类:惰性系统性肥大细胞增生症(ISM)、系统性肥大细胞增生症合并克隆性造血系统非肥大细胞疾病(SM-AHNMD)、侵袭性系统性肥大细胞增生症(ASM)及肥大细胞白血病(MCL)。其中ASM约占SM病例的12%[2],其特征为出现肥大细胞增殖引起的相关组织(胃肠道、肝脏、脾脏、骨骼或血液系统)损伤,也被称为“C”项所见,包括:(1)骨髓功能障碍,一系或者多系细胞减少,但无明显非肥大细胞系造血组织肿瘤;(2)可触及肝肿大伴肝功能损害,腹腔积液和/或门脉高压;(3)骨侵犯伴有溶骨性病损和/或病理性骨折;(4)可触及的脾脏肿大伴脾功能亢进;(5)胃肠道肥大细胞浸润造成吸收不良,体重减轻[1]。
本例符合1个主要标准即骨髓及腹膜后淋巴结见多量异常形态的肥大细胞浸润;3个次要标准即骨髓和腹膜后淋巴结内浸润的肥大细胞>25%有不典型性;CD117、CD2及CD25均表达;存在KIT D816V突变。同时伴多项“C”项所见,即腹腔积液、骨质破坏、脾脏肿大及近半个月体重减轻5 kg,符合ASM。
ASM首先应该与其他类型SM相鉴别。ISM指符合SM,但无“C”项所见,并且不合并非肥大细胞系克隆性造血组织恶性肿瘤/疾病(AHNMD),本例有多项“C”项所见,不符合ISM。SM-AHNMD是指符合SM并合并AHNMD,本例外周血检查、骨髓活检、骨髓涂片及流式细胞学检查均未发现AHNMD。MCL是指符合SM,同时骨髓穿刺涂片中肥大细胞需≥20%,可分为经典型(外周血涂片中肥大细胞数占白细胞总数的比例≥10%)和非白血病性肥大细胞白血病(<10%),本例骨髓涂片显示骨髓增生尚活跃,易见组织嗜碱细胞(约2%),外周血中未见异常肥大细胞成分,不符合MCL。
其次是与受累及部位的常见病变相鉴别。骨髓是最常见累及部位,在骨髓活检或者涂片中观察到肥大细胞浸润时,需要鉴别是反应性增生还是肿瘤性增殖。反应性增生时,肥大细胞通常为圆形,无不典型性,并且分布松散。而肿瘤性增殖时,肥大细胞主要呈梭形,有不典型性,紧密排列于骨小梁旁和/或血管周,常伴有网状纤维增生及胶原纤维增生。本例中骨髓活检示成片梭形细胞呈流水样分布于骨小梁旁,细胞有不典型性,并且经网状纤维染色显示网状纤维增生,因此是肿瘤性增殖。高达80%的SM患者出现胃肠道症状,这时需要胃肠镜活检以便与其他胃肠道的炎症性病变或者肿瘤相鉴别。SM侵犯胃肠道黏膜主要为4种模式[3, 4]:(1)肥大细胞稀疏散在分布,有不典型免疫表型和KIT基因活化性点突变。(2)肥大细胞轻度增多,排列松散,偶有密集灶,表达CD25,常伴KIT基因活化性点突变。(3)不典型肥大细胞弥漫密集浸润黏膜层,与其他组织中的侵袭性SM变型类似。(4)局限性肥大细胞肉瘤。本例的胃黏膜受累模式为第2种,浸润的肥大细胞散在分布,表达CD117和CD2,且伴有KIT D816V突变。此外,约30%ASM患者可出现淋巴结侵犯[5],主要表现为全身性、腹膜后、宫颈、腋窝、腹股沟和纵隔等部位淋巴结受累[6];有2种独特的浸润模式:局灶性和弥漫性;大多数淋巴结显示弥漫性肥大细胞浸润,正常淋巴结结构的部分或全部破坏;浸润区域多为髓索和淋巴窦;可伴有小血管增生、嗜酸性粒细胞增多、浆细胞增多和胶原纤维化[6]。本例腹膜后淋巴结活检示紧密聚集梭形肥大细胞弥漫浸润,可见纤维血管分隔,淋巴结正常结构消失,可明确诊断ASM累及腹膜后淋巴结,此外,患者小网膜囊、肠系膜区、盆腔及两侧腹股沟区多发肿大淋巴结也可能受ASM累及。
SM与分子遗传学异常有关,其中最常见的是KIT基因活化性点突变,尤其是KIT D816V的突变对SM的发病、诊断和靶向治疗起着核心作用,并且与疾病活性、亚型以及生存率之间存在很强的相关性[7]。研究显示KIT D816V在SM及ASM突变率分别为80%及41%[7]。其他的突变相对少见,主要包括KIT第7号外显子D816Y、815-817序列和第11号外显子突变[8]。此外大多数进展期的SM,特别是伴发血液肿瘤SM也常表现出体细胞突变,包括TET2、SRSF2、ASXL1、RUNX1、JAK2和/或RAS突变[9]。
虽然目前ASM无法治愈,但是近年来,在针对肿瘤性肥大细胞疾病起源、分子学改变方面发现了许多不同的治疗靶点[10]。现阶段的治疗方案主要包括以下几点:首先是对症治疗,组胺-2(H1)拮抗剂可用于治疗红斑、潮红、瘙痒和大疱等皮肤症状。克罗莫林可有效减轻胃肠道症状,以及有效缓解骨疼痛和头痛等。其次是化疗,常用的化疗药包括干扰素α、糖皮质激素、羟基脲及阿糖胞苷等。其中干扰素α单用或与糖皮质激素联合用药能使ASM的缓解率达到60%[11]。最后是靶向治疗和造血干细胞移植。最常见的靶向治疗是针对KIT突变状态的治疗。美国食品和药物监督管理局在2006年批准了伊马替尼用于没有KIT D816V突变或KIT突变状态未知的ASM的成年患者,并在2017年批准了米哚妥林用于ASM的治疗[12]。同时一些其他的KIT抑制剂正在研究中,主要包括高特异性的KIT D816V抑制剂BLU-285;KIT、FLN和LYN激酶抑制剂马西替尼;能阻断KIT D816V的酪氨酸激酶活性的达沙替尼等。此外,对于进展较迅速的 ASM患者,有合适供者的年轻患者应考虑行造血干细胞移植[13]。因此,正确的诊断、明确的组织学分型和分子检测,有利于个体化治疗的选择及预后的判断。
所有作者声明无利益冲突



























