
本文报道2例胰腺腺泡囊性转化。该病变非常罕见,是一种良性非肿瘤性病变。临床可有腹痛、消化不良、触及腹部肿块等非特异性表现,但大部分病例无临床症状。诊断需与较多见的胰腺囊性肿瘤性病变鉴别。治疗上可以随访或采取保守手术,避免误认为恶性肿瘤而过度手术治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
例1,患者男,47岁,因右上腹隐痛5个月,体检发现胰腺占位4个月,于2015年1月21日入院。B超示:胰腺尾部一囊性暗区,大小2.8 cm×1.7 cm,界清,主胰管未见扩张。诊断胰尾部囊性占位,考虑单纯性囊肿,囊腺瘤待排。磁共振成像(MRI):胰尾部见一类圆形异常信号灶,T1WI呈低信号,T2WI呈高信号,界清,大小2.6 cm×1.7 cm。胰腺实质边缘可见多发小圆形异常信号灶,T1WI呈低信号,T2WI呈高信号,增强均未见强化。胰管未见明显扩张。诊断:胰腺多发囊性灶。胰腺CT增强造影:胰腺体尾见大小2.4 cm×1.8 cm的低密度灶,边界清,增强未见强化。诊断:胰腺体尾部占位。血清肿瘤标志物检查均未见明显异常。2015年1月28日在机器人辅助下行胰腺体尾切除+胰腺周围神经离断+脾切除术。患者术后恢复良好,顺利出院。例2,患者女,34岁,发现胰腺占位性病变伴阵发性上腹痛半年余,进食后明显,于2020年11月20日入院。半年前当地医院MRI显示胰腺体尾部多发囊性灶,至我院行胰腺细针穿刺细胞学检查报告:炎性背景下找到少量导管上皮细胞,未见肿瘤细胞。穿刺少量组织切片:渗出物中见小灶腺体,未见肿瘤。出院后随访,多次胰腺CT及MR检查(图1),提示胰腺体尾部多发囊性灶,黏液性肿瘤不能除外,部分较前稍有增大。考虑胰体尾分支胰管型导管内乳头状黏液肿瘤可能性大。2020年11月22日血清糖抗原19-9为43.0 U(参考值0~37.0 U),余肿瘤指标无异常。2020年11月27日,行腹腔镜下胰体尾切除术。患者术后恢复良好,顺利出院。
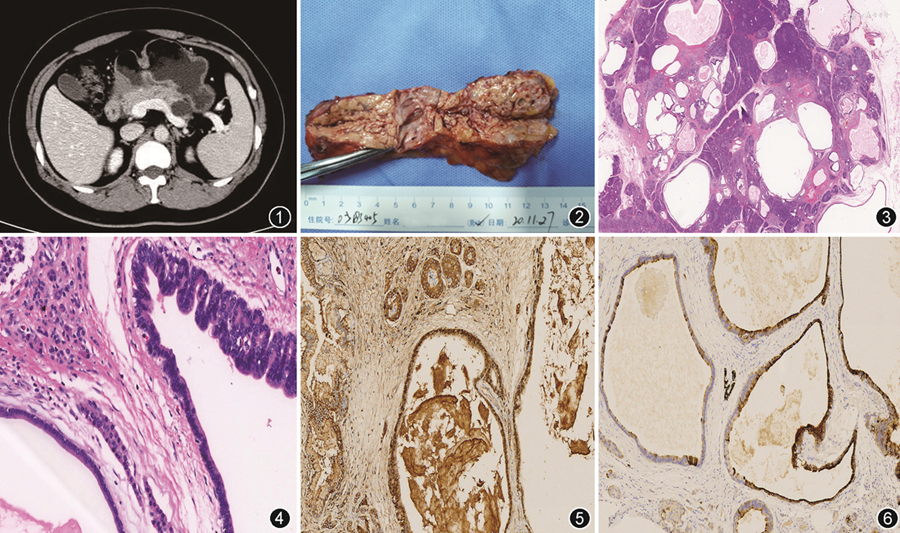

病理检查:例1,送检胰体尾部标本,大小7.0 cm×3.5 cm×2.0 cm,切面见大小不一的囊腔,最大者直径3.0 cm,另见破碎脾脏组织无特殊。镜下胰腺组织内多个大小不等的囊腔样结构,内衬扁平或立方上皮,细胞质空亮或略嗜酸,未见核异型及核分裂象。胰腺切缘处见类似改变,淋巴结4枚未见明显异常。免疫组织化学α-抗胰糜蛋白酶、α-抗胰蛋白酶、细胞角蛋白(CK)7、CK19、MUC-1、MUC-5AC及MUC-6均阳性,CK20、CDX2、嗜铬粒素A(CgA)、突触素、CD56、MUC-2均阴性,Ki-67阳性指数3%。例2,送检胰体尾部标本,大小12.6 cm×4.7 cm×1.6 cm,见多发大小不等类圆形囊性灶,最大者直径2.2 cm(图2)。胰腺镜下改变同例1(图3,4),切缘阴性。免疫组织化学α-抗胰糜蛋白酶(图5)、α-抗胰蛋白酶、CK7、CK19(图6)均阳性,雌激素受体(ER)、孕激素受体(PR)、CD10及α抑制素均阴性,Ki-67阳性指数2%。
病理诊断:均诊断为胰腺腺泡囊性转化。
随访:例1术后随访80个月,例2随访10个月,患者情况均良好,无复发。
讨论:胰腺腺泡囊性转化(acinar cystic transformation,ACT)类似名称首次报道在2000年[1],在2002年1例尸体解剖中发现同样病变,但因假设其为胰腺腺泡细胞囊腺癌的良性前体肿瘤,而被称为胰腺腺泡细胞囊腺瘤[2]。2019年WHO第5版消化系统肿瘤分类重新将其归类为非肿瘤性囊性病变,称为ACT,是由内衬良性胰腺腺泡细胞和导管上皮细胞组成的非肿瘤性囊性病变。同时,也保留胰腺腺泡细胞囊腺瘤这个名称[3]。
胰腺ACT是一种非常罕见的胰腺囊性病变,经PubMed文献系统查询,目前文献报道不足80例[4, 5, 6, 7],年龄范围9~83岁,中位年龄43岁,以女性多见,可达88%[8]。它可以发生在胰腺的任何部位,一般以胰头部多见,可以为多发囊肿,弥漫累及整个胰腺,或为单发大囊肿。平均直径约5.3 cm(1.0~19.7 cm),但与胰腺主导管均不相通。囊肿壁很薄、光滑半透明,囊内积水样液体,可以有囊壁内结节。偶然发现的病例常为单个病灶,小于1.0 cm,大体上不能发现。临床上,大的囊肿性病变以腹痛为主要表现,可有消化不良,甚至触及腹部肿块等非特异性表现,但大部分病例没有临床症状。部分病例及小的囊肿只是在其他原因行胰腺病理检查或尸检时偶然发现[2],可以合并Von Hippel-Lindau(VHL)病[9],甚至有报道称在胰腺ACT中合并发生了导管内乳头状黏液性肿瘤[4]。
组织形态学上,胰腺ACT以大小不一的囊肿形成多个小叶状病变为特征。扩大的囊腔和腺泡上皮簇相连,有时可见囊内假乳头结构,囊肿被纤维组织及残留萎缩的胰腺组织分隔。囊壁内衬上皮由分散的胰腺腺泡和导管分化的细胞组成,单个的囊肿由1~2层腺泡细胞组成,导管上皮分化较少。上皮细胞近腔缘胞质空淡或嗜酸颗粒状,胞核位于基底部,没有异型及核分裂活性,囊腔内可见浓缩的嗜酸性分泌物。免疫组织化学检测显示腺泡细胞阳性表达胰蛋白酶、糜蛋白酶、bcl-10等,导管上皮细胞阳性表达CK19。
与胰腺的实体肿瘤相比,胰腺囊性病变占总体的比例较少,但类型较多需要鉴别诊断:(1)最常见的囊性肿瘤包括浆液性囊腺瘤、导管内乳头状黏液性肿瘤和黏液性囊性肿瘤。除结合临床和影像学表现外,从病理学上,首先是区分黏液性和非黏液性,如果是黏液性,则考虑肿块是否为导管内乳头状黏液性肿瘤或黏液性囊性肿瘤。胰腺ACT缺乏浆液性囊腺瘤富于糖原的上皮细胞,没有导管内乳头状黏液性肿瘤的黏液性上皮,及黏液性囊性肿瘤的卵巢样间质。(2)滞留囊肿:由于炎性病变、结石或先天因素引起的梗阻,胰腺导管呈囊性扩张,一般单房,体积较小,内衬立方上皮,可以有鳞状化生或脱落,囊壁纤维化。(3)任何的胰腺实体肿瘤都可以引起囊性变。如胰腺实性假乳头状肿瘤发生显著的囊性变,但其囊壁为肿瘤细胞。(4)不太常见的非上皮病变,如淋巴管瘤,镜下为扩张的淋巴管,没有上皮细胞内衬易于鉴别。认识到腺泡上皮及导管上皮的双重分化并用免疫组织化学证实对胰腺ACT的正确诊断有帮助。术前囊肿细针穿刺液细胞学检查常报告为良性或无明确诊断,可结合囊肿液中生化成分的检测,如癌胚抗原(CEA)及淀粉酶含量,以及分子病理学特征,如KRAS或GNAS突变情况,则有利于判断是否为肿瘤性改变[10]。
胰腺ACT的病因及具体流行病学均不清楚,也缺乏有临床意义的分子生物学发现[3]。虽然有报道通过阵列比较基因组杂交技术发现一个病例有染色体的增加,认为是肿瘤性病变[9],但更多的研究表明,这些染色体的改变是随机和非特异性的,并且在胰腺导管腺癌及其囊性前期肿瘤性病变中存在的KRAS、GNAS、RNF43、TP53、CDKN2A及SMAD4等突变均没有在胰腺ACT中发现[7, 8],从而更支持其为非肿瘤性改变。有文献报道,微小的导管周胰腺神经内分泌肿瘤和导管腺癌引起胰腺近端导管阻塞,可继发远端导管囊性扩张和腺泡细胞化生,其形态和免疫表型与ACT完全相同[6]。因此,在诊断ACT之前,需要对标本进行广泛取材,以确定是否存在近端的潜在肿瘤。与报道的许多胰腺ACT病例剩余胰腺组织均没有发现任何病理改变相同[4],我们的2个病例经广泛取材,也未发现其他的肿瘤性改变。
已报道的ACT均为良性,且生长缓慢,其中最长随访15年[5],没有复发及恶性变,未见并发腺泡细胞癌。部分病例不完全切除,也无疾病复发及进展。我们的病例1手术切缘有病灶组织,但随访80个月无复发及进展。因此,在术前诊断明确的情况下,不一定需要手术治疗[4, 5]。
总之,胰腺ACT是一种罕见的胰腺非肿瘤性上皮性病变,需鉴别的胰腺囊肿性病变类型较多,术前诊断有一定难度。应结合临床病史、影像学资料、细针穿刺细胞学及囊肿液生化指标检测等综合分析。病理检查应充分取材,排除胰腺近端微小的肿瘤性病变。病理组织学诊断需证实有腺泡细胞和导管上皮细胞两种分化。应根据患者的临床症状制定治疗方案,尤其对年轻及无症状患者,可以随访或保守手术治疗,避免误认为恶性肿瘤而过度手术治疗。
所有作者声明无利益冲突



























