
老年男性右肺上叶3.5 cm×2.5 cm大小肿块,显微镜下示肿瘤由2种成分构成,主要以小到中等、蓝圆细胞片巢状分布为主,胞质较少,核呈泡状,核仁明显,另一部分肿瘤细胞透亮,2部分可见过渡,均异型性显著,核分裂象易见。免疫组织化学显示INI1(SMARCB1)缺失,BRG1(SMARCA4)未缺失,广谱细胞角蛋白(CKpan)、p40、细胞角蛋白(CK)5/6、p63、突触素均阳性,甲状腺转录因子1灶区阳性,CK7少量阳性,生长抑素受体2个别细胞阳性,CD56个别细胞阳性,Ki-67阳性指数50%。基因检测示INI1(SMARCB1)拷贝数异常以及EGFR、DIS3、BRIP1、HMCN1、PLCG2、RAD21、TSC2基因突变,病理诊断为INI1(SMARCB1)缺失低分化癌伴有鳞、腺及神经内分泌免疫表型。INI1(SMARCB1)蛋白是染色体重塑相关多聚体蛋白SWI/SNF的一个亚单位,SWI/SNF复合体缺失的未分化癌对传统化疗药物不敏感、预后差,但组蛋白甲基转移酶抑制剂治疗可能有效,而本例极易与低分化鳞癌、腺鳞癌混淆,故将INI1(SMARCB1)缺失的肿瘤识别出来十分必要。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,74岁。因发现“右肺上叶结节”4个月余于2021年6月16日就诊,CT提示右肺上叶后段可见一不规则软组织肿块,平面大小为3.5 cm×2.5 cm,边缘毛糙,密度不均匀,邻近胸膜及斜裂牵拉凹陷,增强病灶明显不均匀强化(图1),余双肺多发结节状密度增高影,较大者位于右肺下叶前基底段,大小为2.5 cm×2.0 cm。双肺散在斑片状、条索状密度增高影。纵隔及双肺门见小及稍大淋巴结,较大者约1.2 cm×1.0 cm。心脏未见明显增大,双侧胸腔内未见积液影,临床分期cT2NxMx,行单孔胸腔镜下右肺上叶切除术。
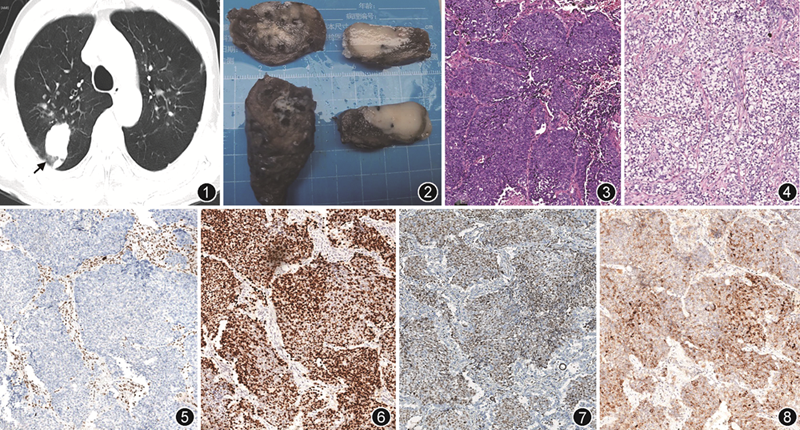

病理检查:带吻合钉的楔形切除肺组织标本1个,大小9.8 cm×3.6 cm×2.4 cm,距吻合钉断端3.6 cm见一肿块,大小3.1 cm×2.2 cm×2.0 cm,切面灰白灰褐色、实性质中,侵及脏层胸膜(图2)。镜下观察:肿瘤有2种形态,主要以小到中等、蓝圆细胞片巢状分布为主(图3),部分包绕血管呈岛状分布,周围广泛坏死,肿瘤细胞胞质较少,核呈泡状,染色质深,核仁明显,另小部分区域细胞透亮,细胞核较小,可见小核仁(图4),2个区域可见过渡,均异型性显著,核分裂象易见,偶可见瘤巨细胞,伴有明显的坏死,可见脉管侵犯。免疫组织化学及分子检测结果:INI1(SMARCB1)缺失,BRG1(SMARCA4)未缺失,广谱细胞角蛋白(CKpan)、p40、细胞角蛋白(CK)5/6、p63、突触素均阳性,甲状腺转录因子1(TTF1)灶区阳性,CK7少量阳性,生长抑素受体2(SSTR2)个别细胞阳性,CD56个别细胞阳性,Ki-67阳性指数50%;Napsin A、波形蛋白、CD117、嗜铬粒素A(CgA)、S-100蛋白、Calponin、INSM1、CD34、NUT均阴性,各种免疫表型表达区域重叠,2种区域免疫表型无明显差异(图5~8)。基因检测示INI1(SMARCB1)拷贝数异常,EGFR、DIS3、BRIP1、HMCN1、PLCG2、RAD21、TSC2基因突变(检测方法:目标基因捕获测序方法,检测平台:高通量基因测序平台,参考基因组:GRCh37/hg19)。
病理诊断:肺INI1(SMARCB1)缺失低分化癌伴有不典型鳞、腺及神经内分泌免疫表型,病理分期pT2NxMx。
随访:患者手术后未遵嘱返院治疗,2个月后当地医院CT检查显示右肺下叶基底段结节及双侧肋骨骨质密度不均,后行放疗(剂量不详)。家属自述“患者术后第5个月全身多处转移治疗无效死亡”。
讨论:INI1(SMARCB1)属于抑癌基因,位于染色体22q11.2,几乎表达于机体所有正常组织的细胞核内[1, 2],它被认为是染色质重塑复合体SWI/SNF的核心亚基之一[3],SWI/SNF是ATP依赖性染色质重塑复合体的一个亚家族,SWI/SNF复合体由多个亚基构成,包括2个催化亚基BRM/SMARCA2和BRG1/SMARCA4,3个核心亚基SMRCB1、SMARCC1和SMARCC2,以及辅助调节亚基(其中主要的辅助调节亚基有:ARID1A/1B、ARID2、ACTL6A/6B、MARCD1/D2/D3、DPF1/2/3、SMARCE1、PBRM1、BRD7/9 等)。其功能主要是参与染色质重塑,涉及染色质结构的动态修改,将染色质由致密转为开放状态,以控制基因表达和调控转录机制蛋白[4],从而实现包括DNA复制、转录和损伤修复等功能,在调控细胞增殖分化等过程中发挥了重要的作用,尤其是在肿瘤发生发展中。INI1(SMARCB1)高度保守,其基因产物INI1(SMARCB1)在所有正常人体组织中普遍表达,INI1(SMARCB1)蛋白表达缺失是由涉及SMARCB1基因位点的缺失和/或突变导致的双等位基因失活的结果,错义、无意义突变、剪接位点、移码突变和框内缺失都可能改变SMARCB1蛋白的合成状态[5, 6]。本例通过高通量测序检出了SMARCB1拷贝数的降低,相对应的则是免疫组织化学INI1蛋白表达的缺失。在一项包含24种肿瘤669例癌症患者的研究中,SWI/SNF亚基基因呈现高频突变现象,突变率为19%,仅低于TP53的26%的突变率,在所有基因中居第2位。因此,SWI/SNF突变体的致病机制可能广泛地参与到了各种肿瘤之中[7]。如SMARCB1表达缺失与肾和肾外组织的非典型畸胎样/横纹样肿瘤(AT/RT)和恶性横纹肌样瘤(MRT)相关[8, 9],此外,在其他恶性肿瘤中发现了SMARCB1基因的改变,如上皮样肉瘤、肌上皮癌、上皮样神经鞘瘤以及骨外黏液样软骨肉瘤[10, 11]。不仅如此,SMARCB1缺失引起的鼻窦基底样癌和胃肠道、胰腺和子宫肿瘤也有报道。而在胸部,随着Le Loarer等[12]于2015年首次报道SMARCA4缺失的胸部肉瘤后,Perret等[13]也陆续发现该类肿瘤,与上述不同的是,Rekhtman等[14]报道了一部分SMARCA4缺失的肺肿瘤显著表达上皮标志物,并将该类肿瘤以SMARCB1缺失的肺癌报道出来。第4版(2015年)WHO肺肿瘤分类中并未对SMARCA4缺失的肺肿瘤做出具体描述[15],直到第5版(2021年)WHO肺肿瘤分类中才做出了SMARCA4缺失性未分化肿瘤的分类[16],而SMARCA4缺失的胸部肉瘤、SMARCA4缺失的肺癌,与前者是包含或者交集关系并未做出明确解释。而发生于胸部SMARCB1缺失的肿瘤并无系统性的阐述,仅Yoshida等[17]报道了1例SMARCB1缺失的胸膜鳞状细胞癌,该例与本例同样强表达CK5/6、p63,而不表达TTF1和神经内分泌标志物,形态学上胞质更丰富,呈镶嵌状排列,也较本例分化更好,另1例INI1(SMARCB1)缺失的肿瘤不表达CK5/6、p63、TTF1等标志物,而表达CD34,最终确诊为上皮样肉瘤[18]。本例肺原发INI1(SMARCB1)缺失的癌伴有不典型腺、鳞、神经内分泌免疫表型,是否可能命名为SWI/SNF复合体缺失的未分化癌,尚需要更多病例及临床治疗、预后的数据支持。
鉴于本病例的免疫表型较为多样,容易误诊,显著的鳞状细胞表型和CD34阴性可以比较容易与恶性间皮瘤、上皮样肉瘤、恶性横纹肌样肿瘤及肌上皮癌鉴别开来。肿瘤并未累及纵隔、鼻腔鼻窦,故胸腺癌、INI1(SMARCB1)缺陷型鼻腔鼻窦癌也不支持,且缺乏胸腺癌高度灵敏的标志物CD117的表达。NUT癌常表现为鳞状分化,但目前肿瘤缺乏核NUT蛋白表达。鉴于本例的免疫表型表达鳞、腺及神经内分泌标志物,且表达于同一区域肿瘤细胞,故最易混淆的还是基底样型鳞状细胞癌、腺鳞癌、混合性神经内分泌-非神经内分泌肿瘤,INI1(SMARCB1)的缺失有助于将其区分开来,可见在低分化肿瘤中,即使免疫表型提示了分化方向,常规加入免疫指标INI1(SMARCB1)也是有必要的,因为这一类肿瘤不仅在预后上有区别,在治疗上也可能有所不同。SWI/SNF复合体缺失的肿瘤对传统化疗药物不敏感、预后较差,而组蛋白甲基转移酶(enhancer of zeste homolog2,EZH2)抑制剂他泽司他(Tazemetostat)在INI1缺失的肿瘤中显示出抗肿瘤活性[19],在体内肿瘤模型中,EZH2失活完全阻断了SMARCB1缺失驱动的肿瘤发生。他泽司他已经在2020年初获美国食品药品监督管理局批准上市,用于治疗不适合手术的、转移性或局部复发的晚期INI1(SMARCB1)缺失的肿瘤。鉴于EZH2抑制剂有可能成为治疗SMARCB1缺陷肿瘤的有效药物,故识别出INI1(SMARCB1)缺失的肿瘤是非常有必要的。
所有作者声明无利益冲突



























