
第5版WHO乳腺肿瘤分类中新增乳腺少见和涎腺型肿瘤,通常是雌激素受体、孕激素受体和HER2均为阴性、具有惰性生物学行为的“三阴性”肿瘤。因其总体预后良好,故临床治疗需区别于“高度恶性”的三阴性乳腺癌。本文就此类肿瘤的形态学、分子特征、预后及临床治疗进行介绍,以期提高对其临床病理认识水平,并为临床精准治疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
第5版WHO乳腺肿瘤分类(以下简称第5版分类)将乳腺腺泡细胞癌、腺样囊性癌、分泌性癌、黏液表皮样癌、多形性腺癌、伴有极性反转的高细胞癌纳入乳腺少见和涎腺型肿瘤章节[1]。正常乳腺和涎腺均为小管腺,具有相似上皮和肌上皮细胞成分,因而大多数乳腺涎腺型肿瘤形态学和分子特征与唾液腺中的肿瘤十分相似。这部分乳腺肿瘤免疫表型通常是雌激素受体(ER)、孕激素受体(PR)、HER2均为阴性,被归类为“三阴性”肿瘤。不同于高度恶性的三阴性乳腺癌(triple negative breast cancer,TNBC),这是一类有着惰性生物学行为,除极少数亚型外总体预后良好的低级别三阴性浸润性癌[2],故临床治疗方面需区别于高度恶性的TNBC。本文就乳腺少见和涎腺型肿瘤的形态学、分子特征及临床预后进行介绍,以期提高对此类少见肿瘤的临床病理认识和诊治水平。
乳腺ACC是一种罕见的恶性上皮性肿瘤,形态学与涎腺ACC相似,细胞呈广泛的浆液性分化,其特征是细胞胞质内含酶原颗粒。乳腺ACC在1996年首次被报道[3],目前文献报道45例[4]。肿瘤主要发生在成年女性,平均年龄50岁(20~80岁),通常表现为结节或肿块,直径0.1~5.0 cm。
腺泡细胞癌组织学形态常表现出多种生长模式,可呈实性巢状、腺泡状,具有微腺结构(图1,2),类似于唾液腺的腺泡结构和乳腺的微腺体腺病,腺腔内见嗜酸性分泌物。肿瘤细胞常呈多角形,可见单个核仁,核分裂象不等、胞质含有丰富的双嗜性颗粒或呈明显的空泡状(图3)。免疫组织化学示肿瘤细胞浆液性唾液腺样分化(淀粉酶、溶菌酶和α-1抗糜蛋白酶阳性),上皮细胞膜抗原(EMA)和S-100蛋白呈强阳性(图4),GCDFP15和低相对分子质量细胞角蛋白可为阳性,ER、PR和HER2阴性[5]。最新发现免疫组织化学指标NR4A3/NOR-1在涎腺ACC中高表达(98.4%)[6],而在乳腺ACC不表达,表明其为不相关疾病。
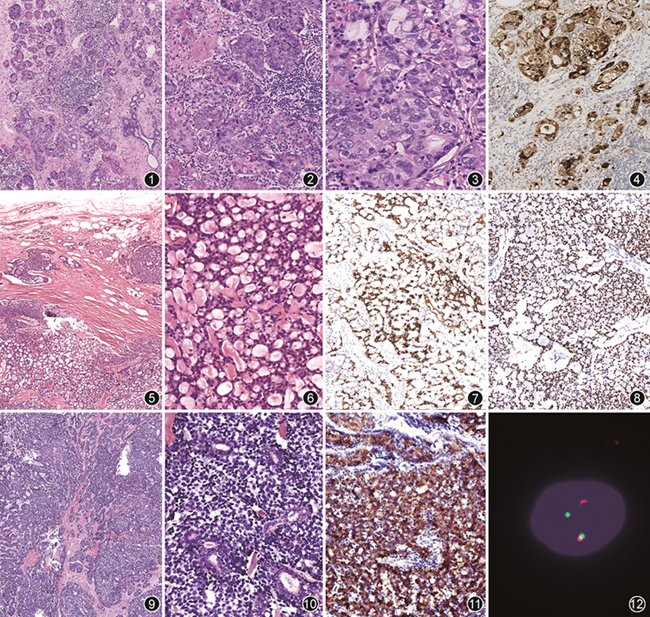

乳腺ACC的基因突变谱已被证明与涎腺ACC不同[7],前者的DNA拷贝数改变和基因突变谱与高度恶性的TNBC或起源于微腺体腺病的乳腺癌相似[8],常含有TP53、PIK3CA、KMT2D等基因突变,现有的分子特征亦支持乳腺微腺体腺病可能是TNBC的前期病变[1]。Geyer等[8]认为,乳腺ACC和起源于微腺体腺病的乳腺癌可能代表一类“低级别TNBC”,它们具有低侵袭性,可以发生转移,少见情况下有可能进展为高级别TNBC,亦有学者认为乳腺ACC不是一种独立的类型,而是起源于微腺体腺病的浸润性癌伴有腺泡分化[9]。关于乳腺ACC的预后,现有的数据亦非常有限。第5版分类认为乳腺ACC是一种中等侵袭性的TNBC,与微腺体腺病可能存在重叠。
以往的文献报道中,大多数患者除了手术治疗外,还接受术后放、化疗,随访时间内绝大多数患者生存良好,但也存在远处转移和死亡的个例[10]。具有高级别特征的ACC或者与其他类型乳腺癌混合的ACC可能更具有侵袭性,临床医师可结合患者实际情况(包括患者年龄、身体素质、肿瘤TNM分期、是否合并其他类型乳腺癌、有无转移等情况)综合评估,制定治疗方案,现有数据表明,宜对此类患者采取更为积极的治疗方法,手术治疗加术后辅助治疗可能是一种有益的选择。
乳腺AdCC是一种由上皮和肌上皮细胞组成的浸润性癌,形态学和分子特征类似于腮腺AdCC,多发生在老年女性(60~70岁),少数为年轻女性和男性患者[1],通常表现为位于乳晕下的单发结节,极少见情况下呈多灶性,大小不等,1~12 cm均可见,可伴有疼痛或触痛。影像学常表现为境界清楚的分叶状肿瘤、边界不清的肿块或毛刺样病变,可见微小钙化,少数肿瘤可呈隐匿性。
乳腺AdCC组织学形态分为3种亚型:(1)经典型腺样囊性癌(classic AdCC,CAdCC)。镜下表现为中央区特征性筛状结构,可呈真/假腺腔,周边管状结构为主,少部分呈实体巢团状,管腔内可见黏液样或基底膜样物。肿瘤主要由上皮和肌上皮细胞组成,比例不等,部分细胞可呈基底样(图5,6)。肿瘤通常无坏死,核分裂象和神经侵犯少见。CAdCC形态特征与胶原小球病、筛状癌、小管癌等存在重叠,免疫组织化学真腺腔内衬细胞细胞角蛋白(CK)7阳性,肌上皮细胞p63阳性(图7,8)。当肿瘤以管状结构为主,间质玻璃样变硬化时,术中冷冻易与腺病相混淆。对于60~70岁老年人,腺病的诊断一定要谨慎。(2)实性-基底样腺样囊性癌(solid basaloid AdCC,SB-AdCC)。SB-AdCC在2002年首次被报道[1],镜下主要呈实性的生长模式(>90%),少部分区域细胞呈岛屿或小梁状排列,间质呈玻璃样变(图9)。实性区细胞形态似基底细胞,大小较一致,胞质少,核圆形或卵圆形,呈中-重度异型,核分裂象易见,实性细胞巢之间见少量导管样分化,为真性腺腔,衬覆细胞胞质丰富嗜酸,核圆形,可见小核仁(图10)。常见坏死和神经周围侵犯[11],需借助免疫组织化学与基底样型乳腺癌和小细胞癌鉴别。(3)腺样囊性癌伴有高级别转化(AdCC with high-grade transformation,HG-AdCC)。涎腺AdCC伴高级别转化已被报道,这种现象在乳腺AdCC中亦有罕见报道[4,12],HG-AdCC相伴发的癌通常是高侵袭性类型,如小细胞癌、浸润性导管癌、恶性黑色素瘤、梭形细胞癌、恶性腺肌上皮瘤等[4]。
乳腺AdCC免疫组织化学显示腺上皮细胞表达CK7、CK8/18、EMA,肌上皮细胞表达p63、SMMHC等,而基底样细胞表达CK14、CK5/6。值得注意的是肌上皮缺失并不能否定AdCC的诊断,而有可能是高级别的AdCC。CD117在所有上皮成分中呈不同程度阳性表达(图11)。ER、PR、HER2通常阴性,也有ER阳性病例[2]。多数CAdCC具有MYB-NFIB基因融合[2],SB-AdCC亚型亦可见(图12),少数AdCC可能出现MYBL1重排或MYB扩增[13]。新近发现SB-AdCC中存在CREBBP和NOTCH突变,NOTCH信号通路抑制剂有望成为SB-AdCC治疗的新选择。
阳性切缘、Nottingham分级、新生血管、神经周围浸润、淋巴血管浸润、基底样成分(>50%)、坏死和淋巴结受累等因素与AdCC的复发和转移密切相关[14, 15]。CAdCC尽管具有三阴性表型,但大部分为早期病变,腋窝淋巴结转移率低,局部转移罕见,一般根治性手术切除通常可治愈[1],ER阳性的治疗意义尚不明确。乳腺AdCC的亚型归类是影响患者预后的重要指标之一,与CAdCC相比,SB-AdCC是一种侵袭性变异亚型,腋窝淋巴结转移和神经侵犯更常见,具有更早和更高的远处转移率,预后较差,因此建议对所有SB-AdCC进行淋巴结分期[12,15];治疗以根治性手术切除为主,但是治疗方面的相关数据有限,经辅助化疗的患者均无瘤生存。临床可依据患者情况术后采取辅助治疗。HG-AdCC病例罕见,但恶性程度高,多数致患者死亡,预后可能取决于相伴发的恶性肿瘤,目前尚无最佳治疗方案提供。
乳腺分泌性癌是一种罕见的,以细胞内和细胞外产生嗜酸或嗜碱性分泌物为特征的浸润性癌。1966年McDivitt和Stewart[16]首次报道该肿瘤,因患者是儿童和青少年,曾命名为“幼年性乳腺癌”。后文献相继报道,肿瘤不限于儿童,Tavassoli和Norris[17]在1980年根据其组织学特征更名为“分泌性癌”。分泌性癌多见于年轻女性[1],也可见于儿童、男性患者。肿瘤可单发或多发,常表现为无痛性、边界清楚、活动良好的肿块,肿块直径通常约2 cm,生长缓慢,也可表现为血性乳头溢液。多数女性患者肿瘤位于乳头附近或外上象限;在男性和儿童,多数位于乳晕下方。
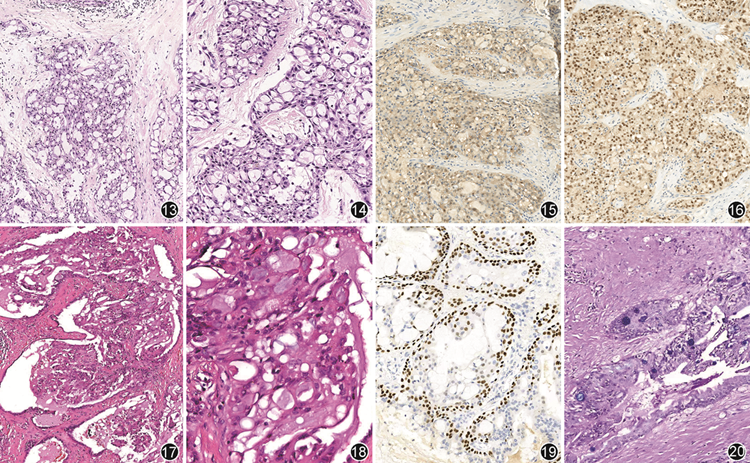
乳腺分泌性癌组织学形态常表现为微囊状、管状或实体结构等混合模式,腺腔内可见嗜酸性分泌物(图13),少数肿瘤也可出现乳头状结构[18]。肿瘤细胞呈多角形,形态温和,细胞内外含有分泌物,胞质呈嗜酸性颗粒状或泡沫状,胞核圆形或椭圆形,轻-中度异型,核仁不明显,核分裂象罕见(图14)。第5版分类强调了该肿瘤常伴有硬化间质和原位癌成分,排列呈筛状或实性,细胞呈低-中核级。免疫组织化学常为三阴性(ER、PR和HER2阴性)或ER/PR弱阳性[17]。S-100蛋白强阳性(图15),癌胚抗原、Mammaglobin、S0X10常阳性[1],可表达基底样标志物CK5/6和表皮生长因子受体(EGFR),Ki-67阳性指数低(<20%)。此外,Pan-TRK免疫组织化学在分泌性癌中具有较高的灵敏度和特异度,呈核阳性表达(图16),这与新近文献中的报道相一致[19]。

分泌性癌最常见分子特征是ETV6-NTRK3基因融合[20],神经营养酪氨酸激酶受体(NTRK)是一个原癌基因家族,包括NTRK1、NTRK2和NTRK3,分别编码TrkA、TrkB和TrkC蛋白。后者参与了生理环境下的神经元存活、分化和可塑性等生物过程。在各种癌症中,这些基因容易重排,使它们与ETV6、EML4、NPM和TPM等活性基因相邻,由此产生的融合蛋白显示出转化致癌潜力。此外,NTRK融合伴侣还有LMNA1、TPM3/4等。随着NTRK抑制剂Larotrectinib及Entrectinib获得美国食品药品监督管理局(FDA)批准并应用于临床,为存在NTRK融合的分泌性癌患者提供了有效的治疗选择,临床医师应该意识到这些潜在的靶向治疗意义,并积极寻求NTRK基因融合检测[21]。
随访数据表明,分泌性癌生物学行为通常为惰性,实性结构和坏死可提示预后不良,虽有20%~30%的病例存在腋窝淋巴结转移(一般≤3个淋巴结),即使淋巴结转移,预后也较好[22],5年和10年生存率超过90%[23]。可能在老年患者侵袭性会增加,但一般复发较晚,且罕见死亡病例报道。分泌性癌治疗以手术切除为主,不需因其TNBC表型而进行辅助治疗。报道显示,对存在ETV6-NTRK3融合基因的晚期进展性患者行靶向药物治疗,效果良好[21]。
乳腺MEC是一种由黏液细胞、表皮样细胞和中间型细胞组成,呈囊性和实性排列的浸润性癌,其形态和免疫表型与涎腺MEC相似,但不如涎腺MEC常见,自Patchefsky等[24]1979年报道第1例乳腺MEC以来,迄今国内外文献仅报道40余例[25]。肿瘤常发生于女性患者,年龄29~80岁,中老年多见。表现为单侧乳腺肿块或囊性病变,直径0.6~11.0 cm。乳晕后区域的MEC可表现为乳头溢液[4]。
乳腺MEC组织学形态常表现为肿瘤细胞排列呈实性片状、腺管状或巢状,肿瘤间质可见纤维组织条索(图17)。黏液细胞常为柱状、立方状或呈透明细胞样,形态较温和,胞质丰富含黏液,异型性小,表皮样细胞可见细胞间桥,但不会出现角化或角化珠,中间型细胞呈椭圆或多边形,核圆,胞质嗜酸性或嗜双色,有时透明(图18)。MEC分级可参照乳腺癌分级标准或涎腺MEC分级标准,研究显示,两种分级方法具有一致性[26]。低级别MEC通常由囊性和实性成分构成,以黏液细胞为主,占肿瘤50%以上。囊性区可见温和的黏液细胞,胞质丰富,异型性小。实性区由数量不等表皮样和中间型细胞组成,无坏死,肿瘤细胞由纤维性间质包绕。高级别MEC以实性为主,主要由表皮样或中间型细胞构成,黏液细胞较少(<10%)。肿瘤细胞异型性明显,可见坏死、核分裂象增多。罕见的中级别MEC亦有报道[26]。原位病变亦可见。免疫组织化学因细胞类型而异,表皮样和中间型细胞常高相对分子质量细胞角蛋白(如CK5/6、CK14、34βE12)、p63阳性(图19);黏液细胞CK7阳性。ER、PR和HER2多为阴性。乳腺标志物(GATA3、Mammaglobin)可阳性[1]。阿辛蓝-过碘酸雪夫(AB-PAS)染色(图20)和黏液卡红染色可显示黏液分泌细胞。
涎腺MEC典型分子特征为t(11;19)(q13;p13)易位,导致CRTC1-MAML2融合基因产生,乳腺MEC亦存在CRTC1-MAML2融合基因[27]。组织学级别是影响乳腺MEC预后的重要因素[12]。非高级别的MEC患者少见腋窝淋巴结转移和复发,即使术后无辅助治疗,预后亦良好。而高级别MEC患者更常见远处转移和复发,出现进展性死亡,预后较差,临床应对这类患者采取积极的综合治疗方式。
乳腺PmA是一种罕见的、由单一肿瘤细胞群构成多种形态结构的浸润性癌,组织学形态类似于涎腺PmA。目前文献报道仅有4例[28, 29],均为女性患者,年龄37~74岁,肿瘤主要表现为可触及的乳腺肿块,直径1.3~4.0 cm。镜下肿瘤中央呈大的实性细胞巢,周边围绕着腺泡状、筛状及小梁状结构。在某些区域,肿瘤细胞可呈现经典型浸润性小叶癌的单行排列方式[28]。肿瘤细胞小而圆,形态一致,可见中位核,核仁常不明显,核分裂象常见,未见坏死。免疫组织化学示肿瘤细胞ER、PR、HER2均为阴性;bcl-2阳性,CK7和E-cadherin灶性阳性,可表达EMA、CK14、CD117[29]。诊断主要依靠组织学形态特征。因PmA少见,其诊断需谨慎,当组织学鉴别诊断有困难时,需借助免疫组织化学及分子检测除外其他肿瘤类型(如浸润性小叶癌、AdCC等)。
涎腺PmA中存在PRKD1突变与PRKD1-3重排,在乳腺PmA中尚未见报道。目前以手术治疗为主,术后可辅助放疗。由于病例较少,预后尚无定论,文献中1例患者在术后3年内发生了广泛转移导致死亡[28]。总体而言,乳腺PmA生长缓慢,但具有侵袭性与转移能力,其形态学特征及生物学行为更趋于高级别TNBC[4],临床治疗宜采取积极态度。
乳腺TCCRP是一种罕见、特殊类型的浸润性癌,其特征为核极性反转的高柱状细胞呈实性或实性乳头状排列。TCCRP最早于2003年由Eusebi等[30]发现并报道5例,因其形态学类似甲状腺乳头状癌的高细胞亚型,曾被命名为“类似于高细胞亚型甲状腺乳头状癌的乳腺肿瘤”。后续的病例研究,从形态学、免疫表型、分子遗传学改变以及生物学行为等方面增进了对该肿瘤的认识。第5版分类中,将该肿瘤的名称确定为伴有极性反转的高细胞癌[1]。乳腺TCCRP罕见,目前国内报道6例[31, 32, 33]。多发生在绝经后女性,平均年龄63岁,临床上常单发,偶见多发,表现为乳腺无痛性肿块,平均最大径2.7 cm(0.7~8.5 cm)。
TCCRP组织学形态表现为实性乳头状结构,部分巢团内含细小的纤维血管轴心,乳头轴心常见泡沫细胞。实性区细胞巢常被毛细血管包绕,有时可伴有嗜双色性胶样分沁物。肿瘤细胞呈高柱状,胞质细颗粒状,嗜酸性,胞核圆形或卵圆形,具有极性反转(细胞核位于腔面,而非基底)特征,可见核沟、核内包涵体,核分裂象少见。免疫组织化学示病变周围缺乏肌上皮细胞,肿瘤细胞CK5/6强阳性。CK7和Calretinin阳性[34],ER、PR和HER2多为阴性或ER/PR弱阳性,雄激素受体(AR)可阳性。乳腺标志物(GCDFP15、GATA3、Mammaglobin)可阳性,神经内分泌标记为阴性。
此外,TCCRP主要与转移性甲状腺乳头状癌鉴别,后者免疫组织化学甲状腺转录因子1(TTF1)、甲状腺球蛋白(TG)、PAX8阳性,HMBE1、Galectin3、CK19阳性。最新研究证实了免疫组织化学单克隆抗体IDH2 R172S在TCCRP中的诊断灵敏度是93%,特异度为100%[34],可用于TCCRP的辅助诊断。在分子遗传学特征方面,TCCRP缺乏甲状腺乳头状癌中常见的BRAF基因和RET基因突变,而具有特异性的IDH2p.Arg172热点突变[34],这在其他乳腺肿瘤中非常罕见。
TCCRP具有惰性的生物学行为[2,12]。手术切除是主要治疗方法,随访期间多数患者无复发,预后良好。目前尚难以评价对该类肿瘤行前哨淋巴结活检、放疗和全身治疗的价值,有待于更多病例的积累。有学者建议对其行保守的临床处理即可[35]。
综上所述,本文重点介绍了乳腺少见及涎腺型肿瘤的形态学、分子特征、预后及临床治疗方式。该类肿瘤病例数较少,除多形性腺癌外,大部分此类肿瘤具有低侵袭性,属于预后良好的低级别TNBC。病理诊断过程中需借助免疫组织化学和分子检测与预后较差的高度恶性的TNBC进行区分,以避免过度诊断和治疗。2022版美国国立综合癌症网络(NCCN)乳腺癌诊疗指南将这部分肿瘤归为“预后良好的组织学类型”,并提出现有的有限数据支持局部治疗,仅对淋巴结阳性者考虑行全身或靶向治疗。此外,本文提到的个别亚型(如SB-AdCC、HG-AdCC、高级别MEC等)肿瘤具有高侵袭性,生物学行为类似高度恶性的TNBC,临床应采取积极的综合治疗措施,手术治疗辅以术后放化疗,但是新辅助化疗的意义尚不明确。总之,对于乳腺少见及涎腺型肿瘤患者,准确的病理诊断是临床合理治疗的必要前提,为该类肿瘤患者制定个体化的精准治疗方案尤为重要。
所有作者声明无利益冲突



























