
报道1例发生于直肠及乙状结肠系膜的伴有JAZF1-BCORL1基因融合的高级别子宫内膜间质肉瘤,继发于异位的子宫内膜。本例发病部位罕见、形态特殊、分子改变罕见,容易误诊。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,43岁。因停经36 d,持续下腹痛就诊。孕4产2,2018年曾行子宫黏膜下肌瘤摘除术,无特殊家族史。CT示子宫-直肠陷凹内异常低密度影增多,局部密度不均,增强后见不规则线样结节状异常强化(图1),左侧盆腔见大小约8.8 cm×6.3 cm×5.8 cm团块样混杂低密度灶,界清,增强后未见强化;考虑子宫-直肠陷凹、左侧盆腔囊实性占位性病变。2021年10月11日于外院行肠系膜肿瘤切除术,术中见子宫后方直肠中段系膜上见大小约7.0 cm×6.0 cm,乙状结肠系膜上见大小约10.0 cm×8.0 cm囊实性包块。术后病理考虑间叶源性肿瘤,于2021年12月来院会诊。
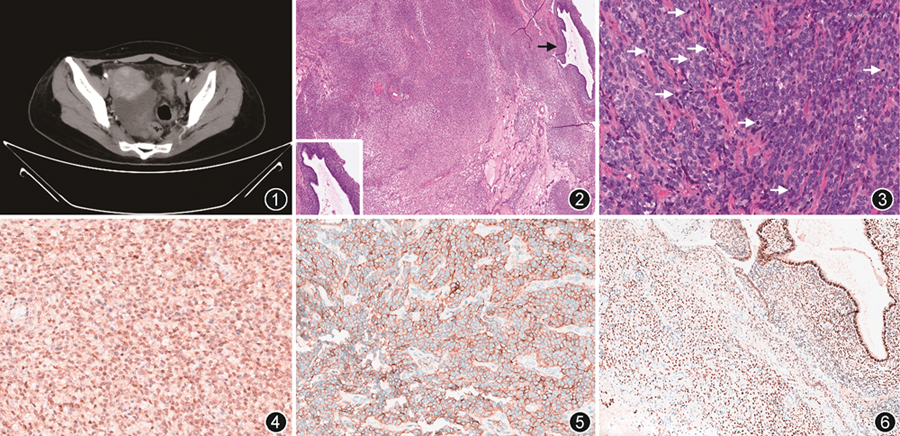

病理检查:灰白灰红碎肿瘤组织一堆,大小约8.0 cm×8.0 cm×2.0 cm,切面质嫩,部分组织半透明状。原单位主要病理诊断(直肠中段系膜、乙状结肠系膜)间叶源性肿瘤,倾向肌纤维母细胞肿瘤,中度恶性,建议分子检测明确诊断。病理会诊:镜下肿瘤组织破碎,细胞呈卵圆或短梭形,可见细胞丰富区和稀疏区交替分布的疏密相间的组织形态,细胞稀疏区伴间质显著黏液样水肿变性,细胞丰富区间质内可见胶原形成,肿瘤细胞轻至中度异型,核分裂象活跃区约18个/10 HPF。局灶区域见残存的子宫内膜异位腺体与间质(图2,3)。免疫组织化学:BCOR、结蛋白、雌激素受体(ER)、孕激素受体(PR)、CD10、p16均弥漫阳性,h-caldesmon、平滑肌肌动蛋白(SMA)、间变性淋巴瘤激酶(ALK,D5F3)、CD117、CD34、cyclin D1均阴性,Ki-67阳性指数约70%。子宫内膜异位腺体PAX8、ER、PR均弥漫阳性,腺体周围间质CD10弥漫阳性(图4, 5, 6)。分子检测:二代测序检测到JAZF1-BCORL1基因融合(图7),荧光原位杂交(FISH)检测CDK4基因无扩增。2022年1月磁共振成像(MRI)及正电子发射计算机断层显像(PET-CT)检查均提示盆腹腔仍有肿瘤,2月11日患者于我院行补充全子宫双附件及盆腹腔肿瘤减灭术。大体检查:子宫及双附件未见异常,盆底腹膜见肿瘤结节1枚,最大径1.0 cm;大网膜、乙状结肠、直肠及小肠系膜表面均见肿瘤结节,最大径0.5~2.0 cm。镜下形态同会诊切片所见,结合免疫组织化学结果,术后(子宫后壁盆底腹膜、大网膜、乙状结肠、直肠、及小肠系膜表面结节)均见相同形态的肿瘤组织。(全子宫+双附件)子宫内膜呈分泌期形态,慢性宫颈炎,卵巢及输卵管均未见肿瘤累及。

病理诊断:(直肠中段系膜、乙状结肠系膜)结合形态、免疫表型和分子检测,符合子宫外的高级别子宫内膜间质肉瘤伴JAZF1-BCORL1基因融合,起源于异位的子宫内膜组织。
治疗及随访:患者术后行TP(紫杉醇+顺铂)方案化疗,随访8个月,情况良好,无复发。
讨论:子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是起源于子宫内膜间质的恶性肿瘤,其发生率在子宫恶性肿瘤中<1%。ESS也可发生于子宫外,胃肠道是最常见的部位,此外可见于卵巢、子宫直肠陷窝、网膜、直肠等部位,其大多数存在子宫内膜异位的基础病变。Sampson[1]提出了诊断肿瘤来源于子宫内膜异位病灶的标准:存在子宫内膜异位证据,可见肿瘤与内膜异位病灶相互移行,子宫无相应原发性肿瘤,组织学形态支持肿瘤来源于子宫内膜。本例在直肠系膜肿瘤周边见子宫内膜异位病灶,补充手术后证实子宫无原发ESS病变,形态、免疫组织化学及分子检测结果均支持起源于异位子宫内膜组织的高级别子宫内膜间质肉瘤(HGESS)这一诊断。
随着分子病理的快速发展,HGESS作为一种独立的疾病被重新认识,常见的遗传学异常是t(10;17)(q22;p13)导致YWHAE-FAM22基因融合[2]。2020年第5版WHO女性生殖系统肿瘤分类提出了HGESS的新亚型,包括ZC3H7B-BCOR基因融合[3]和BCOR基因内部串联复制(ITD)肉瘤[4]。BCOR基因位于染色体Xp11.4上,编码BCOR蛋白,与bcl-6因子结合,是PRC1的组成部分,增强PRC1的转录抑制功能。关于BCOR基因重排在ESS发生中的机制尚不明确,可能参与破坏了PRC1复合物的形成。
研究报道伴BCOR基因融合的HGESS[3,5, 6],患者中位年龄54岁,预后较差,常伴有肿瘤复发、转移或死亡。组织学特征:肿瘤呈舌状浸润,肿瘤细胞疏密不均,间质可见丰富的黏液样基质,或伴胶原形成,肿瘤细胞呈梭形,轻至中度异型性,核多形性,核分裂象易见。肿瘤细胞弥漫表达CD10、cyclin D1和BCOR,部分性表达ER、PR。研究发现伴BCOR基因重排的HGESS常伴有CDK4或MDM2基因扩增[7, 8]。
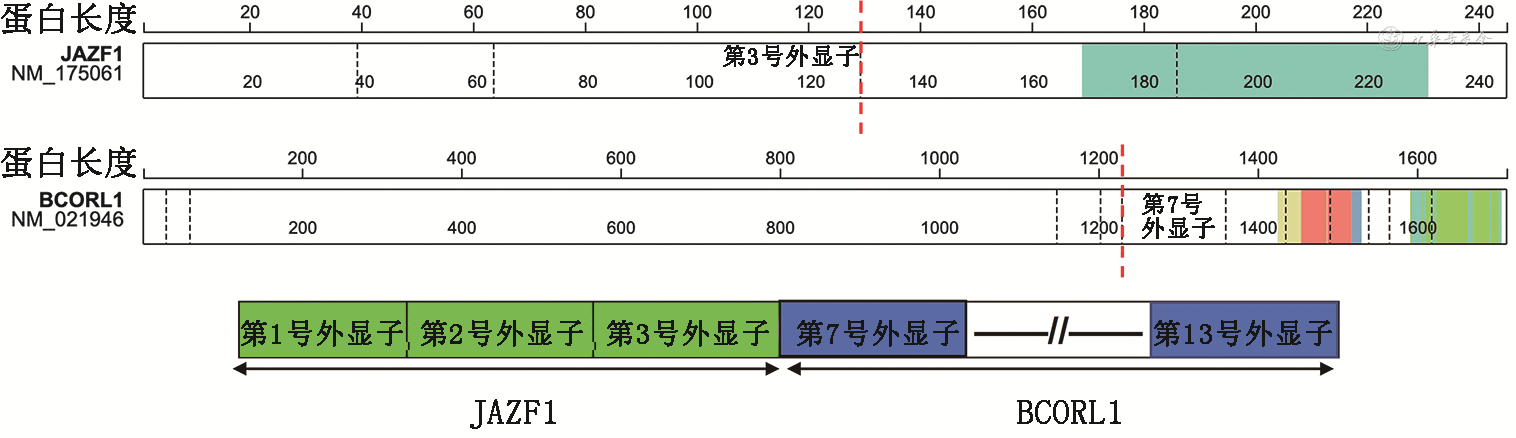
此外,少数HGESS病例伴有EPC1-BCOR、JAZF1-BCORL1和BRD8-PHF1基因融合[9, 10, 11]。其中BCORL1是与BCOR同源的转录辅助抑制因子,两者在基因转录调控过程中具有相似的生物学功能,BCORL1可与BCOR互换形成PRC1复合物变异体,发挥转录抑制功能。目前为止,关于BCORL1基因异常在子宫内膜间质肉瘤中的报道共14例,包括6例BCORL1基因易位(4例JAZF1-BCORL1基因融合、1例EP300-BCORL1基因融合、1例BCORL1自身重排)、6例BCORL1无义突变、2例BCORL1纯合性缺失[10,12]。第1例报道的伴JAZF1-BCORL1基因融合的ESS,诊断为低级别ESS(原发病灶形态未展示),复发病灶的形态级别更高,肿瘤具有侵袭性的临床经过,患者术后第5年发生了ESS的腹部复发转移[10],不除外是原发低级别ESS复发后级别升高。Lin等[12]报道了12例伴BCORL1基因异常的HGESS(其中3例JAZF1-BCORL1基因融合),患者年龄、组织学形态、免疫表型、分子异常及预后均与伴BCOR基因重排的HGESS相似。该组患者平均年龄57.5岁,预后较差,2例患者于术后11个月死亡。主要组织学形态包括肿瘤细胞呈梭形,疏密不等,伴间质黏液变性,黏液水肿区细胞稀疏,伴低度异型性,还可见数量不等的伴高度异型的上皮样细胞区及多少不等的纤维胶原。肿瘤细胞弥漫表达CD10、ER、PR、cyclin D1,此组病例未进行BCOR的免疫组织化学染色。分子改变上,50%伴BCORL1易位的HGESS病例同时伴有CDK4基因扩增或CDKN2A缺失,与伴BCOR易位的HGESS相同。不同的是,部分BCORL1易位的病例还伴有NF1基因改变及mTOR-NF2-AKT通路的异常。
本例患者43岁,是目前报道中发病年龄较小的病例,为发生于子宫外的伴BCORL1基因融合的HGESS病例。该肿瘤发生于肠系膜,多发,体积较大,起源于异位的子宫内膜组织。与文献报道相同,镜下见肿瘤细胞梭形,呈疏密相间分布,稀疏区间质黏液水肿样,细胞轻至中度异型性,核分裂象活跃;但未见上述报道中提及的数量不等的高度异型的上皮样细胞区。与文献报道相似,本例肿瘤细胞弥漫表达CD10、ER、PR、BCOR,但cyclin D1阴性,FISH检测未发现CDK4扩增。
鉴别诊断:(1)黏液性平滑肌肉瘤:依照形态学特征最易与此肿瘤混淆,但黏液性平滑肌肉瘤生长方式更具破坏性,肿瘤边界不规则,浸润性生长,肿瘤细胞均匀分布于黏液样基质中,梭形细胞形态较温和,细胞轻至中度不典型性,细胞核呈雪茄样,核分裂象低;肿瘤细胞明确表达肌源性标志物结蛋白、SMA、h-caldesmon,缺乏BCOR/BCORL1基因易位。(2)子宫炎性肌纤维母细胞肿瘤(IMT):也可伴有黏液样变性的间质,且细胞梭形,可表达CD10,不同的是IMT间质常见炎性细胞浸润,梭形细胞为成纤维细胞和肌成纤维细胞,细胞核呈空泡状、可见显著的核仁,有时可见核内包涵体,肿瘤细胞特征性表达ALK(D5F3)蛋白并伴ALK相关易位。(3)低级别子宫内膜间质肉瘤(LGESS):该类肿瘤细胞常比较温和,呈短梭形及小圆形,间质可见螺旋小动脉,细胞核仅轻度异型性,核分裂象不常见;肿瘤细胞弥漫表达ER、PR,而伴BCOR/BCORL1基因易位的HGESS弥漫表达cyclin D1和BCOR,分子检测到JAZF1-SUZ12、JAZF1-PHF1等基因融合有助于LGESS的诊断。
目前,HGESS的治疗仍以手术及化疗为主。伴BCORL1易位HGESS病例检出CDK4扩增或CDKN2A的缺失,使得CDK4抑制剂有望成为HGESS靶向治疗的新方向,仍待进一步的研究。此外伴BCORL1易位的HGESS中发现有NF1基因的失活,及mTOR-NF2-AKT通路的改变,MEK抑制剂或mTOR抑制剂也可望成为BCORL1易位HGESS治疗的新方法[12]。
伴有BCORL1基因易位的HGESS报道十分有限,本例为发生于直肠系膜异位子宫内膜基础上的伴JAZF1-BCORL1基因融合的HGESS。病例尚少,还需更多的病例积累以提高病理医师的认识,避免误诊,并寻求基于分子发生机制上的诊治方法。
李慧, 姚茜岚, 包龙龙, 等. 子宫外伴JAZF1-BCORL1基因融合的高级别子宫内膜间质肉瘤1例[J]. 中华病理学杂志, 2023, 52(6): 621-623. DOI: 10.3760/cma.j.cn112151-20221128-01003.
所有作者声明无利益冲突



























