
胃癌是常见的消化道恶性肿瘤,严重威胁人民的生命健康。筛查是降低疾病发生率和死亡率的主要手段,也是防治的重要策略。文章通过检索中国知网、万方数据知识服务平台、PubMed和EMbase等数据库,对国内外胃癌筛查的情况进行总结分析。胃癌筛查地区主要在亚洲东部,筛查方法以胃镜检查和指示性活检为主,筛查起始年龄为40岁及以上。开展高危人群筛查,是中国胃癌防治的重点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是常见的消化道恶性肿瘤,居恶性肿瘤死因第3位[1]。我国是胃癌高发大国,新发病例数和死亡病例数分别为全球的44.1%和49.9%,2015年发病率约为29.3/10万,死亡率约21.2/10万[1,2]。近年来,政府投入大量人力、物力和财力致力于胃癌筛查工作,并取得有效成果。在上消化道癌高发地区开展一次性胃镜筛查,可明显降低患者死亡率和筛查人群的累积发病率[3]。有研究显示,在亚洲国家开展胃镜筛查可以降低胃癌死亡率[4]。目前,我国胃癌5年生存率仅为35.1%[5],远低于开展全国性胃癌普查的日本(60.3%)和韩国(68.9%)[6]。由于早期胃癌无特异性症状和体征,大部分患者发现时已为进展期,预后差。因此,确定高危人群,提高胃癌的早期诊断率对改善胃癌预后具有十分重要的意义[7]。基于中国知网、万方数据知识服务平台、PubMed和EMbase等数据库,我们检索国内外公开发表的胃癌筛查方法和胃癌高危人群模型的流行病学相关研究(中文关键词有胃癌、筛查、胃镜、幽门螺杆菌(helicobacter pylori,Hp)、胃蛋白酶原(pepsinogen, PG)和胃泌素17(gastrin-17, G-17),英文关键词有gastric cancer, cancer screening, gastroscopy, endoscopy, helicobacter pylori, pepsinogen and gastrin-17,阐述了胃癌筛查领域的研究进展,以期为胃癌防控制定提供科学依据和研究方向。
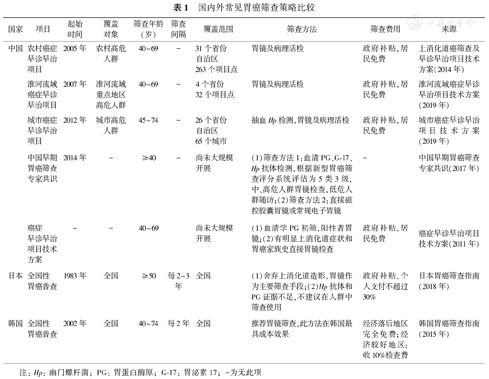
2005年,我国卫生部启动农村恶性肿瘤高发区癌症早诊早治项目,胃癌是重点防治对象。2007年,卫生部启动淮河流域癌症早诊早治项目,加强淮河流域的上消化道恶性肿瘤的筛查。2012年,城市癌症早诊早治项目正式纳入国家重大公共卫生服务项目。目前,胃癌筛查手段主要有胃镜(电子胃镜、高清筛查胃镜和磁控胶囊胃镜等)和血清学筛查(Hp检测、血清PG、G-17和常见肿瘤标志物)。我国相继启动的上消化道癌筛查项目,筛查年龄农村地区居民为40~69岁,城市居民为45~74岁。普查前先问卷评估,锁定高危人群后再行胃镜筛查。2018年日本胃癌筛查指南指出,针对50岁及以上居民开展每2~3年1次的胃镜筛查,Hp抗体和血清PG由于证据不足,不建议在人群筛查中使用[8]。韩国于2002年启动全国性胃癌筛查,2015年发布的胃癌筛查指南,推荐40~74岁居民每2年进行1次胃镜筛查[9]。美国、英国和加拿大等欧美国家目前尚无常规或标准胃癌筛查方法。国内外胃癌筛查策略的比较见表1[8,9]。
国内外常见胃癌筛查策略比较
国内外常见胃癌筛查策略比较
| 国家 | 项目 | 起始时间 | 覆盖对象 | 筛查年龄(岁) | 筛查间隔 | 覆盖范围 | 筛查方法 | 筛查费用 | 来源 |
|---|---|---|---|---|---|---|---|---|---|
| 中国 | 农村癌症早诊早治项目 | 2005年 | 农村高危人群 | 40~69 | - | 31个省份自治区263个项目点 | 胃镜及病理活检 | 政府补贴,居民免费 | 上消化道癌筛查及早诊早治项目技术方案(2014年) |
| 淮河流域癌症早诊早治项目 | 2007年 | 淮河流域重点地区高危人群 | 40~69 | - | 4个省份32个项目点 | 胃镜及病理活检 | 政府补贴,居民免费 | 淮河流域癌症早诊早治项目技术方案(2019年) | |
| 城市癌症早诊早治项目 | 2012年 | 城市高危人群 | 45~74 | - | 26个省份自治区65个城市 | 抽血Hp检测,胃镜及病理活检 | 政府补贴,居民免费 | 城市癌症早诊早治项目技术方案(2019年) | |
| 中国早期胃癌筛查专家共识 | 2014年 | - | ≥40 | - | 尚未大规模开展 | (1)筛查方法1:血清PG、G-17、Hp抗体检测,根据新型胃癌筛查评分系统评估为5类3级,中、高危人群胃镜检查,低危人群随访;(2)筛查方法2:直接磁控胶囊胃镜或常规电子胃镜 | - | 中国早期胃癌筛查专家共识(2017年) | |
| 癌症早诊早治项目技术方案 | - | - | 40~69 | 尚未大规模开展 | (1)血清学PG初筛,阳性者胃镜;(2)有明显上消化道症状和胃癌家族史直接胃镜检查 | 政府补贴,居民免费 | 癌症早诊早治项目技术方案(2011年) | ||
| 日本 | 全国性胃癌普查 | 1983年 | 全国 | ≥50 | 每2~3年 | 全国 | (1)舍弃上消化道造影,胃镜作为主要筛查手段;(2)Hp抗体和PG证据不足,不建议在人群中筛查使用 | 政府补贴,个人支付不超过30% | 日本胃癌筛查指南(2018年) |
| 韩国 | 全国性胃癌普查 | 2002年 | 全国 | 40~74 | 每2年 | 全国 | 推荐胃镜筛查,此方法在韩国最具成本效果 | 经济落后地区完全免费;经济较好地区:收10%检查费 | 韩国胃癌筛查指南(2015年) |
注:Hp: 幽门螺杆菌; PG: 胃蛋白酶原; G-17: 胃泌素17; -为无此项
胃镜活检是胃癌筛查公认的金标准。(1)胃镜筛查的流行病学效果:基于上消化道癌高发区(如河南省林州、山东省肥城和河北省磁县等)开展胃镜筛查一定程度上可降低胃癌死亡率[10,11]。一项汇总前瞻性队列研究的循证医学证据表明,胃镜筛查可以降低胃癌死亡风险[4]。(2)卫生经济学效果:胃镜筛查符合成本-效益原则[12,13]。韩国全国性上消化道恶性肿瘤筛查项目显示,胃镜筛查在韩国是最具成本效果的胃癌筛查手段[14]。目前,我国消化道胃镜筛查多以40或45岁为起始年龄,筛查年龄和筛查间隔仍需前瞻性研究和卫生经济学证据支持。我国地域广阔,卫生资源分布不均衡,基层医院的诊断规范、经验和技术水平参差不齐,如何提高筛查参与率和依从性也是今后工作的重点和研究方向。
磁控胶囊胃镜是新兴的胃癌筛查技术,对胃部疾病的早发现和早诊断有重要作用[15,16]。磁控胶囊胃镜检查无创伤、痛苦小,可为老人、儿童和不适合传统胃镜检查者使用。目前,磁控胶囊胃镜已获得中国早期胃癌筛查专家共识的认可,在我国多中心现场的验证中取得良好效果[15,16]。有研究显示,磁控胶囊胃镜和传统电子胃镜诊断胃部疾病的准确性一致[17,18]。磁控胶囊胃镜检查费用比传统电子胃镜高,考虑到资源有效合理配置,若磁控胶囊胃镜在筛查人群中大规模推广应用,需考虑付费机制。磁控胶囊胃镜可能还需更多长期流行病学和卫生经济学效果证据进一步支撑。
目前,我国尚未开展全国性的胃癌筛查计划,现行的胃癌筛查指南建议,对≥40岁或≥45岁的胃癌高风险人群进行胃镜筛查。我国胃癌风险人群超过3亿[19],考虑到经济资源和医疗卫生资源的优化配置,迫切需要在胃镜检查前对筛查人群进行风险分层,实现高危人群筛选,提高筛查效能。我们从胃癌筛查指标和胃癌高危人群模型角度系统梳理了胃癌筛查策略,为优化胃癌筛查方案提供证据。
目前,国际上普遍认为Hp通过肠型胃癌发生的多步骤假说导致胃癌发生,即从正常胃黏膜→慢性非萎缩性胃炎→萎缩性胃炎→肠化生→异型增生→肠型胃癌[20]。Hp被国际癌症研究署(International Agency for Research on Cancer, IARC)列为人类胃癌Ⅰ类致癌原。前瞻性研究显示,Hp感染者进展为异型增生或胃癌的风险增加80%[21]。我国人群中Hp感染率约为58%,胃癌高发的主要病因之一为Hp感染[22,23]。血清Hp抗体检测廉价、快速,容易被患者接受,被广泛应用于流行病学调查。目前,我国早期胃癌筛查指南中也推荐使用血清Hp抗体初筛胃癌高危人群。但血清Hp抗体检测无法区分Hp感染是既往感染还是现症感染,也不能评估根除后治疗效果[24],人类宿主的个体遗传差异对Hp抗体水平也有较大影响。日本筛查指南建议,Hp抗体由于证据不足,不建议在人群中筛查胃癌高危人群使用[8]。另外,呼气试验诊断是检测Hp感染最常用的非侵入性检查方法,并用于Hp治疗的疗效评估。有研究显示,呼气试验检测Hp感染的灵敏度为0.96,特异度为0.93。但当呼气试验检测值接近临界值时,结果不可靠[25,26]。
1998年,在PG比值(pepsinogen ratio, PGR)和PGⅠ降低的人群中,胃癌发病率远高于不降低者,且普查检出的胃癌中,90%属于早期癌[27]。一项对42项研究PG准确度汇总的Meta分析显示,汇总灵敏度为0.77,特异度为0.73[28]。另一项汇总31项研究PG准确度的Meta分析显示,汇总灵敏度为0.70,特异度为0.79[29]。以血清PG为初筛,再行胃镜检查,可提高早期胃癌和癌前病变的检出率[30]。日本和芬兰等欧洲国家将血清PG应用到胃癌筛查或预防干预计划中[31]。PGⅠ浓度≤70 μg/L且PGR ≤3.0是最常用的筛查胃癌高危人群的参考范围[28,29,32]。我国癌症早诊早治项目工作方案指出,<50岁、PGⅠ浓度≤70 μg/L、PGR≤9.0以及≥50岁、PGⅠ浓度≤70 μg/L、PGR≤7.5均为胃癌高危人群。2014年我国早期胃癌筛查专家共识指出,胃癌筛查采用PGⅠ浓度≤70 μg/L且PGR≤7.0筛选高危人群[19]。2017年,在我国早期胃癌筛查专家共识中,将PGR=3.89作为临界值,PGR<3.89的人群为胃癌高危人群[15]。血清PG浓度受地区、种族、膳食、感染和环境因素的影响[33]。目前,用于胃癌筛查的PG临界值尚未统一,需建立国家级的统一标准,这需要更多大样本、多中心、高质量的前瞻性研究证据支持。日本最新指南提出,PG由于证据不足,不建议在人群中胃癌筛查使用[8]。
多项研究表明,胃癌患者血清G-17水平的升高或下降均能反映胃窦黏膜萎缩情况,可作为早期胃癌筛查指标之一[34,35]。G-17诊断萎缩性胃炎的灵敏度较低(0.48),特异度尚可(0.79)[36]。2017年发布的早期胃癌筛查流程专家共识提出,当G-17>1.50 pmol/L时,胃癌发生风险显著增高[15]。一项汇总G-17诊断萎缩性胃炎临界值的Meta分析显示,纳入13项研究的G-17临界值不尽相同,范围为1~13 pmol/L[36]。目前,大多研究未区分胃窦萎缩和胃体萎缩,低质量的研究设计可能导致G-17准确性的高估,鉴于胃泌素作用的复杂性且易受多种因素影响,因此不推荐G-17单独作为胃癌筛查标志物[14,36]。
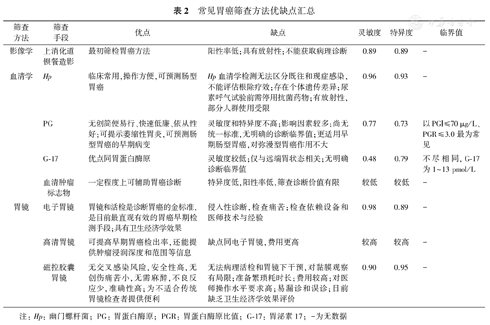
常见胃癌筛查方法的优缺点分析见表2[24,25,28,29,32,36]。
常见胃癌筛查方法优缺点汇总
常见胃癌筛查方法优缺点汇总
| 筛查方法 | 筛查手段 | 优点 | 缺点 | 灵敏度 | 特异度 | 临界值 |
|---|---|---|---|---|---|---|
| 影像学 | 上消化道钡餐造影 | 最初筛检胃癌方法 | 阳性率低;具有放射性;不能获取病理诊断 | 0.89 | 0.89 | - |
| 血清学 | Hp | 临床常用,操作方便,可预测肠型胃癌 | Hp血清学检测无法区分既往和现症感染,不能评估根除疗效;存在个体遗传差异;尿素呼气试验前需停用抗菌药物;有放射性,部分人群使用受限 | 0.96 | 0.93 | - |
| PG | 无创简便易行、快速低廉、依从性好;可提示萎缩性胃炎,可预测肠型胃癌的早期病变 | 灵敏度和特异度不高;影响因素较多;尚无统一标准,无明确的诊断临界值;更适用早期肠型胃癌,对弥漫型胃癌作用不大 | 0.77 | 0.73 | 以PGⅠ≤70 μg/L、PGR≤3.0最为常见 | |
| G-17 | 优点同胃蛋白酶原 | 灵敏度较低;仅与远端胃状态相关;无明确诊断临界值 | 0.48 | 0.79 | 不尽相同,G-17为1~13 pmol/L | |
| 血清肿瘤标志物 | 一定程度上可辅助胃癌诊断 | 特异度低,阳性率低,筛查诊断价值有限 | 较低 | 较低 | - | |
| 胃镜 | 电子胃镜 | 胃镜和活检是诊断胃癌的金标准,是目前最直观有效的胃癌早期检测手段;具有卫生经济学效果 | 侵入性诊断,检查痛苦;检查依赖设备和医师技术与经验 | 0.98 | 0.89 | - |
| 高清胃镜 | 可提高早期胃癌检出率,还能提供肿瘤浸润深度和范围等信息 | 缺点同电子胃镜,费用更高 | 较高 | 较高 | - | |
| 磁控胶囊胃镜 | 无交叉感染风险,安全性高,无创伤痛苦小,无需麻醉,不良反应少,准确性高;为不适合传统胃镜检查者提供便利 | 无法病理活检和胃镜下干预,对黏膜观察有局限;准备繁琐耗时长;费用较高;对医师操作水平要求高;易漏诊和误诊;目前缺乏卫生经济学效果评价 | 0.90 | 0.95 | - |
注:Hp: 幽门螺杆菌; PG: 胃蛋白酶原; PGR: 胃蛋白酶原比值; G-17: 胃泌素17; -为无数据
目前,全球范围内尚无统一的高质量胃癌高危人群风险预测模型。2018年我国早期胃癌筛查专家共识提出的新型胃癌筛查评分模型,为胃癌高危人群风险预测模型提供了思路和方向[15]。胃癌筛查评分模型综合了人口学因素和血清指标进行联合初筛,具体包括年龄、性别、PG、G-17和Hp抗体,分别赋予不同分值,划分为3个等级(高危、中危和低危)。胃癌筛查评分模型已通过验证,证实了其胃癌筛查效能[37]。新型胃癌筛查评分模型在应用到大样本之前可能需更多的队列研究和随机对照试验来验证结果的可靠性和稳定性,同时观察模型的长期效果和效益。
2011年日本推荐,采用血清PG与Hp抗体联合法(ABC模型)筛查胃癌,早期胃癌检出率显著提高,同时还能够检测出血清PG阴性的胃癌[38,39]。在日本西市进行大规模胃癌机会性的筛查中,将PGⅠ≤70 μg/L且PGR≤3.0界定为PG阳性,血清Hp抗体滴度≥30 U/ml界定为Hp阳性,按危险等级分为A、B、C、D组(表3),胃癌风险逐渐升高[19,30,40]。有研究显示,Hp、PG和胃镜联合筛查比单纯胃镜筛查更具成本效果[41]。

胃癌高危人群评估模型
胃癌高危人群评估模型
| 模型 | 变量 | 评分方法 | 曲线下面积(95%CI) |
|---|---|---|---|
| 新型胃癌筛查评分模型 | 年龄、性别、PGR、G-17、Hp | 赋予每个变量不同权重分值,总分0~23分,根据分值分为3个等级:0~11分为胃癌低危人群,12~16分为胃癌中危人群,17~23分为胃癌高危人群 | 0.757(0.729~0.786) |
| 血清PG与Hp抗体联合模型 | PGⅠ、PGR、Hp | (1)A组a: PG阴性Hp阴性; B组a: PG阴性Hp阳性; C组a: PG阳性Hp阳性; D组a: PG阳性Hp阴性; (2)PG阳性:PGⅠ≤70 μg/L且PGR≤3.0;Hp阳性:Hp抗体滴度≥30 U/ml | 0.527(0.476~0.579) |
| 血清PG与G-17联合模型 | PGⅠ、PGR、G-17 | (1)A组a: G-17阴性PG阴性;B组a: G-17阳性PG阴性; C组a: G-17阴性PG阳性;D组a: G-17阳性PG阳性;(2)G-17阳性: G-17≤1 pmol/L或G-17≥15 pmol/L;(3)PG阳性: PGI≤70 ng/ml且PGR≤7.0 | - |
| 血清PG、G-17和Hp抗体联合模型 | PGⅠ、PGⅡ、PGR、G-17、Hp | 赋予每个变量不同权重分值,总分0~21分;根据分值分为4个等级:0~2分、3~8分、9~13分和14~21分,风险依次增大 | 0.589(0.548~0.630) |
注: PG: 胃蛋白酶原; PGR: 胃蛋白酶原比值; G-17: 胃泌素17;Hp: 幽门螺杆菌; a A、B、C、D组在胃癌风险预测模型中胃癌发生风险递增; -为无数据
胃癌在亚洲、南美和东欧地区发病率较高[1],胃癌筛查研究相对集中在中国、日本和韩国。美国国立癌症中心指出,胃癌在美国并不常见,目前尚无标准或常规筛查试验。世界卫生组织、国际抗癌联盟、IARC尚未有相关胃癌筛查指南或方案。与我国胃癌筛查现状比较,日本和韩国胃癌筛查优势可能在于实施了全国性胃癌普查,我国更多是地区性筛查,比如高发区、农村地区和城市地区。我国现行的胃癌筛查指南多建议从40岁或45岁开始对胃癌高风险人群进行胃镜筛查;韩国筛查起始年龄与我国相似,为40岁;日本筛查起始年龄由40岁更新为50岁。至于筛查间隔,日本和韩国推荐每2~3年进行1次胃癌筛查,我国仍需进一步的前瞻性研究和卫生经济学研究证据推荐筛查间隔时间。
国务院近年来印发和出台的《十三五卫生与健康规划》、《中国防治慢性病中长期规划》和《健康中国行动(2019—2030年)》,围绕疾病预防和健康促进两大核心,将恶性肿瘤防治列入重大专项行动。我国在借鉴国外胃癌筛查模式的同时,应结合我国国情以及胃癌流行病学现状,寻找适合我国国情的早期胃癌筛查方法,同时仍需更多大规模、多中心、高质量的流行病学和临床研究提供科学证据,提高早期胃癌早诊早治率和5年生存率,降低胃癌死亡率,延长患者生命,提高患者生活质量。
所有作者均声明不存在利益冲突



























