
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
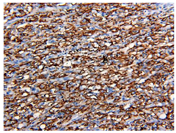
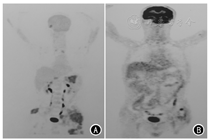
患者男,65岁,因左侧髋部及下肢疼痛1周余,于2018年7月就诊于吉林大学中日联医院。7月23日正电子发射计算机体层摄影(positron emission tomography-computed tomography, PET-CT)检查示,左侧髂骨、髋臼糖代谢增高伴骨质密度不均匀,局部骨质破坏伴软组织密度影形成,最大标准摄取值(SUVmax)为16.90。行超声引导下左侧髂骨肿物穿刺,病理诊断:不除外肿瘤性病变。先后于北京积水潭医院、北京大学肿瘤医院、北京中日友好医院病理科会诊,病理诊断:梭形细胞肿瘤组织,伴散在炎细胞浸润,符合炎症性肌纤维母细胞瘤(inflammatory myofibroblastic tumor, IMT)。免疫组化:CD20(散在+),CK(-),CD1a(-),CD34(-),CD68(+),S-100(-),CD3(散在+),Ki-67(5%),EMA(-),actin(-)。8月29日对左侧髂骨肿物行CT引导下经皮微波消融术。术后症状缓解不明显,于11月28日再次行左侧髂骨旁软组织肿物穿刺活检,病理诊断:考虑为IMT。免疫组化:CK(-),CD34(血管+),CD138(散在+),β-catenin(-),CD68(散在+),间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)(-),Vimentin(+),Myogenin(-),Desmin(-),SMA(-),S-100(-),Ki-67(5%)。患者左髋部和下肢疼痛进行性加重,行动困难,左腰背和左髂部出现多发皮下结节。2019年3月25日于吉林省肿瘤医院行左腰背和左髂部皮下结节切除活检,病理诊断:考虑为肉瘤,倾向纤维源性。因左髂骨肿物第1次活检标本进行过脱钙处理,第2次活检标本在免疫组化检测后剩余不足,因此仅对患者转移组织标本(左腰背皮下结节)和血浆进行二代测序(next generation sequencing, NGS), 对患者转移组织标本行程序性细胞死亡配体1(programmed cell death-ligand 1, PD-L1)免疫组化检测。NGS由南京世和基因生物技术股份有限公司完成,检测平台为Illumina Hiseq/MiSeqDx,参考基因组为GRCh37/hg19。转移组织标本中检测到成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR1)、异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)、磷脂酰肌醇-3-激酶催化亚单位a基因(phosphatidylinositol-3-kinase catalytic alpha polypeptide gene, PIK3CA)和端粒酶逆转录酶基因(telomerase reverse transcriptase, TERT)突变,血浆标本中未检测到FGFR1突变,但IDH1、PIK3CA和TERT突变均检测到,并检测到ALK和RAS同源基因家族成员A(ras homolog gene family, member A, RHOA)突变,胚系突变和高度微卫星不稳定(microsatellite instability-high,MSI-H)未检测到。转移组织的肿瘤突变负荷(tumor mutation burden, TMB)为3.4个突变/Mb,血浆为4.6个突变/Mb,属低TMB。PD-L1免疫组化检测显示,转移组织肿瘤比例分数(tumor proportion score, TPS)为80%(图1)。4月4日查PET-CT示,右眼眶内直肌下方和内直肌可见软组织影,CT值31 HU,糖代谢增高(SUVmax=4.8),大小为2.1 cm;右第二肋间可见软组织影,CT值32 HU,糖代谢增高(SUVmax=4.7);胃周可见散在多发肿大淋巴结,较大短径约1.1 cm,糖代谢增高(SUVmax=5.2);腹腔可见散在多发肿大淋巴结影,部分融合成团,较大轴位约4.9 cm×3.8 cm, 糖代谢增高(SUVmax=6.4);腹膜后区(十二指肠降部、脾周等)见多发肿大淋巴结,较大短径约0.7 cm,糖代谢增高(SUVmax=4.6);左侧盆壁可见软组织影,周围肌(臀大肌、臀中肌、臀小肌、骨直肌、缝匠肌、闭孔内肌)内组织肿胀,边缘模糊,较大轴位约8.0 cm×12.9 cm,糖代谢增高(SUVmax=10.0);两侧髂骨、骶骨、左髋臼可见骨质破坏;右膝关节可见多发软组织影,糖代谢增高(SUVmax=10.0);左背阔肌、右臀大肌、右小腿肌内见软组织影,糖代谢增高(SUVmax=6.4);皮下组织散在多个软组织影,糖代谢增高(SUVmax=1.7,图2A),疾病明显进展。4月5日于我院开始给予帕博利珠单抗+安罗替尼联合治疗。具体方法:帕博利珠单抗200 mg,第1天;安罗替尼12 mg,第1~14天;21 d为1个周期。每月给予唑来膦酸4 mg。治疗2个周期后,患者左髋部和下肢疼痛明显减轻,可以行走,皮下结节消失。5月15日查PET-CT示,胃周、腹腔内、腹膜后淋巴结较前明显缩小,多消失,糖代谢较前减低(SUVmax=2.2);左侧盆壁软组织影较前明显缩小,糖代谢较前减低(SUVmax=2.8);两侧髂骨、骶骨、左髋臼可见骨质破坏同前,糖代谢较前减低(SUVmax=2.0);左背阔肌、右臀大肌内软组织影较前明显缩小,界限模糊,糖代谢无异常;右眼眶内和皮下组织未再见到糖代谢增高病灶(图2B)。疗效评定为部分缓解。截至目前,患者已完成10个周期抗PD1单抗联合安罗替尼治疗,耐受性良好,未出现明显不良反应,生活质量明显改善。


IMT是一种罕见的间叶细胞来源肿瘤,儿童和年轻成人多见,好发于肺和腹腔深部软组织,起源于骨者很少见[1]。尽管IMT呈惰性生物学行为,但一部分肿瘤表现为局部侵袭性,5%的患者发生远处转移[2]。手术切除是IMT的根治性治疗手段,但对局部侵袭性不可切除和转移病灶,治疗选择十分有限,联合化疗偶有成功的案例[1]。研究表明,50%~75%的IMT患者有ALK基因重排,少部分患者有其他基因的融合,如c-ros原癌基因1受体酪氨酸激酶(c-ros oncogene 1 receptor kinase, ROS1)、神经营养性酪氨酸受体激酶3(neurotrophic tyrosine receptor kinase 3, NTRK3)、RET(rearranged during transfection)原癌基因和血小板衍化生长因子受体B(platelet derived growth factor receptor B, PDGFRB)[3,4]。具有上述驱动基因改变的患者对相应的靶向治疗反应良好,但并非所有的患者都具有明确的驱动基因改变,即便是靶向治疗也会出现获得性耐药。本例患者为老年男性,原发灶位于左侧髂骨,病程中很快表现出高度侵袭性和广泛转移,肿瘤组织免疫组化检测ALK阴性,转移组织标本和血浆NGS检测未发现ALK基因重排及ROS1、NTRK3、RET和PDGFRB融合等已报道的驱动基因突变,没有针对这些靶点进行靶向治疗的机会。这种罕见、高侵袭性和驱动基因阴性IMT的治疗是临床医师面临的巨大挑战,尤其是面对老年、体弱患者,需要新的治疗策略。首先是在靶向治疗上有没有新的靶点可用。患者肿瘤组织标本和血浆中均检测到IDH1(R132G)突变,在临床前模型和早期临床试验中针对IDH1突变的小分子抑制剂表现出一定的抗肿瘤活性和安全性。ivosidenib(AG-120)在复发或进展性胶质瘤中6个月的临床获益率为35%;在肝内胆管细胞癌患者中,6%获得部分缓解,56%病情稳定,6个月的无进展生存率为40%[5]。另一种小分子抑制剂AG-881,使1.9%的复发进展胶质瘤患者获得轻微反应,75%的患者病情稳定;在非胶质瘤的实体肿瘤中,2.4%的患者获得部分缓解,36.6%的患者病情稳定[5]。此外,本例患者肿瘤组织标本中尚检测到FGFR1突变。erdafitinib(JNJ-42756493)是一种口服小分子选择性泛FGFR抑制剂,在多种具有FGFR突变或融合的晚期难治性实体肿瘤中表现出一定的抗肿瘤活性,尤其是在尿路上皮癌和肝内胆管细胞癌,前者客观缓解率(objective response rate, ORR)达到46.2%(12/26),中位反应持续时间为5.6个月,后者ORR为27.3%(3/11),中位反应持续时间为11.4个月,而其他类型肿瘤的ORR均低于10%[6]。针对这两种基因突变的靶向治疗对于转移性IMT可能不失为一种可行的治疗策略,但药物可及性限制了在该患者的应用。
IMT病理学上表现为炎症细胞浸润背景下的梭形细胞肿瘤,提示了肿瘤的免疫原性。Cottrell等[7]报道,69%的IMT肿瘤细胞PD-L1(+),80%的复发转移肿瘤和88%的ALK(-)肿瘤PD-L1(+),表明IMT肿瘤细胞适应性表达PD-L1,与肿瘤浸润性CD8+ T淋巴细胞浸润增加有关。免疫治疗,尤其是基于PD1/PD-L1的免疫检查点阻断,可能对IMT有效。因本例患者原发病灶活检标本不足,我们对转移病灶进行了PD-L1免疫组化检测,证实PD-L1阳性和高表达,TPS为80%。安罗替尼是一种具有抗血管生成作用的新型小分子多靶点血管内皮生长因子受体酪氨酸酶抑制剂。一项多中心Ⅱ期临床研究证实,安罗替尼在难治转移性软组织肉瘤中具有一定的抗肿瘤活性,且毒性可控、可接受[8]。临床前研究和临床研究显示,抗血管生成药物可通过肿瘤血管"正常化"来改善肿瘤免疫抑制微环境,增强免疫治疗的疗效,两者之间存在协同抗肿瘤效应[9]。针对本例患者,我们采用免疫联合抗血管生成治疗策略,予以帕博利珠单抗联合安罗替尼治疗,取得了良好的近期效果。一方面得益于肿瘤细胞PD-L1高表达;另一面也可能来自免疫和抗血管生成联合的协同效应。在不良反应方面,本例患者对联合治疗耐受性非常好,截至目前已完成10个周期治疗,并未出现明显不良事件。因此,对于ALK等驱动基因阴性的转移性IMT患者,基于免疫检查点阻滞的免疫联合抗血管生成治疗是一种新的有效方法,建议治疗前进行PD-L1表达检测。由于本病比较罕见,开展免疫单药和免疫联合治疗的对照研究存在困难,具体方案应基于患者的耐受性和肿瘤的生物学行为进行个体化选择。
所有作者均声明不存在利益冲突


























