
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,51岁,2018年9月10日因发现右侧颏下、耳下包块生长4月余入院。入院查体示,右侧腮腺弥漫性肿大,右侧颏下扪及一约1 cm×1.5 cm肿物,质硬,按压无疼痛,界限欠清,皮肤表面色泽正常,皮温不高。颌面部CT示,右侧腮腺肿大,增强呈中度强化,腮腺强化不均,其内见散在强化结节;双侧颌下淋巴结肿大,考虑炎性病变。2018年9月13日于全身麻醉下行右侧腮腺浅叶切除+面神经解剖+颏下包块切除术,术后病理示,颏下肿物查见腺癌,脉管内查见癌栓,可见神经侵犯,请临床检查乳腺是否有肿块,若排除乳腺癌转移后,考虑涎腺原发导管腺癌。免疫组化检测结果示,CK7(+),GCDFP-15(+),CK5/6(灶+),CEA(个别细胞+),CD34(血管+),P63(-),CerbB-2(-),CK20(-),TTF-1(-)(图1)。乳腺及淋巴结超声检查未见明显乳腺肿物及腋窝淋巴结肿大。患者于2018年9月28日于四川省肿瘤医院行右腮腺癌扩大根治+面神经松解减压+右颌下腺切除+右颈部淋巴结清扫+颈总动脉剥离术,术后骨扫描示,全身骨骼广泛骨转移征象。依据病理及影像学检查明确诊断为右侧腮腺导管腺癌(pT4aN2M1 Ⅳc期)伴全身多发骨转移。患者行多西他赛+顺铂方案化疗4个周期,使用唑来膦酸抑制骨不良事件。规律随访复查,病情稳定。
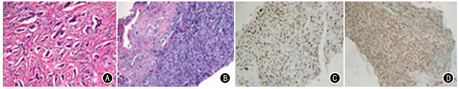

患者2019年11月5日因面部、颈部及左上肢进行性水肿半月就诊于我院,查体示双侧颜面部肿胀,以右侧腮腺区明显,无压痛,耳前至颏下可见长约10 cm L形手术切口,颈部肌肉僵硬,皮肤发红,活动受限,右侧颈部见长约15 cm陈旧性手术切口,左上肢肿胀。颌面部及颈部增强MRI示,右侧腮腺术后改变,术区软组织增厚并弱强化,右侧面部软组织增厚;双侧颈部、颌下区多发淋巴结显示,较大者短径约0.5 cm。血管超声未见上肢血栓。双侧颈部皮肤及左侧淋巴结穿刺活检术后病理示(1)左侧颈部淋巴结腺癌,符合腮腺来源;(2)右侧颈部水肿区腺癌符合腮腺来源。免疫组化检测表皮生长因子受体(epidermal growth factor receptor, EGFR)和雄激素受体(androgen receptor, AR)结果见图1,EGFR(+),AR(+)。根据病理结果诊断为右侧腮腺导管腺癌术后化疗后(pT4aN2M1 Ⅳc期)复发伴全身多发骨转移,颈部淋巴结,颈部皮肤转移。
我院推荐患者行PF方案(顺铂+氟尿嘧啶)+西妥昔单抗化疗或行抗雄激素内分泌治疗(亮丙瑞林+比卡鲁胺),患者及家属经商议选择内分泌治疗。患者于2019年11月20日行抗雄激素内分泌治疗,具体方案为亮丙瑞林3.75 mg(每28 d 1次)+比卡鲁胺片50 mg(2次/d)口服。患者用药后2周,颜面部、颈部皮肤、左上肢水肿减轻,局部皮肤结节退缩,继续维持治疗。2020年1月17日,患者颜面部、颈部皮肤、左上肢水肿基本消退,局部皮肤结节明显退缩。颌面部及颈部增强MRI评估疗效示,右侧腮腺术后改变,腮腺缺如,术区未见异常信号改变,术区未见异常强化,与前片比较原术区软组织水肿及软组织增厚基本消失。随访截至2020年2月15日,患者颜面部、颈部、上肢水肿已基本消退,治疗有效,仍继续行内分泌治疗。
涎腺癌(salivary gland carcinoma, SGC)是一种少见的恶性肿瘤,包含多种类型的组织学亚型。涎腺导管癌(salivary ductal carcinoma, SDC)是SGC中的一种高侵袭性亚型,占SGC的4%~10%,通常发生于腮腺,易复发及远处转移,总生存率低[1]。由于SDC临床不常见,相关病例报道较少,故该病复发及转移后的治疗尚无系统完善的报道。现通过一例晚期腮腺导管癌患者的病历资料,并结合国内外相关文献,我们就晚期SDC的综合治疗进行总结。
SDC是一种临床不多见的涎腺肿瘤,最早报道于1968年[2],于1990年被定义为SGC的一种亚型[3],在组织学上类似于乳腺原位浸润性导管癌。SDC好发于中年男性,肿瘤常发生于腮腺,大多数患者于3年内死亡,易发生淋巴结转移及远处转移,远处转移常发生于肺、骨、脑[4]。SDC标准治疗方式为手术切除联合或不联合辅助放疗,通常需要后续综合治疗,但如何有效降低复发仍需进一步探索。
有研究显示,铂类和紫杉类药物联合治疗头颈部鳞状细胞癌已得到广泛应用[5],但此类药物对于SGC的疗效和安全性尚不清楚。有回顾性研究表明,卡铂联合紫杉醇化疗对SGC有一定的疗效,患者病理类型不同,客观缓解率亦不同,但患者预后差异无统计学意义[6]。虽然多西他赛与紫杉醇同属于紫杉类药物,但多西他赛对周围神经不良反应低于紫杉醇,且多西他赛与紫杉醇无交叉耐药作用,因此,多西他赛可以在疾病复发后使用,是继紫杉醇耐药之后的二线选择。卡铂联合多西他赛治疗晚期和(或)复发转移性SGC,客观缓解率为42%,化疗不良反应可控[7]。因此,卡铂联合多西他赛可能是晚期和(或)复发和(或)转移性SGC患者,特别是AR阴性和人表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2)阴性SDC患者的化疗选择。
SDC常表达AR,96%的SDC病例中AR为阳性,男性患者AR阳性率较高[8]。在前列腺癌和乳腺癌中,AR的表达与预后有关[9]。然而,AR的表达与SDC的预后相关性尚不明确。有研究显示,与AR阳性和雌激素受体(estrogen receptor, ER)β阳性或AR阴性和ERβ阴性的SDC患者比较,AR阳性和ERβ阳性的SDC患者生存率较低[10],但未提供AR单独检测的结果。近年来,AR已经成为SDC患者治疗的关键靶点。国外学者对SDC细胞系研究发现,雄激素可促进SDC细胞生长,抑制AR的表达可抑制SDC细胞的增殖[11]。有研究显示,使用AR阻断剂(如比卡鲁胺或恩扎鲁胺)治疗复发和(或)转移性SDC,患者出现临床缓解[12]。AR阻断剂常与促性腺激素释放激素受体激动剂(曲普瑞林或亮丙瑞林)联合使用,后者可抑制雄激素的产生。一项前瞻性Ⅱ期试验中,研究者评估36例SGC患者(其中SDC患者34例)使用比卡鲁胺联合亮丙瑞林的疗效,结果显示,部分缓解(partial responses, PR)率或完全缓解(complete responses, CR)率为41.7%,疾病稳定(stable diseases, SD)率为44.4%,治疗过程中3级或4级不良反应发生率较低[13]。此外,雄激素去势疗法(androgen deprivation therapy, ADT)为AR阳性SDC患者一个可选择的治疗措施。35例AR阳性SDC患者一线接受ADT治疗,其中34例可评价疗效,PR 6例,SD 11例;ADT治疗患者的中位无进展生存时间为4个月,中位总生存时间(overall survival, OS)为17个月;43例接受最佳支持治疗患者的中位OS为5个月[14]。
SDC患者中,HER-2的表达率为15%~100%[15]。采用2007年美国临床肿瘤学会和美国病理学家协会指南推荐的乳腺癌HER-2检测标准进行评价,SDC患者HER-2的表达率为15%~44%[1,16]。这可能因为定义HER-2阳性的标准不同造成的。乳腺癌中,HER-2阳性为不良预后因素[9]。有研究显示,在SDC中,HER-2的表达与生存率有关[17,18]。另有研究结果显示,暂未证实HER-2与SDC患者临床预后之间的相关性[16]。一项日本的Ⅱ期临床研究数据显示,曲妥珠单抗联合多西紫杉醇治疗HER-2阳性SDC患者的疗效可,且不良反应可控[19]。因此,在HER-2阳性SDC患者中,曲妥珠单抗联合化疗可作为一个治疗选择。
除AR和HER-2外,SDC也有其他基因突变,如EGFR(53%)、HRAS(16%~23%)、PIK3CA (18%~26%)、BRAF(4%)等[16]。针对这些基因的靶向治疗,临床上报道较少。国外学者报道,HRAS突变可能对MAPK/MEK抑制剂司美替尼敏感[20]。EGFR突变对西妥昔单抗、吉非替尼等敏感,已在SGC的其他亚型中有报道[21]。达拉非尼(BRAF抑制剂)联合曲美替尼(MEK抑制剂)可能对BRAF p.V600E突变患者有效[22]。这些基因突变作为靶点虽然只在少数病例中有报道,但其可提供一个治疗的方向。
近年来,免疫治疗极大地改变了难治性实体瘤的治疗模式。然而,为使免疫抑制剂对特定肿瘤有效,就必须存在潜在的免疫反应,这就要求肿瘤有被免疫系统识别为外来的突变,而基因组改变数量较多的肿瘤往往对免疫治疗反应更好[23]。国外学者对16个SDC样本的全外显子组测序研究显示,每兆碱基平均有1.7个突变负荷,虽然这种突变负荷相比其他涎腺肿瘤如腺样囊性癌高,但远低于其他对免疫治疗应答良好的肿瘤类型,如结直肠癌、肺癌或黑色素瘤[24]。有研究表明,在31例SDC标本中近50%的标本程序性死亡受体配体1(programmed cell death-Ligand 1, PD-L1)的表达>1%,提示抗程序性死亡受体1(programmed cell death 1, PD-1)或抗PD-L1或其他免疫抑制剂在该肿瘤中可能具有一定的抗肿瘤活性[25]。小样本队列研究显示,26例晚期SGC患者使用帕博利珠单抗(抗PD-1抗体)治疗,结果为11.5%的缓解率和46.2%的稳定率,其中缓解患者中有2/3为SDC患者[26]。
SDC为一种少见的高侵袭性恶性肿瘤,发现时常处于晚期。尽管我们对SDC生物学和发病机制的认识不断深入,但手术和辅助放疗后,SDC患者仍有很高的复发率和远处转移率。化疗、内分泌治疗、曲妥珠单抗和其他靶向治疗的系统治疗有待进一步研究论证,并且需要生物标志物来预测患者治疗的有效性。尽管根据平均突变负荷,SDC可能仅有中等程度的免疫原性,但免疫抑制剂联合其他治疗方式可能是治疗该病的一个有前景的研究方向。
所有作者均声明不存在利益冲突


























