
纯红系白血病是一种少见类型的急性白血病,老年发病多见,临床进展较快,中位生存期短,预后差。本研究中,我们分析1例骨髓增生异常综合征(MDS)转化纯红系白血病临床表现、治疗经过及临床诊断,并结合2016年世界卫生组织对造血和淋巴组织肿瘤分类关于红白血病的修订进行文献复习。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,60岁。于2016年6月无诱因感乏力明显,2016年7月当地医院体检提示贫血,后在我院门诊定期复查,予叶酸片、维生素B12片口服治疗,2016年10月3日再次来院复查血常规:白细胞计数3.7×109/L,血红蛋白70 g/L,平均红细胞体积87.2fL,血小板计数221×109/L。为进一步治疗,门诊以贫血收住入院。入院查体:神清,精神可,贫血貌,四肢皮肤无瘀斑及瘀点,全身浅表淋巴结未触及肿大,肝脾肋下未及,双下肢无浮肿。实验室检查:叶酸:12.7 nmol/L、维生素B12:287 pmol/L、血清铁蛋白:451.9 μg/L,乳酸脱氢酶:393 U/L,网织红细胞百分比:0.96%;抗人球蛋白试验、酸溶血试验阴性。继续口服叶酸、甲钴胺等治疗,效果不佳,后因头晕、乏力加重患者转至上级医院住院治疗,骨髓常规示:红系增生明显活跃,有核红细胞占51%,其中原红+早幼红占17%,部分有核细胞可见巨幼样变、核出芽、核分叶、核碎裂、双核、母子核、花形核及豪焦小体,发育异常细胞>10%;原始细胞2.5%,提示骨髓增生异常综合征骨髓象;免疫分型:CD117+GPA+CD71+细胞约占20.8%,该细胞群细胞大小(FS)较大,胞内颗粒性(SS)略低于粒细胞;染色体核型分析:41-44,XX,-5,9q+-15,-16,-17,-19,+M3-M6[cp9]/46,XX;未发现N-RAS、DNMT3A-PHD、DNMT3-催化结构域N端基因突变。2016年12月26日起予地西他滨针25 mg,1次/d方案治疗,2017年1月26日我院门诊复查血常规:白细胞计数5.9×109/L,血红蛋白121 g/L,血小板计数738×109/L,2017年2月10日复查骨髓常规报告无明显异常。2017年2月13日起再次予地西他滨针25 mg,1次/d方案治疗,2017年3月21日为巩固化疗再次来我院,门诊以确诊骨髓增生异常综合征4个月、巩固化疗收住入院。查体:贫血貌,肝脾肋下未及。实验室检查:血常规白细胞计数3.5×109/L,血红蛋白100 g/L,血小板计数243×109/L,丙氨酸氨基转移酶89 U/L,门冬氨酸转移酶56.2 U/L,γ-谷氨酰转肽酶71.1 U/L,乳酸脱氢酶1 158.6 U/L,总胆红素30.3 μmol/L,直接胆红素10.1 μmol/L,间接胆红素20.2 μmol/L。辅助检查:超声:肝囊肿,脾增大。2017年3月26日骨髓常规提示:有核细胞明显增生,其中红系占90%,以异常原红细胞增生为主(占有核细胞65.4%),此类细胞胞体体积较大,染色质偏疏松,核仁可见,胞浆有强嗜碱性,含有大量空泡,无颗粒(图1)。糖原染色胞浆内球状阳性(图2),髓过氧化物酶阴性,形态学考虑纯红系细胞白血病;免疫分型:有核红细胞群表达CD117(53.16%)、CD36(94.91%)、CD235a(81.89%)、CD71(96.15%),骨髓中红系前体细胞优势增生伴CD235a表达异常及CD117表达,提示纯红系细胞白血病。患者确诊MDS转化纯红系白血病,随访至2017年6月死亡。
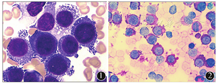

纯红系白血病是一种少见类型的急性白血病,占所有急性髓系白血病的不到1%[1]。纯红系白血病是急性髓系白血病非特殊类型或不另作特定分类型(NOS)中的少见类型,是早期前体红细胞的增殖失控,原始红细胞分化受阻,导致红系前体细胞生存时间延长、无限增殖的一种疾病[2]。1917年由Di-Guglielmo首先报道一组骨髓红系细胞高增生特点和治疗贫血无反应的血液紊乱[1],这种罕见白血病的诊断有较多争论,关于红白血病的分型标准一直在演变:2001年纯红系白血病(M6b)作为单独分型第1次出现在世界卫生组织(WHO)分型中,另一个M6亚型为急性红白血病(M6a)[3],2008年WHO分型修正方案中提出原始细胞百分比计数不再采用非红系(NEC)分类,而直接采用骨髓所有有核细胞计数(ANC)分类[4]。据此,急性红系白血病分成2个亚型:即急性红白血病(红系/髓系)和纯红系细胞白血病(PEL)。纯红系细胞白血病诊断需满足红系≥80%(ANC),原始红细胞或早期红系分化停滞;急性红白血病(红系/髓系)诊断需满足红系在所有有核细胞分类(ANC)≥50%并原始细胞(髓系)在所有有核细胞分类(ANC)<20%但在非红系分类中(NEC)≥20%,并且提出了骨髓有核红细胞≥50%(ANC)并原始细胞(髓系)≥20%(ANC)应诊断为急性髓系白血病伴骨髓增生异常相关改变(AML-MRC);而红系≥50%(ANC),原始细胞(髓系)<20%(ANC)且<20%(NEC)则诊断为MDS,这种分类标准将部分急性红白血病病例重新划分至急性髓系白血病伴骨髓增生相关改变(AML-MRC),这种划分有可能人为将生物学上相似的一类髓系肿瘤分成不同类型。2016年WHO对造血和淋巴组织肿瘤疾病分类再次修正,对红白血病诊断有了相当严格的标准,取消了急性红白血病中其他亚型,只留下纯红系细胞白血病(PEL)[5],PEL的诊断要求红系前体细胞≥80%且原始红细胞>30%。
纯红系白血病临床进展较快,中位生存期短,预后差。通常表现为三系减少或进行性贫血与血小板减少,外周血中易出现有核红细胞[6]。PEL可以是初发或有MDS病史[2],此例患者有明确的MDS病史。患者在MDS阶段,骨髓主要表现为各阶段幼红细胞的增多,幼红细胞有巨幼样变、核出芽、核分叶、核碎裂、双核、母子核、花形核及豪焦小体等病态,转化为PEL以后,骨髓主要表现为异常原红细胞的优势增生,幼红细胞向下阶段分化受阻。由MDS转变的PEL诊断上需要与AML-MRC相鉴别,虽然两者都可以有红系明显增生的特点,但主要的区分点在于PEL的红细胞停滞在红细胞前体细胞或原始红细胞,其他原始髓系细胞几乎不见,有核红细胞的病态造血特征更为突出,而AML-MRC中的红系保留了连续成熟的能力,除要求原始粒细胞或原始及幼稚单核细胞的比例以外,更强调至少两系以上病态造血≥50%。在一组对15例PEL患者的调查中发现纯红系白血病是一种中老年人疾病(中位年龄68岁),男性显著多于女性,总体中位生存期为1.4个月,PEL患者生存期显著差于其他伴有红系前体细胞≥50%的急性髓系白血病患者[7]。纯红系白血病细胞形态学上需要与非肿瘤性疾病如巨幼细胞性贫血和肿瘤性疾病如其他类型的红系增多急性白血病和骨髓增生异常综合征甚至部分高级别淋巴瘤、浆母细胞型骨髓瘤等疾病相鉴别,原始红细胞形态表现为细胞体积偏大,核圆,染色质细腻,有核仁可见,胞质有强嗜碱性并充满大量空泡,糖原染色为球状或块状阳性。PEL普遍与异常核型相关,有学者复习25例PEL病例,其中21例(84%)具有复杂核型,复杂核型通常涉及5号和7号染色体异常[8,9],另有学者发现染色体核型异常和(或)开始表现为骨髓增生异常综合征后转化为PEL患者预后比初发者更差,完全缓解率低,且完全缓解后高达75%患者死于复发[10,11];在基因方面,相比其他急性髓系白血病,红白血病的突变与MDS更为相似,TP53突变非常普遍,FLT3-ITD、NPM1和CEBPA突变较少,Wang等[12]发现在PEL中TP53基因突变与缺失共同存在,认为TP53基因高频突变表明其有可能在PEL发病中起重要作用;在免疫表型方面,PEL原始细胞呈CD34、HLA-DR阴性,CD117常部分阳性或弱阳性,有些异常表达CD33,通常CD36、CD235a高表达,但CD36不具有特异性,另外2种铁相关蛋白具有较高敏感性和特异性指标:转铁蛋白受体CD71和铁蛋白H,CD71可表达在所有有核红细胞上,而铁蛋白H为早期红系前体细胞和原始红细胞的特异性标记,在更成熟的中晚幼红阶段细胞往往呈弱阳性或阴性,因此在PEL的诊断中,铁蛋白H更具优势。纯红系白血病的形态和免疫表型特征决定了其核型非常复杂,预后很差,需要积极的临床治疗,但目前对于纯红系白血病尚无标准化治疗方案,通常采用高强度诱导化疗和去甲基化治疗,常见的化疗方案有DA方案、HA方案等,此例患者在MDS阶段开始使用地西他滨去甲基化治疗1次后疾病缓解,第2次化疗后转化为PEL,发病1年后死亡。
急性红白血病的分类一直广受争议,并存在诊断重复性差,难以执行统一标准导致分类不清等问题,近年来随着对纯红系白血病的深入研究,发现其生物学特性及临床经过与其他红系增多的急性白血病有明显不同,但更接近于MDS,从发病年龄看在老年人中发病率更高,对于有染色体复杂核型的MDS病史老年患者,骨髓检查中若异常原红比例持续增高需警惕PEL的发生。2016年WHO对于急性红白血病的修正更新,更清晰地体现了各类红系增多疾病的特征和预后,有助于纯红系白血病与其他红系增多髓系肿瘤鉴别诊断,对于PEL临床研究、疾病诊断以及预后分析都有重要的意义。
所有作者均声明不存在利益冲突



























