
探究CD38/p53/ME1轴在人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染中对T细胞线粒体功能及衰老的影响。
流式细胞仪检测HIV感染者及对照T细胞CD38表达情况、CD38+和CD38- T细胞衰老及线粒体功能的差异。qRT-PCR检测CD38抑制剂78c处理后T细胞苹果酸酶1(malic enzyme 1,ME1)的表达水平。流式细胞仪检测ME1抑制剂处理后T细胞的线粒体功能及衰老水平。研究CD38介导的T细胞中ME1下调的潜在机制。
HIV感染后T细胞表面CD38表达显著增加,且抗逆转录病毒治疗无法完全纠正,导致了T细胞的衰老与线粒体功能障碍。抑制CD38可导致T细胞中ME1酶的mRNA水平增加(P<0.05)。CD38介导的ME1表达下调可导致T细胞线粒体功能障碍和免疫衰老。
HIV感染中,CD38/p53/ME1轴通过抑制T细胞线粒体功能进而促进免疫衰老。本研究为HIV感染中CD38介导的T细胞功能障碍、线粒体损伤和免疫衰老提供了新的临床诊疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在过去四十余年中,获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)一直是全球面临的重大公共卫生挑战[1]。AIDS是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染引起,并通过血液等途径传播的一种传染性疾病[2]。尽管抗逆转录病毒治疗(antiretroviral therapy,ART)可有效抑制HIV复制,但不能彻底纠正HIV感染者的免疫衰老[3],仍存在免疫重建不良者[4]。T细胞衰老是免疫衰老的主要特征之一[5],目前,HIV感染中T细胞衰老的机制尚未阐明,且缺乏有效的干预手段。
CD38是一种Ⅱ型跨膜糖蛋白,在肿瘤细胞和人体免疫细胞中广泛表达[6]。在T细胞中,CD38作为经典的活化标志物[7,8],常被用于疾病的预测和预后评估。此外,CD38还具有烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)酶活性和环化酶活性[6],可促进细胞外和细胞内的NAD的降解[6,9,10,11,12],在细胞衰老过程中发挥重要作用[9,13]。NAD的浓度会影响去乙酰化酶SIRT1的酶活性,导致乙酰化等表观修饰变化,影响胞内基因表达[6]。然而,作为NAD水解酶,CD38过表达在HIV感染中对T细胞功能的生物学效应尚未完全阐明。
以往研究显示,在内皮细胞衰老过程中,CD38的激活以及SIRT1去乙酰化酶活性的下降可能会抑制苹果酸酶1(malic enzyme 1,ME1)的表达[14]。ME1酶是一种胞质蛋白,以烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADP+)依赖的方式将胞内苹果酸催化成为丙酮酸[15,16],参与脂质和胆固醇的合成[17]。除了是细胞质NADPH的主要来源外,ME1酶也是参与糖酵解途径和三羧酸循环的苹果酸酶之一,对能量代谢和维持细胞内氧化还原平衡状态至关重要[18,19]。有研究表明,ME1的耗竭可显著影响基质细胞的线粒体膜功能[19],在肿瘤细胞系中敲除ME1可产生大量活性氧(reactive oxygen species,ROS)物质[20]。在肿瘤细胞系和小鼠模型中敲除ME1会促进细胞衰老[15,21]。在人骨肉瘤细胞中和人胚肺成纤维细胞中,ME1的酶活性和mRNA水平均受p53的调控[15]。然而在HIV感染中,CD38是否通过调控ME1影响T细胞线粒体功能及免疫衰老尚不清楚,因此,本研究探究在HIV感染中,高表达的CD38导致T细胞免疫衰老的可能作用机制。
本研究纳入HIV感染者29例及健康对照者10例,用于研究体内T细胞CD38表达。HIV感染者中接受ART治疗组(ART组)20例,未接受ART治疗组(HIV组)9例。ART组纳入标准为:ART治疗持续时间>2年,CD4+T淋巴细胞计数>350个/μl且病毒载量<20拷贝/ml。研究对象外周血样本采集自中国医科大学附属第一医院,且获得中国医科大学伦理委员会批准(科伦审[2020]2019-150-4号)。
T细胞分离试剂盒购自加拿大STEMCELL公司;Ficoll淋巴细胞分离液购自美国Cytiva公司;RPMI 1640培养基购自美国HyClone公司;ME1、GAPDH引物购自华大基因;T细胞激活剂CD3/CD28、鸡抗兔IgG(H+L)交叉吸附二抗、LIVE/DEAD流式染液、MitoTracker Green、MitoTracker Orange、MitoSOX™ Red线粒体试剂购自美国Thermo Fisher公司;细胞固定/透化试剂盒、流式荧光抗体及标记物购自美国BD公司;ME1抑制剂、CD38抑制剂78c购自美国MCE公司;p53抑制剂pifithrin-α购自美国SCBT公司,SIRT1抑制剂EX-527购自美国Cayman公司;CD38 shRNA及对照慢病毒购自中国吉凯公司。本实验中使用到流式细胞仪BD FACS LSRⅡ(美国BD公司)、二级生物安全柜(美国Nuair公司)、EasyEights™多通道磁极(加拿大STEMCELL公司)、RT-PCR仪LightCycler480实时荧光PCR仪(德国Roche公司)等设备仪器。
采用Ficoll淋巴细胞分离液对外周血单个核细胞进行分离与提取,T细胞分离试剂盒负选出高纯度的CD3+T细胞。
为探究ME1在CD38介导HIV感染T细胞衰老中的作用,将ME1抑制剂[22](6.25 μmol/L)预处理24 h后的T细胞与T细胞激活剂CD3/CD28或抗CD3(1 μg/ml,加拿大STEMCELL)共培养48 h以激活T细胞。对照组加入与实验组等量的溶媒二甲基亚砜(DMSO)。为探究CD38介导T细胞中ME1表达下调的潜在机制,将T细胞分别与CD38抑制剂78c[23](0.5 μmol/L)和T细胞激活剂共培养36 h、与p53抑制剂pifithrin-α[24](10 μmol/L)和T细胞激活剂共培养24 h、与SIRT1抑制剂EX-527[25](1 μmol/L)和T细胞激活剂CD3/CD28共培养24 h。对照组均加入与实验组等量的DMSO。处理后的细胞均培养于含10%灭活FBS及100 U/ml青-链霉素的RPMI 1640培养基中,在37℃,5%CO2培养箱中进行培养。为明确CD38对NAD及SIRT活性的调控作用,本研究使用20感染复数(multiplicity of infection,MOI)的CD38 shRNA慢病毒和对照慢病毒分别感染Jurkat T细胞,将转染后的Jurkat T细胞置于含10% FBS的RPMI 1640培养基,37℃,5%CO2湿润环境中进行培养。qRT-PCR检测CD38的表达。涉及HIV阳性标本的实验操作均严格遵循生物安全等级2(BSL-2)标准进行。
表面染色时,使用以下抗体对细胞进行分析:CD3-PerCP、CD3-BV510、CD4-APC-Cy7、CD4-PE-Cy7、CD8-APC、CD8-FITC、CD8-PerCP-Cy5.5、CD38-BV421、CD28-PE、CD28-APC、CD57-BV510、CD57-BV421。为检测T细胞p53乙酰化水平,使用固定/透化试剂盒对细胞进行固定透化,将破核后的细胞使用重组Anti-p53(acK382)抗体(1 mg/ml)进行一抗染色,再用Alexa 488标记的鸡抗兔二抗(2 mg/ml)进行染色。为了检测线粒体功能,将细胞与线粒体染料MitoTracker Green(50 nmol/L)和/或MitoTracker Orange(25 nmol/L)在37℃条件下孵育30 min,再进行表面染色。为了评估线粒体ROS水平,将细胞在含有MitoSOX™ Red线粒体超氧化物指示剂(5 μmol/L)的PBS中孵育10 min再进行细胞染色。数据使用Flowjo software v 10.6.2进行分析。
RNeasy Plus Mini Kit或RNeasy Plus Micro Kit提取总RNA。RNA浓度测定:使用Nanodrop 2000软件对提取的RNA样本进行测量,检测反映蛋白质污染的A260/A280值是否在正常范围(1.8~2.0)内。Primp Script RT试剂盒进行RNA逆转录。内参基因为β-actin或GAPDH。mRNA相对定量采用2-ΔΔCt进行计算。
采用核蛋白提取试剂盒分离核蛋白,并应用通用型SIRT活性检测试剂盒测定SIRT酶活性,具体操作严格遵循试剂盒说明书。
采用Amplite™荧光法总NAD/NADH检测试剂盒进行测定。
使用GraphPad Prism v8.0软件进行统计分析。Wilcoxon配对检验用于两组之间配对秩和检验。P<0.05为差异具有统计学意义。
检测HIV感染患者和健康对照者T细胞上CD38的表达水平。结果发现,ART组和HIV组CD4+和CD8+T细胞上CD38的表达百分比及平均荧光强度(mean fluorescence intensity, MFI)均高于健康对照组(P<0.01、P<0.001或P<0.000 1,图1A和图1B)。CD38可降解NAD,NAD减少已被证明与多种年龄相关的代谢性疾病有关[26,27]。CD38+T细胞中,T细胞表面衰老标志物CD57[28]的表达增加,且衰老细胞群CD28-CD57+T细胞[29]的百分比显著高于CD38-T细胞(P<0.05或P<0.001,图1C和图1D)。为了验证CD38是否影响线粒体功能,从HIV感染者外周血中分离出CD38+和CD38-T细胞以检测线粒体去极化水平。结果发现,与CD38-T细胞相比,CD4+CD38+和CD8+CD38+T细胞线粒体去极化水平增加(P<0.001,图1E和图1F)。提示在HIV感染中高表达的CD38可通过诱导线粒体损伤,导致T细胞免疫衰老。
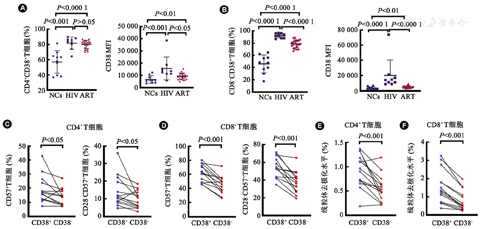

注:A:健康对照组(NCs)、未接受抗逆转录病毒治疗组(HIV)、抗逆转录病毒治疗组(ART)3组人群CD4+T细胞上CD38表达水平统计图(MFI:平均荧光强度);B:NCs、HIV、ART 3组人群CD8+T细胞上CD38表达水平统计图;C、D: ART组患者CD38+和CD38-T细胞的衰老水平;E、F:ART组患者外周血CD38+和CD38-T细胞的线粒体去极化水平
检测CD38诱导细胞衰老的机制,结果发现,CD38的小分子抑制剂78c可增加ME1表达(P<0.05,图2A)。ME1抑制剂处理后的CD4+和CD8+T细胞CD28-CD57+的百分比增加(P<0.01或P<0.001,图2B和图2C),CD57表达升高(P<0.01或P<0.001,图2D和图2E)。提示ME1抑制剂处理后,衰老T细胞百分比增加。
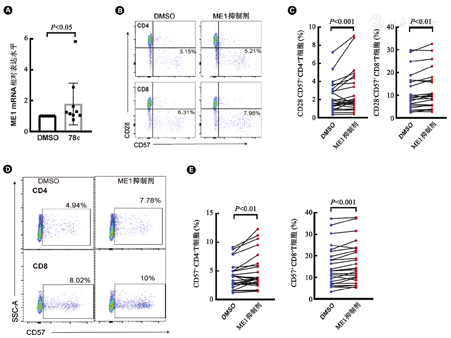

注:A:78c处理后,T细胞ME1的mRNA水平;B~E:抑制ME1后,CD4+和CD8+T细胞的衰老水平。DMSO:二甲基亚砜
与对照组相比,ME1抑制剂处理后,CD4+和CD8+T细胞的线粒体去极化水平均显著升高(P<0.01或P<0.001,图3A和图3B)。CD8+T细胞线粒体膜电位(mitochondrial membrane potential,MMP)的MFI显著降低(P<0.05),CD4+T细胞MMP的MFI亦呈下降趋势(P=0.074 9, 图3C和图3D)。CD4+和CD8+T细胞线粒体ROS的MFI均升高(P<0.05,图3E)。提示ME1抑制剂处理可导致T细胞线粒体功能障碍。
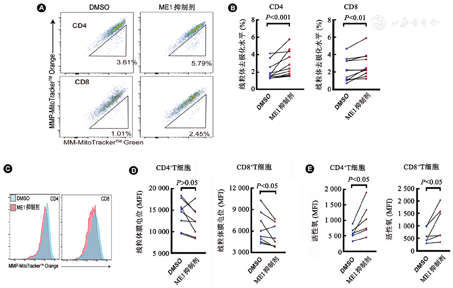

注:DMSO:二甲基亚砜;MMP:线粒体膜电位;MM:线粒体质量;MFI:平均荧光强度
敲减Jurkat T细胞中CD38(CD38i,图4A),相比于对照组(ShCtrl),CD38i Jurkat T细胞的NAD水平及SIRT活性均显著升高(图4B和图4C)。进一步发现抑制SIRT1可以提高p53的乙酰化水平(P<0.01,图4D)。为了验证在T细胞中ME1的表达是否受SIRT1及p53的调节,检测SIRT1抑制剂EX-527和p53抑制剂pifithrin-α分别处理后的T细胞的mRNA水平,结果发现pifithrin-α处理后ME1 mRNA水平显著增加,EX-527处理后ME1 mRNA水平显著降低(P<0.05,图4E和图4F)。上述结果提示,CD38可能通过调节NAD、SIRT1及p53,对ME1的表达进行调节。
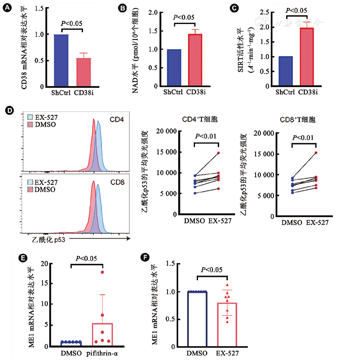

注:A:对照组(ShCtrl)与CD38敲减(CD38i) Jurkat T细胞中CD38 mRNA水平(n=3); B:ShCtrl与CD38i Jurkat T细胞中烟酰胺腺嘌呤二核苷酸(NAD)水平(n=3); C:ShCtrl与CD38i Jurkat T细胞中SIRT活性水平(n=3);D:SIRT1抑制剂EX-527处理后,CD4+和CD8+T细胞p53的乙酰化水平;E、F:p53抑制剂pifithrin-α和SIRT1抑制剂EX-527处理后,T细胞ME1 mRNA的统计图
HIV在感染人体后,会加速与衰老相关的身体生物学变化,甚至表现出自身免疫的倾向[30]。多项研究表明,CD38与HIV感染的发生和发展有关,且CD38可能通过不同机制调节其进程[31]。本研究证实CD38可通过SIRT1/p53/ME1轴影响线粒体稳态进而促进T细胞衰老。
高表达CD38的T细胞,呈现出与年龄增长相关的NAD+水平降低以及线粒体功能异常[31,32]。线粒体在调节细胞衰老等多个方面发挥作用[33]。线粒体去极化是线粒体功能损伤的指标[34],可出现线粒体质量增加,膜电位降低[35]。在自身免疫性疾病、癌症和衰老小鼠模型中,CD38可以诱导线粒体功能和结构损伤[36]。一项关于系统性红斑狼疮的研究显示,CD38可通过抑制线粒体自噬降低细胞毒性CD8+T细胞的线粒体适应度和抗病毒能力[35]。相较于健康对照者,HIV感染者CD8+T细胞上CD38表达增高,线粒体适应度降低[37]。然而,尚不清楚在HIV感染中,CD38与线粒体功能之间是否存在直接的因果关系。本研究表明,CD38能够持续影响线粒体功能并诱导T细胞免疫衰老,这表明CD38在HIV感染中的作用不仅仅是活化标志物。
进一步对CD38在HIV感染中调节线粒体功能的可能机制进行研究。Sabbatinelli等[14]研究发现,在内皮细胞衰老过程中,CD38的高表达以及SIRT1去乙酰化酶活性的下降可能会抑制ME1。78c是一种高效且特异的CD38抑制剂,可通过逆转组织NAD水平进而影响CD38的表达[12,23]。本研究证明,78c可提高T细胞中ME1的mRNA水平,验证了CD38对ME1可能的调控作用。ME1是三羧酸循环相关的酶,可以将苹果酸转化为丙酮酸,对维持细胞代谢平衡至关重要[15,19]。目前对ME1在线粒体功能和衰老领域的研究常见于肿瘤细胞系和小鼠实验中。以往研究显示敲除ME1可以使子宫内膜基质细胞的去极化线粒体积累[19]。去极化线粒体的积累是肿瘤浸润性T细胞功能缺陷的原因之一[35],可影响T细胞的分化和衰老[38]。然而,ME1对T细胞线粒体功能的影响鲜见报道。本研究发现,抑制ME1酶活性可升高T细胞的线粒体去极化水平,降低CD8+T细胞MMP,同时,CD4+T细胞MMP也呈下降趋势。MMP是评价线粒体功能的重要指标之一[39]。当MMP降低时,ATP合成受损,线粒体功能损伤,是衰老细胞中常见的线粒体表型[40]。提示在T细胞中抑制ME1酶活性可损伤线粒体功能。ROS是决定细胞命运和维持细胞内环境稳定所必需的氧化还原信使[41]。线粒体功能损伤会导致呼吸链复合体不稳定,进而升高ROS水平[42,43,44],并最终诱导细胞衰老[43]。在体外蜕膜化条件下,敲除ME1会增加基质细胞中线粒体ROS水平[19],在乳腺癌细胞中过表达ME1可显著降低ROS水平[20],但在T细胞中ME1是否会影响ROS的生成尚鲜见报道。本研究发现,ME1抑制剂处理后的CD4+和CD8+T细胞的线粒体ROS水平相较于对照组显著升高。ROS水平的升高是诱导和维持细胞衰老的关键[38,43]。近年来,多项研究显示ME1与细胞衰老关系密切。以往研究显示,在ME1基因敲除的人胚肺成纤维细胞(IMR90)中,细胞衰老相关的β半乳糖苷酶水平增加[15,19]。本研究发现,ME1酶抑制剂处理后的CD4+和CD8+T细胞CD57表达升高,CD28-CD57+亚群百分比明显增加。这表明在T细胞中,抑制ME1酶活性可促进细胞的免疫衰老。
CD38作为一种NAD水解酶,通过消耗NAD+的方式抑制SIRT1去乙酰化酶活性[44]。本研究发现,相较于对照组,CD38i Jurkat T的NAD水平及SIRT活性均显著增加,这与既往研究报道一致,证实了CD38可直接调控T细胞中NAD+/SIRT1信号轴。p53是迄今为止研究最为深入的肿瘤抑制因子之一,也是最早被发现的SIRT1非组蛋白底物[45]。乙酰化修饰是p53主要的翻译后修饰,在调节p53功能方面起着重要作用[46]。研究表明,下调的SIRT1能使p53在k382位点上发生乙酰化修饰[47]并激活p53,增强其功能[48]。Jiang等[15]的研究表明,在IMR90和肿瘤细胞系中敲除p53可显著增加ME1的mRNA水平、蛋白质水平以及酶活性。ME1在T细胞中的调控机制目前鲜见报道。鉴于SIRT1酶活性降低可增强p53功能,而p53又可抑制ME1的酶活性,我们推测CD38可能通过NAD/SIRT1/p53轴抑制T细胞中ME1的表达。本研究证实,在T细胞中p53的乙酰化水平受SIRT1调控,进一步发现抑制p53可增加ME1的表达,抑制SIRT1则降低ME1的表达。SIRT1、p53与ME1之间的联系补充并解释了CD38介导T细胞中ME1下调的一种可能机制。这些结果表明,CD38可能通过NAD/SIRT1/p53轴影响ME1的表达,从而影响T细胞衰老和线粒体损伤。进一步阐明CD38调控ME1表达的具体机制,有助于夯实现有证据链,为理解CD38在T细胞衰老和线粒体损伤中的作用提供更有力的支撑。
综上,本研究发现在HIV感染中,CD38在T细胞的线粒体损伤和免疫衰老中发挥重要作用,可能通过SIRT1/p53/ME1轴调节T细胞线粒体稳态,促进细胞衰老。
钟鑫,宋成博,刘丁宁,等. CD38/p53/ME1轴通过抑制线粒体功能促进HIV感染中的T细胞衰老[J].中华微生物学和免疫学杂志,2025, 45(4): 269-276. DOI: 10.3760/cma.j.cn112309-20250205-00029.
所有作者声明无利益冲突



























