
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Von Hippel-Lindau(VHL)病是一种罕见的常染色体显性遗传的家族性多系统肿瘤疾病,发病率约为1/36 000,平均发病年龄为26.3~30.9岁[4],临床表现复杂、诊断困难,如未治疗,自然死亡年龄在50岁以前,最常见的死亡原因是小脑血管母细胞瘤的合并症和肾细胞癌(renal cell carcinoma, RCC)转移[2]。本文报道1例临床、影像学资料完整的VHL病,并结合文献进行分析,以提高对本病的影像和临床诊疗水平。
患者,男,50岁。因无痛性全程肉眼血尿5个月,伴视物模糊(右眼明显)于2009年12月16日入院。查体未见异常。患者1997年行小脑血管母细胞瘤手术治疗,无家族遗传史。入院后查血肝肾功能以及癌胚抗原、甲胎蛋白、糖类抗原199、血清铁蛋白等肿瘤标志物均正常,血红细胞5.1×109/L,血红蛋白165 g/L。
彩色多普勒超声:双肾多发性肿瘤,右肾最大者4.6 cm×4.2 cm,左肾最大者3.6 cm×3.2 cm,双肾多发囊肿;肝内多发血管瘤,多发小囊肿;胰腺多发囊肿,最大径3.0 cm;左侧附睾头囊性包块0.8 cm×1.0 cm。
头颅MRI检查:小脑血管母细胞瘤术前MRI检查(1997年8月,图1)示右侧小脑半球见一椭圆形囊性病灶,大小约5.5 cm×4.0 cm,囊壁内见一直径约1.0 cm壁结节,增强扫描壁结节强化明显,大囊未见强化,囊壁清晰。术后MRI(2009年12月,图2)检查示右侧小脑血管母细胞瘤术后改变,右侧枕叶小片陈旧性软化灶,局部小脑内片状异常信号影,边界不清,信号欠均匀, T1WⅠ为低信号,T2WⅠ为高信号,增强未见明显异常强化,未见肿瘤残留或复发。
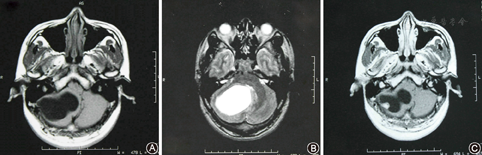

A.T1像右侧小脑半球见一椭圆形囊性病灶,大小约5.5 cm×4.0 cm;B.T2像四脑室受压,囊内信号均匀;C.增强扫描囊壁内见一大小约10 mm壁结节,强化明显,大囊未见强化,囊壁清晰
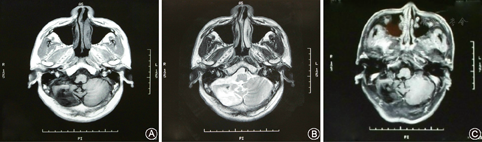

A.T1像右侧小脑半球不规则囊状低信号灶;B.T2像囊状高信号灶欠均匀,边界不清,脑室受压不明显;C.增强扫描未见明显异常强化,未见肿瘤残留或复发
垂体MRI检查(图3):矢状位垂体稍饱满,局部见一团块样信号影,大小约0.9 cm×0.5 cm,T1WI高信号,T2WI呈相对低信号影,考虑垂体微腺瘤并出血。
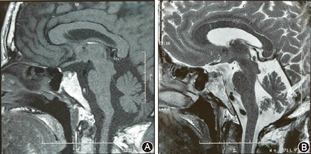

A.T1像矢状位垂体稍饱满,局部见一团块样高信号影,大小约0.9 cm×0.5 cm;B.T2像呈相对低信号影
腹部CT检查(图4):肝内多个低密度灶,边界部分清楚、部分模糊,较大的两个病灶直径2.0 cm,增强后明显强化,胰腺内低密度灶较大者直径3.0 cm,无强化,双肾多个结节状异常密度影,部分呈囊性水样密度,部分病灶内有分隔、伴结节样改变,增强扫描条索分隔及结节影有强化,囊性病灶无强化。腹部MRI检查:双肾多个大小不等异常信号影,T1WI为不均匀低信号、T2WI为等高混杂信号影,增强为轻中度不均匀强化,左肝外侧段及右肝下部异常信号影,呈向心性渐进性强化,另双肾、胰腺、肝脏多个大小不等未见强化囊肿信号影。CT及MRI诊断:双肾多发肿瘤,肝多发血管瘤,双肾、肝、胰腺多发囊肿。
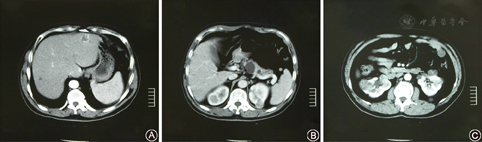

A.肝内多个低密度灶,边界部分清楚、部分模糊,增强后明显强化;B.胰腺内多个低密度灶较大直径3.0 cm,无强化;C.双肾多个结节状异常密度影,部分呈囊性水样密度,部分病灶内有分隔、伴结节样改变,增强扫描条索分隔及结节影有强化,囊性病灶无强化
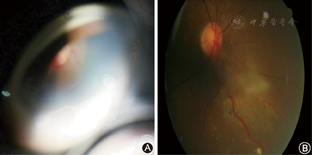
眼底镜检查(图5):右眼鼻下方靠前血管母细胞瘤,直径0.5 cm,可见粗大的滋养血管,黄斑水肿混沌,液体渗出。

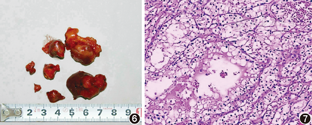
患者入院后全麻下行左侧保留肾单位肾癌切除术,右侧暂未给予处理。术中发现左肾多个肿瘤伴囊肿,最大者直径约3.5 cm,最小者约0.8 cm,包膜完整,突出于肾表面。手术顺利,术后病理报告:多发性透明细胞癌Ⅰ级(5个)(图6、图7)。术后1个月出院。出院诊断:VLH病Ⅰ型;双侧多发性肾癌伴多发性肾囊肿;小脑血管母细胞瘤术后;垂体微腺瘤;右眼视网膜血管母细胞瘤;肝、胰腺多发性囊肿;肝多发性血管瘤;左侧附睾头囊肿;红细胞增多症。

术后分子靶向药物治疗及其并发症:2010年1月(术后3周)开始口服舒尼替尼: 50 mg,每日1次,应用4周,停2周。服药期间反复出现腹胀、厌食、脚踝部肿胀、关节痛、皮炎、高血压。第2、3疗程出现濒死感,减量至25~37.5 mg,好转后恢复常规剂量,近1年治疗方案为37.5 mg,每日1次,应用4周,停2周。
术后分子靶向药物治疗长期疗效:患者除第1疗程采用舒尼替尼50 mg每日1次,应用4周方案外,后一直规律服用舒尼替尼37.5 mg每日1次,4/2方案。患者服药5个月后双肾肿瘤明显缩小;服药81个月后复查双肾CT提示双肾肿瘤依旧稳定,且右肾积水较前减轻,复查血肝肾功能均正常。随访近8年,患者带瘤生存,病情稳定,舒尼替尼疗效满意。
VHL病是一种由VHL基因突变引起的常染色体显性遗传性疾病,约每35 000例新生儿中就有1例。主要表现为视网膜及中枢神经系统的血管母细胞瘤、嗜铬细胞瘤、胰腺囊肿、胰腺神经内分泌肿瘤、肾囊肿、肾透明细胞癌[1]。其中,<25%的VHL病患者有转移性RCC。VHL病对治疗的反应、病程,以及转移性RCC合并VHL病的治疗、预后尚无明确结论[2]。VHL基因的失活导致缺氧诱导因子的聚集和某些因子的过表达,例如VEGF和PDGF,这些因子的过表达影响了肿瘤的增殖、生长和转移[3]。
本文基于1例VHL病患者接受舒尼替尼治疗后的临床和影像学特点,评估舒尼替尼对于该患者的长期疗效。不良反应包括服药期间反复出现腹胀、厌食、脚踝部肿胀、关节痛、皮炎、高血压;第2、3疗程出现濒死感、手足综合征(左小腿前侧皮肤感染坏死)等。在正确处理患者的不良反应后,结果显示患者接受舒尼替尼疗效满意,随访8年患者带瘤生存,病情稳定。
既往一项临床Ⅱ期研究评估了舒尼替尼在15例VHL病患者中的安全性和有效性[4],18个RCC病灶和21个血管母细胞瘤病灶均可评估;6个(33%)RCC病灶获得部分缓解,而血管母细胞瘤病灶未获得部分缓解。RCC和神经内分泌肿瘤病灶大小明显缩小。检测发现血管内皮生长因子受体-2的表达在血管母细胞瘤低于RCC。报告的Ⅲ级不良事件包括疲劳5例(33%)、手足综合征2例(13%)、恶心2例(13%)、高血压1例(7%)、中度粒细胞减少4例(26%)。
Roma等[5]回顾性分析了9例VHL病合并RCC患者的临床资料,平均接受9个周期的舒尼替尼治疗,8例疾病稳定,此8例中7例(87.5%)患者的肾脏、肝脏和胰腺结节病灶影像学密度均降低。所有的中枢神经系统血管母细胞瘤病灶均稳定,患者中位无进展生存时间>13个月。舒尼替尼治疗VHL病具有很好的疾病控制效果,不仅限于肾脏的病灶,而且对VHL相关的其他脏器的病灶也有作用,尤其是胰腺实体结节这种难以进行活检确认的病灶。
综上所述,舒尼替尼治疗VHL病显示出良好的疗效,并且不良反应可以耐受,可获得长期生存。后续可搜集更多病例进行分析,进一步明确舒尼替尼在这类疾病患者中的疗效。
VHL综合征也叫VHL病,表现为一系列的病变综合征,基本组成分为两部分:①视网膜、脑干、小脑或脊髓的血管母细胞瘤;②腹腔脏器病变(嗜铬细胞瘤、肾囊肿或肾细胞癌、胰腺囊肿等)。不同病变的组合其临床表现不相同,但其主要死亡原因是中枢神经系统血管母细胞瘤破裂出血、肾细胞癌和嗜铬细胞瘤引起的恶性高血压。对于合并的肾细胞癌,其与散发性肾细胞癌有所不同,常为双侧多发,该病例特点基本符合,通过手术切除主要病灶,获得明确病理,但由于双侧多发,无法手术根治,因此采用药物治疗。
目前上市的肾癌靶向药物作用机制基于大部分肾癌合并VHL基因突变,从而导致肿瘤新生血管生成,因此通过抗血管生成达到抗肿瘤治疗作用。因此,这些靶向药物对于VHL病导致的肾细胞癌治疗大多敏感,但这个病例接受舒尼替尼控制时间达到8年,确实比较长,疗效相当不错。


























