
膀胱恶性外周神经鞘膜瘤是一种罕见的恶性肿瘤,常继发于1型神经纤维瘤病(NF-1),少数为散发病例。本文报道1例行经尿道切除的70岁男性膀胱恶性外周神经鞘膜瘤患者,术后辅助吉西他滨膀胱灌注治疗,随访12个月,无局部复发和远处转移。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者,男,70岁。因无痛性血尿3周于2019年5月24日入院。无尿频、尿痛,无腰酸、腰疼,无畏寒、发热。有多囊肾病史;吸烟史40年,20支/天。查体未见明显阳性体征。泌尿系超声检查示膀胱9点处占位,前列腺增生伴结石,双肾多发囊肿,部分囊壁钙化,双肾形态欠规则,皮质回声稍增强,右肾结石,双侧输尿管未见明显扩张。尿常规示潜血(++)。泌尿系CT平扫示膀胱三角区右侧占位,基底较宽,轮廓欠光整,呈分叶状,内部见低密度灶,最大长径约29 mm(图1A);增强扫描肿瘤不均匀强化,坏死区不强化(图1B),周围未见明显肿大淋巴结影。胸部增强CT未见异常结节影。诊断膀胱占位,恶性肿瘤可能。全麻下行经尿道膀胱肿瘤切除术(TURBT)。镜下见膀胱右后壁圆形新生物,大小约2.5 cm×2.5 cm,蒂宽,表面稍有充血水肿,前列腺Ⅱ度增生,双侧输尿管口未见喷血,余未见实质性占位。予电切环将肿块完整切除,并将肿块基底周围1 cm膀胱黏膜切除,深达肌层,术中将标本及周围组织分别送病理检查。
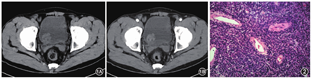

术后病理:送检组织大小为5.5 cm×4.5 cm×1.5 cm;镜下示梭形细胞密集排列,有异形,核分裂象最活跃处>10个/10HPF,局部见坏死(图2),肿块周围组织基底见肿瘤组织。免疫组化染色检查示S-100(+++)、GFAP(+++)、SOX-10(+++)、AE1/AE3(++)、PSA(-)、CK7(-)、CK20(-)、SMA(-)、Desmin(-)、GATA-3(-)、ALK(-)、HMB-45(-)、MyoD1(-)、EMA(-)、Melan-A(-)、CD57(-)、CK8/18(小灶+)、CD34(血管内皮细胞+)、CD31(血管内皮细胞+)、Ki-67(约20%+)。诊断为恶性外周神经鞘膜瘤(malignant peripheral nerve sheath tumors,MPNSTs)。术后第1天予吉西他滨膀胱灌注,术后第7天拔除导尿管出院。告知患者肿瘤高复发风险,患者仍要求保留膀胱,但因首次电切术后病理示肿块周围组织基底见肿瘤组织,术后1个月行二次电切术,病理未见肿瘤残留,术后未行辅助放化疗。第2次手术后门诊行吉西他滨膀胱灌注治疗,灌注方案:每周1次灌注8次,后每月1次灌注12次。第2次术后3、6、12个月复查膀胱镜未见复发,第2次术后9个月复查胸腹部CT及尿常规未见明显异常。
MPNSTs是一种罕见的起源于周围神经或神经鞘细胞的恶性软组织肿瘤,占所有软组织肉瘤的5%~10%,其中40%~50%继发于1型神经纤维瘤病(neurofibromatosis type 1,NF-1)的恶变[1]。NF-1是一种因NF基因突变导致功能缺失的获得性常染色体显性遗传疾病,研究结果表明约10%的NF-1患者伴发MPNSTs[2]。MPNSTs常见于躯干和四肢,头颈部较少,偶见于腹膜后及内脏器官[3]。因此MPNSTs发生在膀胱罕见,目前仅有少数病例报道。
MPNSTs生长迅速,常伴局部疼痛、压迫感,以及运动和感觉神经障碍。虽然影像学检查对MPNSTs的鉴别诊断有一定的辅助作用,但仍需要组织病理和免疫组化染色检查明确诊断。MPNSTs典型的病理特征是梭形细胞排列成束,部分肿瘤区域坏死较大,血管周围细胞增多。免疫组化染色检查是鉴别MPNSTs和其他肿瘤的重要方法,S100、Ki-67、NSE、p53、SMA、Vimentin、CD34阳性和H3K27me2缺失是诊断MPNSTs的重要指标[4,5]。
MPNSTs多经血液转移,淋巴转移少见,常见的转移部位有肺、软组织、骨、肝、脑、区域淋巴结、皮肤和腹膜后。其预后较差,局部复发率和远处转移率较高。临床研究结果表明,MPNSTs的5年总生存率为44%~57%,5年疾病特异性生存率为32%~50%,影响MPNSTs预后的因素有肿瘤>5 cm、病理分级高、既往有NF-1病史、伴远处转移、手术切缘阳性、S100阴性和Ki-67>20%阳性[3]。
完整切除肿瘤且保证切缘阴性是提高生存率的主要治疗方法[6],放疗作为一种辅助治疗手段可减少局部复发,改善预后。多数学者认为术后辅助放疗可显著延长无症状生存期,但其有效性仍存在争议[7]。目前推荐对于肿瘤较大、病理分级较高及手术切缘阳性的患者采用放疗作为MPNSTs标准治疗的一部分[8]。临床上,化疗在MPNSTs中的治疗作用未被肯定,所以较少应用,只有当肿瘤较大无法切除或远处转移时,才被作为一种治疗选择。
膀胱MPNSTs作为一种高度恶性肿瘤,既往病例大多都进行了早期根治性膀胱切除术,文献中仅报道了1例行TURBT治疗成功的散发膀胱MPNSTs合并原位癌患者,术后辅助卡介苗膀胱灌注治疗,随访2年未见肿瘤复发[9]。因该肿瘤临床罕见,所以膀胱MPNSTs术后辅助治疗的作用仍未明确。基于此病例,并结合国内外文献,我们总结诊治经验如下:①肿瘤多发、合并NF-1病史或切缘阳性者,应选择全膀胱切除术,术后辅助局部放疗;②单发散发的膀胱MPNSTs、无远处转移且切缘阴性者,可选择TURBT,2~6周内行二次电切,手术中对原部位扩大扩深切除,术后辅助膀胱灌注治疗;③保留膀胱者,参考高危非肌层浸润性膀胱癌随访方案,定期复查膀胱镜。
综上所述,膀胱MPNSTs是一种罕见的恶性肿瘤,TURBT是一种可选择的治疗方案,术后可辅以膀胱灌注治疗。但因MPNSTs有较高的复发和早期转移风险,患者应进行密切的长期随访。
所有作者均声明不存在利益冲突



























