
《中华人民共和国疫苗管理法》和其他相关法律法规对受种者或其监护人的疫苗和预防接种工作知情提出了要求,对预防接种告知方式和内容作出了规定。本共识以该法和《预防接种工作规范》为基础,借鉴国内外经验,阐述了预防接种知情告知的发展和形式,制定了预防接种知情告知理论框架、标准流程和信息、非免疫规划疫苗知情告知原则以及各疫苗知情同意书格式,为疾病控制和预防保健人员在预防接种服务中参考。本部分共识包括流感病毒疫苗、肺炎球菌疫苗、含b型流感嗜血杆菌成分疫苗、肠道病毒71型灭活疫苗、轮状病毒疫苗、水痘减毒活疫苗、带状疱疹疫苗、人乳头瘤病毒疫苗、人用狂犬病疫苗、肾综合征出血热疫苗、钩端螺旋体疫苗、炭疽疫苗、戊型肝炎疫苗、霍乱疫苗、伤寒疫苗、森林脑炎疫苗预防接种知情告知内容。

流感病毒是单股、负链、分节段的RNA病毒,包括甲、乙、丙、丁(或A、B、C、D)四型,具有易于发生变异的特点,特别是甲型流感病毒。目前引起全球人间流感季节性流行的病毒是甲型H1N1、H3N2亚型和乙型Victoria和Yamagata系[1, 2]。
轻症流感常与普通感冒表现相似,但其发热和全身症状更明显。重症病例可出现病毒性肺炎、继发细菌性肺炎、急性呼吸窘迫综合征、休克、弥漫性血管内凝血、心血管和神经系统等肺外表现和多种并发症[3]。
全人群对流感普遍易感。婴幼儿、老年人、孕妇和心血管疾病(单纯高血压除外)、慢性呼吸系统疾病、肝肾功能不全、血液病、神经系统疾病、神经肌肉功能障碍、代谢性疾病(包括糖尿病)等慢性病患者、免疫抑制疾病或免疫功能低下者,患流感后出现重症的风险较高。流感在温带地区表现为每年冬春季的季节性流行和高发。热带地区尤其在亚洲,流感的季节性呈高度多样化,呈半年或全年周期性流行,或全年循环。北半球通常在每年10月至次年5月间发生季节性流感流行,1-2月为高峰。中国南方省份夏季也可流行。
全球已上市的流感疫苗分为流感灭活疫苗(inactivated influenza vaccine,IIV)、流感减毒活疫苗(live attenuated influenza vaccine,LAIV)和重组流感疫苗(recombinant influenza vaccine,RIV)。根据生产工艺,可分为基于鸡胚、基于细胞培养和重组流感疫苗。国外还有针对特定人群的高抗原含量IIV、佐剂疫苗、皮内接种疫苗等。
中国批准上市的流感疫苗包括IIV和LAIV,均为基于鸡胚的疫苗:(1)IIV:包括三价IIV(IIV3)和四价IIV(IIV4),其中IIV3又分为裂解疫苗和亚单位疫苗,IIV4为裂解疫苗。IIV3疫苗组分包括甲型H1N1、H3N2和B型的一个系,IIV4在IIV3组分基础上增加了B型的另一个系。(2)LAIV:鼻喷三价LAIV(LAIV3)于2020年3月2日在中国获批上市。LAIV3鼻腔接种后活流感病毒疫苗株可在鼻咽部复制,疫苗株病毒具有毒力衰减(限制其反应原性和致病性)、温度敏感性(限制其在下呼吸道复制)和冷适应性(允许其在鼻咽部复制)3个特点。经鼻腔接种LAIV3后可诱导血清和鼻黏膜均产生抗体,也可诱导细胞介导的免疫反应。
中国一项Ⅳ期临床试验显示,≥6月龄人群接种IIV3后血清抗体保护率≥88%,几乎所有年龄组所有菌株血清血凝抑制抗体阳转率或几何平均滴度(geometric mean titer,GMT)均升高≥78.2%[4]。在≥18岁成人中,IIV3与IIV4相同疫苗株的血清保护率和抗体阳转率均无显著性差异,IIV4的B型流感系的抗体保护率和抗体阳转率明显高于IIV3[5, 6]。根据研究发表数据,LAIV3在婴幼儿、学龄儿童的免疫反应较成年人好[7, 8],具有良好免疫原性[9, 10]。
人体感染流感病毒或接种流感疫苗后获得的免疫力会随时间衰减[11],衰减程度与人的年龄和身体状况、疫苗抗原等因素有关。临床试验证据提示,接种IIV对抗原类似毒株的保护性抗体水平可维持6~8个月[12],接种1年后血清抗体水平显著降低,但部分毒株的保护性抗体持续时间可更长。为匹配不断变异的流感病毒,世界卫生组织(WHO)在多数季节推荐的流感疫苗组分会更新一个或多个毒株,有时疫苗毒株与前一季节完全相同。为保证接种人群得到最大程度的保护,即使流感疫苗组分与前一季节完全相同,鉴于多数接种者抗体滴度已显著下降[13, 14, 15],无论前一季节是否接种流感疫苗,仍建议在当年流感季节来临前接种。
在健康成人中,IIV可预防约59%的实验室确诊流感[16]。妊娠期间接种疫苗不仅能够有效保护妊娠女性,也能对出生后6个月内无法接种流感疫苗的婴儿起到保护作用[17]。流感疫苗高覆盖(>50%)时,学校流感暴发风险显著降低84%[18]。有研究显示老年人接种流感疫苗后预防流感的保护效力为58%[19],同时可减少慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)、慢性支气管炎、哮喘、冠心病等慢性基础性疾病的感染和发作[20, 21, 22, 23]。一项2016-2017流行季在中国东部地区3~17岁儿童中开展的随机、双盲、对照试验显示[24],LAIV3对所有亚型流感的效力为62.5%(95%CI:27.6%~80.6%),对A(H3 N2)亚型流感的效力为63.3%(95%CI:27.5%~81.5%)。对6项安慰剂对照试验研究的Meta分析显示,LAIV3对6~83月龄儿童实验室确诊流感合并急性中耳炎的保护效果为85%(95%CI:78%~90%)[25]。
肌内注射接种IIV常见的局部反应为接种部位红晕、肿胀、硬结、疼痛、烧灼感等,常见的全身反应为发热、头痛、头晕、嗜睡、乏力、肌痛、周身不适、恶心、呕吐、腹痛、腹泻等。反应通常是轻微的,并在几天内自行消失,极少出现重度反应。研究表明IIV3与IIV4在安全性上没有显著性差异[26, 27]。
中国2015-2018年疑似预防接种异常反应(AEFI)监测分析显示,IIV报告不良反应以发热(腋温≥37.1 ℃)最多,其中高热(腋温≥38.6 ℃)发生率为4.27/10万剂,儿童型疫苗(4.47/10万剂)略高于成人型疫苗(4.17/10万剂);在非严重异常反应中,过敏性皮疹(442例,0.53/10万剂)和血管性水肿(70例,0.08/10万剂)报告最多;严重异常反应报告发生率低,为0.14/10万剂,其中热性惊厥(27例,0.03/10万剂)和过敏性紫癜(21例,0.03/10万剂)最多[28]。
儿童接种LAIV3后报告不良反应包括流鼻涕或鼻塞、头痛、发热、呕吐、腹痛、肌痛等[29, 30, 31, 32, 33],多为首次接种LAIV3发生,并且为自限性。中国鼻喷LAIV3的一项Ⅲ期临床试验显示,4 500名3~17岁受试者接种1剂次LAIV3后安全性观察至接种后6个月以上,十分常见不良反应包括发热、流涕/鼻塞,常见不良反应包括咽痛、头痛、乏力或嗜睡、呕吐、食欲下降、咳嗽、上呼吸道感染、肌肉痛、恶心、烦躁,偶见不良反应包括变态反应、关节痛、鼻咽炎和寒战。
无论是儿童还是成年人,在接种LAIV后出现部分受种者排出疫苗株病毒的情况,排毒量和排毒时长均要少于自然感染流行毒株[34, 35]。偶有报道LAIV疫苗株病毒发生从受种者向未接种者的传播,但尚未发现被疫苗株病毒感染的未接种者发生严重疾病的报告[36]。
所有≥6月龄愿意接种疫苗且无禁忌证的人均可接种流感疫苗。现有流感疫苗不可以直接给6月龄以下婴儿接种,该人群可通过母亲孕期和哺乳期接种和对婴儿的家庭成员和看护人员接种流感疫苗,而预防流感。建议60岁以上老年人接种流感疫苗[1]。
中国批准上市的IIV3用于≥6月龄人群接种,其中0.25 ml剂型(含每种组分血凝素7.5 μg)用于6~35月龄婴幼儿,0.5 ml剂型(含每种组分血凝素15 μg)用于≥36月龄人群;IIV4用于≥6月龄人群接种,每剂次0.5 ml(含每种组分血凝素15 μg);LAIV3为冻干制剂,每剂次0.2 ml,含甲型H1N1、A(H3N2)亚型、B(Victoria)系减毒病毒滴度分别不低于6.9、6.9、6.4 lgEID50,用于3~17岁人群。受种者可自愿选择接种任一种流感疫苗,无优先推荐[1]。
6月龄~8岁儿童:既往年度接种<2剂次流感疫苗者应接种2剂次IIV3、IIV4或LAIV,间隔≥4周;既往年度接种过≥2剂流感疫苗者接种1剂。≥9岁儿童和成人:接种1剂IIV3、IIV或LAIV。
通常接种流感疫苗2~4周后可产生具有保护水平的抗体,6~8个月后抗体滴度开始衰减。中国各地每年流感活动高峰出现的时间和持续时间不同,为保证受种者在流感高发季节前获得免疫保护,最好在10月底前完成免疫接种;10月底前未接种的对象,整个流行季节都可以接种。同一流感流行季节已按照免疫程序完成全程接种的人员,无需重复接种[1]。孕妇在孕期的任一阶段均可接种IIV,只要本年度流感疫苗开始供应,可尽早接种[1]。
IIV接种采用肌内注射(皮内注射制剂除外)。成人和>1岁儿童首选上臂三角肌接种疫苗,6月龄至1岁婴幼儿的接种部位以大腿前外侧为最佳[4,37]。LAIV3的接种采用鼻内喷雾法,严禁注射。
对疫苗中所含任何成分包括辅料、甲醛、裂解剂、抗生素等过敏者禁止接种。伴或不伴发热症状的急性疾病者,建议症状消退后再接种。以下人群不建议接种LAIV:接种前48 h服用过流感抗病毒药物者;患有哮喘的2~4岁儿童;因使用药物、人类免疫缺陷病毒(HIV)感染等原因造成免疫功能低下者;需要与严重免疫功能低下者进行密切接触的人群;孕妇和使用阿司匹林或含有水杨酸成分药物治疗的儿童和青少年。
和使用任何药物一样,接种疫苗有可能造成严重的过敏反应、其他严重损伤或死亡,但是可能性极小。
全身反应为发热、寒颤、头痛、头昏、关节痛、疲劳/乏力、瘙痒、皮疹,局部反应为接种部位出现红、肿、痛、硬结等。一般在注射后1~2 d内自行消失,不需处理。
可出现一过性感冒症状和全身不适,可自行消失,不需特别处理;重度发热应采用物理方法或药物对症处理,以防高热惊厥。
过敏性皮疹:一般在接种疫苗后72 h内出现荨麻疹,应及时就诊,给予抗过敏治疗;过敏性紫癜:出现过敏性紫癜反应要及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎;过敏性休克:一般在接种疫苗后1 h发生,应及时采取注射肾上腺素等抢救措施;血管性水肿:肿胀通常出现在头颈部,包括面部、嘴唇、舌、咽喉或身体其他部位。
同裂解IIV。
一般为皮肤反应,如瘙痒、荨麻疹或特异性皮疹。
神经痛、感觉异常、惊厥、一过性血小板减少。
过敏性休克、脑脊髓膜炎、神经炎、吉兰-巴雷综合征。
发热(≥37 ℃)、流涕/鼻塞等。
咽痛、头痛、乏力或嗜睡、呕吐、食欲下降、咳嗽、上呼吸道感染、肌肉痛、恶心、易激惹或烦躁。
变态反应、关节痛、鼻咽炎、寒颤。
肺炎球菌疾病(pneumococcal disease,PD)由肺炎球菌(Streptococcus pheumoniae,Spn)引起。Spn是革兰阳性双球菌,有荚膜多糖和菌体抗原。外覆荚膜多糖是Spn血清分型的依据,已鉴定出90余种血清型。荚膜多糖是Spn致病的重要毒力因子,也是制备肺炎球菌疫苗的最主要抗原[41, 42]。
根据Spn感染部位不同,PD可分为侵袭性肺炎球菌疾病(invasive pneumococcal disease,IPD)和非侵袭性肺炎球菌疾病(non-invasive pneumococcal disease,NIPD)两大类。IPD指Spn侵入原本无菌的部位和组织所引发的感染,常见的有菌血症性肺炎、胸膜炎和脑膜炎;NIPD即Spn感染到原本与外环境相通的部分所引起的疾病,如中耳炎、鼻窦炎和非菌血症性肺炎等[41,43]。
Spn广泛分布于自然界,除大猩猩外[44],人类是其唯一宿主。Spn是一种条件致病菌,可长期定植于人的鼻咽部而不引起临床疾病。一旦机体抵抗力下降时,Spn透过黏膜防御体系发生侵袭性感染[41,45]。在中国<5岁呼吸道感染儿童中,Spn携带率为28.6%[46]。
Spn在人与人之间传播,一般经由呼吸道飞沫传播或由定植菌导致自体感染[45]。Spn是引起中国婴幼儿和老年人发病和死亡的重要病因[47, 48, 49]。2岁以下儿童是PD高发人群。平均75%的IPD病例和83%的肺炎球菌脑膜炎病例发生在<2岁儿童[50]。
WHO把PD和疟疾列为需“极高度优先”使用疫苗预防的疾病。WHO估计,2015年中国<5岁儿童肺炎球菌肺炎严重病例数近20万例,病死率为1%,死亡率为6.43/10万;肺炎球菌脑膜炎8 000余例,病死率为13%,死亡率为1.35/10万,肺炎球菌感染的其他严重病例近万例,病死率为10%,死亡率为1.21/10万[45]。
中国目前使用的肺炎球菌疫苗有13价肺炎球菌多糖结合疫苗(13-valent pneumococcal polysaccharide conjugate vaccine,PPCV13)和23价肺炎球菌多糖疫苗(23-valent pneumococcal polysaccharide vaccine,PPV23)。
用于婴幼儿的主动免疫,以预防由13种肺炎球菌血清型(1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F)引起的侵袭性疾病,包括菌血症性肺炎、脑膜炎、败血症和菌血症等,但不能预防该疫苗以外的血清型别和其他微生物导致的侵袭性疾病。目前中国有三种不同载体的PPCV13上市或即将上市,即无毒白喉类毒素突变体(CRM197)、破伤风类毒素(TT)和破伤风/白喉类毒素(TT/DT)载体疫苗。
系采用23种血清型肺炎球菌,包括1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、I8C、19A、19F、20、22F、23F和33F血清型,经培养、提纯制成的多糖疫苗。PPV23为非T细胞依赖性抗原,在<2岁婴幼儿体内难以产生有效的保护性抗体。≥2岁儿童一般在疫苗接种后产生明显的抗体水平升高。中国一项在≥2岁儿童中开展的PPV23免疫原性研究表明,PPV23可诱导明显的免疫应答,23种血清型抗体的2倍增长率在51.49%~97.01%之间,8、9N、18C和33F型血清型增长率超过90%。在具有免疫能力的成年人中,用PPV23进行免疫接种可以诱导血清型特异性抗荚膜抗体水平显著增高。PPV23在≥65岁人群中能诱导出12种疫苗血清型(1、3、4、5、6B、7F、9V、14、18C、19A、19F、23F)的功能性免疫应答。老年人首次接种疫苗后4年以上复种疫苗,其抗荚膜抗体水平明显升高[51]。
CRM197载体PPCV13在加拿大引入3年后,<5岁儿童IPD发生率由18/10万降至14.2/10万。美国引入PPCV13后社区获得性肺炎住院率明显下降,<2岁、2~4岁儿童和18~39岁成人中分别下降21%、17%和12%[45]。2010年美国波士顿开展的一项<60月龄儿童Spn携带率监测研究发现,与未接种者相比,PPCV13接种者中PPCV13血清型定植下降74%[52]。PPCV13对中国≤5岁儿童IPD致病菌株血清型覆盖率达87.7%[53]。
TT载体PPCV13上市临床试验为非劣性试验,2020年初上市,效果数据仍在积累中。TT/DT载体PPCV13上市临床试验为非劣性试验,目前尚未上市。
PPV23接种后可预防IPD的发生,但在老年人群中,其保护效力随着接种对象年龄的增加而下降,<55岁人群中效力最高,≥85岁人群中效力最低,并随着时间的增长而下降(接种后<3年效果最好,接种后>5年效果最差)[54]。
基础免疫在2、4、6 月龄各接种1剂,加强免疫在12~15月龄接种1剂。基础免疫首剂最早可以在6周龄接种,之后各剂间隔4~8周。目前,中国尚无本品应用于6月龄以上婴幼儿相应免疫程序的临床试验数据。
①2~6月龄(最小满6周龄)婴儿:共接种4剂,首剂在2月龄(最小满6周龄)接种,基础免疫接种3剂,每剂次接种间隔2个月;于12~15月龄时加强接种第4剂。推荐首剂在3月龄接种,基础免疫接种3剂,每剂次接种间隔1个月;于12~15月龄时加强接种第4剂。②7~11月龄婴儿:基础免疫接种2剂,接种间隔至少2个月;于12月龄以后加强接种1剂(第3剂),与第2剂接种至少间隔2个月。③12~23月龄幼儿:接种2剂,接种间隔至少2个月。④2~5岁儿童:接种1剂。
PPCV13仅供肌内注射。首选部位婴儿为大腿前外侧(股外侧肌),幼儿及儿童为上臂三角肌。肌内注射剂量为0.5 ml,注意避免神经和血管中或其附近部位注射PPCV13。
①CRM197载体PPCV13:对产品中任何活性成分、辅料或白喉类毒素过敏者。②TT载体PPCV13:对产品中任何成分包括辅料、破伤风类毒素等过敏者。
推荐用于2岁以上的易感人群,尤其是以下重点人群:①50岁以上(含50岁)者可作常规接种;②患有可增加肺炎球菌感染性疾病危险的慢性疾病者,如心血管疾病、肺部疾患、肝脏及肾脏功能受损者;③免疫缺陷患者,如脾切除者或是由镰状细胞性疾病及其他原因引起的脾功能障碍者;④患有其他慢性疾病而可能感染肺炎球菌的高危人群(如乙醚滥用)及并存如糖尿病、慢性脑脊髓液渗漏、免疫抑制等疾病患者,或是反复发作的上呼吸道疾病,包括中耳炎、副鼻窦炎等疾病患者;⑤何杰金氏病患者;⑥群体接触密切者,如寄宿学校、养老院及其他相似场所的人群;⑦具有发生流行性感冒并发症,特别是肺炎的高危人群;⑧当疫苗中含有的某型肺炎球菌在社区人群爆发流行时的高危人群。
推荐常规免疫接种程序:①何杰金氏病患者如需接种疫苗,可在治疗开始前两周给予。治疗期间不主张免疫接种;②免疫缺陷患者,应于术前两周接种;③脾切除者,每5年加强免疫一次,每次注射剂量0.5 ml;④对10岁以下脾切除或患有镰状细胞性贫血的儿童,应每隔3~5年加强免疫一次。
上臂外侧三角肌皮下或肌内注射。每次注射0.5 ml。PPV23还可于大腿中外侧皮下或肌内注射。
对疫苗中任何成分过敏者禁用。
①CRM197载体PPCV13:十分常见:食欲下降、易激惹、嗜睡/睡眠增加、入睡困难/睡眠减少、发热,注射部位发红、硬结/肿胀或疼痛/触痛,幼儿接种后注射部位发红或硬结/肿胀可达2.5~7.0 cm。常见:腹泻、呕吐、皮疹、超过39 ℃的发热,婴儿接种后注射部位发红或硬结/肿胀可达2.5~7.0 cm,注射部位疼痛/触痛并影响运动。偶见:哭闹、惊厥(包括热性惊厥)、荨麻疹或荨麻疹样皮疹、注射部位硬结/肿胀或发红>7.0 cm。②TT载体PPCV13:十分常见:发热、腹泻、局部发红。常见:哭闹、咳嗽、恶心/呕吐、乏力/嗜睡、变态反应,局部肿胀、疼痛、硬结,偶见肌肉痛、局部瘙痒。
CRM197载体PPCV13:过敏反应(包括面部水肿、呼吸困难和支气管痉挛)、低张力-低反应发作。
注射部位出现暂时的疼痛、红肿、硬结和短暂的全身发热反应等轻微反应,一般均可自行缓解,必要时可给予对症治疗。
头痛、不适、虚弱无力、淋巴结炎、关节痛、肌痛,皮疹、荨麻疹、血清病或其他过敏性反应。对稳定的特发性血小板减少性紫癜的患者,会极偶然地在接种后2~14 d出现血小板减少复发,可持续2周。罕有神经系统异常的报道,如感觉异常、急性神经根病变等,但与接种疫苗的因果关系尚未被证实。
(1)处于发热、急性病、慢性病急性发作期者应暂缓接种。(2)血小板减少症、任何凝血障碍或接受抗凝血剂治疗者和免疫功能受损者(例如恶性肿瘤、肾病综合征患者)慎用。(3)不能保证所有受种者不会罹患肺炎球菌性疾病。(4)暂不推荐CRM197载体PPCV13与其他免疫规划疫苗或常规儿童疫苗同时接种。(5)在任何情况下,TT载体PPCV13中的破伤风类毒素不能代替常规破伤风类毒素的免疫接种。(6)在≥24月龄的镰刀型细胞贫血症、无脾、HIV感染、慢性疾病或其他免疫功能受损的儿童中,使用PPCV13不能代替PPV23。
(1)处于发热、急性病、慢性病急性发作期者应暂缓接种。(2)血小板减少症、任何凝血障碍或接受抗凝血剂治疗者和免疫功能受损者(例如恶性肿瘤、肾病综合征患者)慎用。(3)孕期和哺乳妇女不应接种。(4)用于正在进行免疫抑制治疗的患者时,血清中可能不出现所期望的抗体反应。(5)有严重心脏和肺部疾病的患者接种时应极为慎重,需严密监测全身不良反应的发生。
流感嗜血杆菌是嗜血杆菌属中最常见的对人有致病性的细菌,可引起原发性化脓性感染和呼吸道继发感染。流感嗜血杆菌是一种革兰阴性杆菌,根据荚膜多糖化学成分的不同,可分为a、b、c、d、e和f六个血清型,其中b型流感嗜血杆菌(hemophilus influenzae b,Hib)致病力最强,约95%的侵袭性流感嗜血杆菌疾病由Hib引起。Hib的荚膜含磷酸多聚核糖基核糖醇(PRP),能逃避补体介导的杀菌作用和脾的清除作用,躲避细胞吞噬,利于通过血流传播,是侵袭性疾病发病机制中的一个重要决定因素。<24月龄儿童对纯多糖抗原尚不具备有效免疫应答能力,因此极易罹患侵袭性Hib疾病[55, 56, 57]。
中国目前使用的预防Hib疾病的疫苗包括单价Hib疫苗、AC群脑膜炎球菌(结合)b型流感嗜血杆菌(结合)联合疫苗(MPCV-AC/Hib)、无细胞百白破b型流感嗜血杆菌联合疫苗(DTaP-Hib)、无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗(DTaP-IPV/Hib)四种,均为非免疫规划疫苗。MPCV-AC/Hib还可预防A群和C群流行性脑脊髓膜炎,DTaP-Hib还可预防百日咳、白喉和破伤风,DTaP-IPV/Hib还可预防百日咳、白喉、破伤风和脊髓灰质炎。
对侵袭性 Hib 疾病具备短期保护效果的血清学抗体水平为抗PRP IgG>0.15 μg/ml。在完成含Hib成分疫苗基础免疫1个月后,抗PRP IgG≥1.0 μg/ml,表明对侵袭性Hib疾病具备了长期抵御能力[55]。根据载体蛋白不同,目前上市使用的Hib疫苗包括破伤风类毒素载体(PRP-T)、白喉类毒素无毒突变体载体(PRP-CRM197)和脑膜炎球菌外膜蛋白复合体载体(PRP-OMP)疫苗。
PRP-T和PRP-CRM197载体疫苗的免疫原性相似,在基础免疫后95%以上受种者抗 PRP IgG>0.15 μg/ml,且大部分受种者的抗体水平超过1.0 μg/ml,具有很好的免疫原性[57];在第二年加强接种1剂后两种疫苗均可诱导良好的加强免疫应答,97%以上受试者抗 PRP IgG≥1.0 μg/ml,具备长期抵御能力[57,60,62]。接种1剂或2剂PRP-OMP载体疫苗后即可在更多儿童中诱导出超过阈值(0.15 μg/ml或1.0 μg/ml)抗PRP IgG;12~15月龄加强免疫1剂PRP-OMP载体疫苗后也可诱导明显的加强免疫应答,但弱于PRP-T和PRP-CRM197载体疫苗,因此更适用于早发性Hib疾病高发的人群[55,57]。
根据上市前临床研究数据,2~5月龄、6~11月龄、12~71月龄儿童分别完成3剂次、2剂次、1剂次免疫后,抗A群脑膜炎球菌抗体阳转率分别为100%、99.63%、97.93%,抗C群脑膜炎球菌抗体阳转率分别为92.66%、99.27%、97.93%,抗Hib抗体阳转率分别为96.53%、96.34%、92.76%[63]。
根据上市前临床研究数据,完成3剂次基础免疫后,抗白喉抗体阳转率为100%,抗破伤风抗体阳转率为100%,抗Hib抗体阳转率为98.79%,抗百日咳毒素(PT)抗体阳转率为98.06%,抗百日咳丝状血凝素(FHA)抗体阳转率为97.33%[64]。
在中国开展的研究显示,DTaP-IPV/Hib完成2-3-4月龄和3-4-5月龄基础免疫后,抗破伤风抗体、抗白喉抗体、抗1型和2型脊髓灰质炎抗体、抗PT抗体阳转率均达100%,抗3型脊髓灰质炎抗体阳转率分别达100%和99.6%,抗PRP抗体≥0.15 μg/ml比例分别为97.6%和99.1%,抗PRP抗体≥1.0 μg/ml比例分别为92.1%和95.6%,抗FHA抗体阳转率分别为98.0%和99.6%[65]。
系统综述发现,Hib疫苗对侵袭性Hib疾病的效力达到84%(95%CI:69%~92%)[66]。PRP-T、PRP-CRM197、PRP-OMP载体Hib疫苗的效力分别82%、86%、86%,没有显著性差异[66]。研究观察显示,接种3剂Hib疫苗对侵袭性Hib疾病的保护效果为95%(95%CI:82%~99%),对确诊Hib脑膜炎的保护效果为91%(95%CI:73%~97%)[67],接种Hib疫苗能产生良好的长期保护效果,可大幅降低Hib疾病的发生率。基础免疫的接种间隔均为1或2个月,接种间隔的不同基本上不影响疫苗效果[68],且含有加强剂次免疫程序的免疫持久性较好[69]。此外,接种含Hib成分的联合疫苗对Hib疾病的保护效果与接种单价Hib相似。
中国研究显示,Hib疫苗的不良反应很少见,且反应轻微[56,58]。约20%~25%的受种者在接种后24 h内出现接种部位的疼痛或触痛,可在3 d内自行缓解,约2%的受种者接种后出现发热[62]。
根据上市前临床试验观察和中国相关研究,受试者全身反应和局部反应均以轻、中度反应为主。常见全身不良反应为发热、烦躁、腹泻、厌食、呕吐、乏力、皮疹,其中消化道症状较为明显,常见的局部不良反应为发红、肿胀、硬结、疼痛,偶见水泡、瘙痒[70]。
中国DTaP-Hib大规模上市后安全性观察显示,DTaP-Hib不良反应/事件发生率低,全身反应多为发热和呕吐,局部反应多为发热和肿胀,随接种剂次数增加局部和全身不良反应发生率增加,疫苗具有良好的安全性[71];此外,中国研究显示,上臂三角肌、臀部肌肉和股外侧肌3个部位接种DTaP-Hib不良反应发生率均较低,均具有较好的安全性,其中股外侧肌接种的不良反应发生率最低[72]。
安全性和免疫原性研究显示,DTaP-IPV/Hib多数主动监测的不良反应为轻度,采用2-3-4月龄或3-4-5月龄基础免疫或18~20月龄加强免疫接种DTaP-IPV/Hib主动监测注射部位发生任何反应的总例数小于分别同时接种的DTaP、IPV、Hib疫苗组[65]。常见的局部反应为注射部位触痛和发红,常见的全身反应为发热、异常哭闹、食欲下降等。
6月龄以下儿童:基础免疫共3剂,2或3月龄开始接种,间隔1~2个月(至少4周),在18月龄加强免疫1剂;6~12月龄儿童,基础免疫共2剂,间隔1~2个月(至少4周),在18月龄加强免疫1剂;13~59月龄儿童:接种1剂。加强免疫与基础免疫最后1剂至少间隔8周[56]。
适用于2~71月龄儿童。2~5月龄接种3剂;6~11月龄接种2剂;12~71月龄接种1剂。各剂次间隔至少1个月。
适用于≥3月龄婴幼儿。3月龄起,出生6个月内进行3剂基础免疫,间隔1个月,18~24月龄加强免疫1剂。
适用于≥2月龄婴幼儿。2-3-4或 3-4-5月龄进行3剂基础免疫;18月龄加强免疫1剂。
Hib疫苗每剂次0.5 ml,于上臂外侧三角肌或大腿前外侧(婴幼儿)肌内注射。
已知对Hib疫苗任何成分过敏特别对破伤风类毒素过敏者;既往接种Hib疫苗后有过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;严重心脏疾病、高血压者;患肝脏疾病、肾脏疾病者。
接种Hib疫苗后可出现发热,注射部位可出现轻微红肿、硬结和压痛,偶有局部瘙痒感、烦躁、嗜睡、呕吐、腹泻、食欲不振、头痛和皮疹。
高热[73]。
过敏性皮疹、血管神经性水肿、过敏性休克和热性惊厥[73]。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女慎用Hib疫苗。
部分人群罹患侵袭性Hib疾病风险较高,包括早期补体成分缺乏症、免疫球蛋白缺乏症、功能性或解剖性无脾症、HIV感染者,造血干细胞移植受体、接受化疗或放疗的恶性肿瘤病例,这些特殊人群需尽早接种Hib疫苗[56]。
肠道病毒71型(enterovirus type 71,EV71)是人类肠道病毒的一种,具有脊髓前角神经组织嗜性,可以引起中枢神经系统感染(无菌性脑炎和脑膜炎、脊髓灰质炎样麻痹)。基于全长VP1区核苷酸序列的差异,目前将EV71分为A、B、C、D、E、F和G七个基因型,B和C基因型分布较广,C4基因型为中国1998年以来EV71流行的优势基因型,分为C4a和C4b两个亚型,其中C4a亚型为2007年来引起中国手足口病(hand,foot and mouth disease,HFMD)重症和死亡病例的绝对优势亚型[74]。中国的EV71灭活疫苗是以C4a分支病毒株为基础研发的。
EV71感染临床表现差异较大,可呈隐性感染[75, 76],也可发展为临床病例,其中以HFMD、疱疹性咽峡炎和神经系统感染最常见[77],部分患者可发生严重并发症,甚至死亡。EV71感染相关HFMD急性起病,以发热和手、足、口等部位斑丘疹或疱疹为主要特征,可伴有咳嗽、流涕、食欲不振、恶心、呕吐、头痛等症状,部分病例皮疹表现不典型。少数病例(尤其是<3岁者)病情进展迅速,在发病1~5 d左右出现脑膜炎、脑炎(以脑干脑炎最为凶险)、脑脊髓炎、肺水肿、循环障碍等,极少数病例病情危重,可致死亡,存活病例可留有后遗症。
EV71流行范围遍布全球。中国各地全年均有HFMD发生,夏季是主要流行季节,不同年度HFMD病原构成存在差异,但重症病例和死亡病例中始终以EV71为主[78]。EV71可通过粪-口途径以及接触患者的粪便、呼吸道分泌物(如打喷嚏喷的飞沫等)和疱疹液及被其污染的物品传播。患者和隐性感染者均可成为传染源,患者潜伏期也具有传染性。通常以发病后一周内传染性最强。HFMD主要发生在<5岁儿童,其中1岁组发病水平最高,年龄别发病率、情严重程度均随着年龄增长而下降,<6月龄婴儿病情最重。由于儿童普遍易感且隐性感染比例较高,接触传播途径容易实现,因此2剂次易引起暴发。
EV71灭活疫苗具有良好的免疫原性[79, 80, 81, 82],EV71灭活疫苗接种后28 d,血清抗体阳转率为88.1%~100%。目前关于EV71疫苗免疫持久性研究数据有限,根据对Ⅲ期临床研究对象的跟踪观察[79, 80],接种后56 d至8个月,EV71中和抗体滴度有所下降,8~14个月抗体水平处于相对稳定状态,但抗体阳性率未见下降。免疫后两年的观察结果显示,中和抗体水平和临床保护效力仍然维持在较高水平[83]。
接种EV71灭活疫苗可刺激机体产生抗EV71的免疫力,用于预防EV71感染所致的HFMD。接种2剂次EV71灭活疫苗对于EV71感染相关HFMD的保护效力为90.00%~97.45%,对于EV71引起的相关疾病的保护效力为80.4%~88.0%。受样本量限制,对EV71感染所致重症病例的保护效力尚缺乏准确估计。对柯萨奇病毒A16型(CV-A16)和其他肠道病毒感染HFMD无保护效力[84, 85]。不同基因型毒株的免疫原性研究结果显示,疫苗株对EV71不同基因型和亚型具有交叉保护作用[85, 86]。
EV71灭活疫苗具有良好的安全性,接种后的局部反应主要表现为接种部位红、硬结、疼痛、肿胀、瘙痒等,以轻度为主,持续时间不超过3 d,可自行缓解。全身反应主要表现为发热、腹泻、食欲不振、恶心、呕吐、易激惹等,呈一过性。严重程度达到3级以上的所有症状(如发热、腹泻、恶心、呕吐等)的发生率在疫苗接种组和对照组之间无显著性差异。
EV71灭活疫苗为非免疫规划疫苗,需在受种者或其监护人的知情同意下自愿自费接种。
EV71型灭活疫苗(Vero 细胞):接种对象为6月龄至3岁EV71易感者,基础免疫程序为2剂次,间隔1个月。EV 71型灭活疫苗(人二倍体细胞):接种对象为6月龄至5岁EV71病毒易感者,基础免疫程序为2剂次,间隔1个月。
上臂三角肌肌内注射,每1人次剂量为0.5 ml。
对EV71灭活疫苗中任何一种成分过敏者;发热、急性疾病期患者和慢性疾病急性发作者;严重慢性疾病、过敏体质者。
常见全身不良反应包括发热、腹泻、食欲不振/厌食、烦躁/易激惹、腹泻、恶心、呕吐、嗜睡、乏力等,常见局部不良反应包括注射部位疼痛、发红、肿胀、硬结等,必要时可对症治疗。
罕见全身不良反应包括变态反应/过敏反应、咳嗽、流涕、感冒/上呼吸道感染症状等,罕见局部不良反应包括瘙痒等,通常不需特殊处理,必要时及时到医院就诊。
患有血小板减少症或者出血性疾病者,肌内注射EV71灭活疫苗可能会引起注射部位出血,应慎重接种。正在接受免疫抑制治疗或免疫功能缺陷的患者,接种EV71灭活疫苗产生的免疫应答可能会减弱,接种应推迟到治疗结束后或确保其得到了很好的保护。对慢性免疫功能缺陷的患者,即使基础疾病可能会使免疫应答受限,也应推荐接种。未控制的癫痫患者和其他进行性神经系统疾病(如吉兰-巴雷综合征等)患者,应慎重考虑是否接种。
接种EV71灭活疫苗与注射人免疫球蛋白应至少间隔1个月以上,以免影响免疫效果。
轮状病毒属呼肠孤病毒科,病毒颗粒分为3层,内含11个双股RNA片段组成的病毒基因组,11个基因片段可发生重配,导致自然界中有大量不同病毒株[87, 88]。病毒外层衣壳含有结构蛋白VP7和VP4,可诱导产生中和抗体。VP7蛋白目前确定有36种VP7抗原(G血清型),是免疫保护的主要决定型。VP4蛋白目前有51种VP4抗原(P血清型),不同P血清型之间会发生普遍的交叉反应[88, 89]。目前采用G和P血清型双命名系统确定毒株类型。根据内层衣壳蛋白VP6抗原特征将轮状病毒分为10个组群(A~J组)。A组轮状病毒可感染人和多数哺乳动物,也是5岁以下儿童急性胃肠炎最常见的病原体。
中国目前使用的轮状病毒疫苗有单价口服轮状病毒疫苗(monovalent oral rotavirus vaccine,RV1)和五价口服轮状病毒疫苗(pentavalent oral rotavirus vaccine,RV5)。
RV1为口服减毒活疫苗,系用羊源轮状病毒减毒株(LLR株)[88],接种新生小牛肾细胞,经培养、收获病毒液并加入蔗糖和乳糖保护剂制成,可刺激机体产生针对A群轮状病毒的免疫力。RV5用于预防轮状病毒G1、G2、G3、G4和G9血清型感染导致的婴幼儿RVGE,包含5种人-牛的轮状病毒重配株,其中4种重配株表达人源毒株VP7蛋白(血清型G1、G2、G3、G4之一)和牛毒株VP4蛋白(血清型P7),1种重配毒株表达人毒株的VP4蛋白(血清型P1A)和牛毒株的VP7蛋白(血清型G6)[88,93]。
轮状病毒疫苗保护率存在明显的地区差异性,且对不同血清型RVGE的保护率也有所差异[94]。口服轮状病毒疫苗可以不同程度地降低轮状病毒感染性腹泻的发病,减少重症病例和缩短病程[92]。在发达国家,RV5对轮状病毒(不分血清型别)感染所致急性肠炎的保护效果达87%;在中等发展水平国家,RV5对轮状病毒(不分血清型别)感染所致急性肠炎的保护效果略低,仅为62%[95]。RV5的效力已经在工业化国家和拉丁美洲部分发展中国家得到证实。在国外Ⅲ期临床试验中,给予3剂RV5,预防任何血清型导致的任何程度RVGE、重度RVGE的保护效力分别为71.8%、98%。中国Ⅲ期临床数据显示,完成3剂次RV5接种预防任何血清型导致的任何程度RVGE、重度RVGE的效力分别为69.3%、95.5%。在欧洲和美洲一些国家大规模接种RV5后,2岁以内幼儿的腹泻就诊率减少86%、腹泻急诊率减少94%、因RVGE住院率减少96%[96]。
基于目前已发表文献,未见RV1上市前Ⅲ期临床试验保护效力的数据,只有对于上市后保护效果的评估。广州市、正定市和北京市进行的三项病例对照研究显示,接种1剂及以上RV1对预防任何程度RVGE的保护效果为35%,对重度RVGE的保护效果为52%~88%[97]。在中国一项对3 550名0~5岁儿童接种国产RV1的研究结果显示,该国产RV1可诱导机体产生G1、G4 型血清中和抗体,保护率为68%[98]。
RV1主要用于2月龄至3岁婴幼儿,每年应服一次。RV5接种对象为6~32周龄婴幼儿,全程免疫共3剂,6~12周龄开始口服第1剂,每剂接种间隔4~10周;第3剂接种不应晚于32周龄。
RV1开启瓶盖,用吸管吸取本疫苗,直接喂于婴幼儿,用量为每人一次3 ml。RV5仅限口服,不能用于注射,每支2 ml,用量为每人一次2 ml。
有如下情况者不得接种疫苗:对该疫苗所含任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者。
一过性轻度呕吐和腹泻,一过性发热。
重度发热,持续呕吐、腹泻超过3 d或腹泻超过5 次/d。
过敏性皮疹、过敏性休克、过敏性紫癜和肠套叠。
水痘由水痘-带状疱疹病毒(varicella zoster virus,VZV)感染引起。VZV属于疱疹病毒科,仅有一个血清型。VZV对外界抵抗力弱,不耐热和酸,不能在痂皮中存活,能被乙醚等消毒剂灭活。人是VZV唯一的自然宿主[102]。
1997年进口水痘减毒活疫苗(varicella attenuated live vaccine,VarV)在中国上市,2000年后多个国产VarV陆续上市,采用与国外一致的Oka株。目前中国使用的VarV均为国产,除天津市、上海市、苏州市、青岛市、广州市等地区将VarV纳入免疫规划外,大部分地区仍将VarV作为非免疫规划疫苗实施自愿接种。
国外研究显示,接种1剂次VarV后,85%~89%的受种者达到保护性抗体水平;接种2剂次后,>99%的受种者达到保护性抗体水平。首次接种后无论是间隔3个月还是3~5年接种第2剂,均可诱导体液免疫的显著增强[57]。
2012年一项中国儿童接种1剂次VarV获得的免疫原性系统评价显示,6个FAMA法研究的合并抗体阳转率为95.77%,抗体GMT为1∶38.07;5个ELISA法研究的合并抗体阳转率为85.21%,GMT为1∶831.79[109]。一项国产VarV在初次免疫不同间隔期后加强免疫的免疫原性研究显示,1~7岁的儿童初次免疫后1、3、5年接种第2剂VarV后抗体水平显著升高,血清抗体阳转率均为100%,GMT分别为1∶84.82、1∶40.65、1∶47.03[110]。
无VarV免疫史的1~12岁儿童接种2剂次VarV,分别为12~18月龄、3~4岁各接种1剂次。未完成接种的目标儿童,尽快补齐2剂次,接种间隔不少于3个月。≥13岁人群接种2剂次VarV,接种间隔4~8周(仅适用提供≥13岁接种程序的疫苗)。
上臂外侧三角肌下缘附着处皮下注射。每1剂次人用剂量为0.5 ml。
已知对VarV所含任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;妊娠期妇女;免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者;患先天性免疫病或密切接触的家庭成员中有先天性免疫疾病史者;未控制的脑病、癫痫和其他进行性神经系统疾病者。
全国AEFI监测数据表明,VarV具有良好的安全性,不良反应报告发生率在预期范围内,主要以发热和过敏性皮疹为主,绝大多数病例均治愈或好转[115]。
十分常见:发热。常见:接种部位发红、肿胀、瘙痒、疼痛、硬结;全身不良反应有腹泻、皮疹、哭闹、嗜睡、厌食、头痛、乏力。
重度发热。
过敏性皮疹、过敏性休克、过敏性紫癜、血小板减少性紫癜。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女。
注射免疫球蛋白者应至少间隔3个月以上接种VarV,以免影响免疫效果;育龄妇女注射VarV后应至少避孕3个月;在接种VarV后6周内避免使用水杨酸盐类药物。
带状疱疹是潜伏在人体感觉神经节的水痘-带状疱疹病毒(varicella-zoster virus,VZV)再激活后所引起的以皮肤损害为主的疾病。VZV属疱疹病毒科,仅有一个血清型。VZV对外界抵抗力弱,不耐热和酸,不能在痂皮中存活,能被乙醚等消毒剂灭活。人是已知自然界中的唯一宿主[102]。
带状疱疹发病时会出现沿某一周围神经区域呈带状排列的成簇水疱,多发生在身体的一侧,并伴有局部剧烈疼痛[116]。极罕见的情况下可能导致肺炎、听力障碍、失明、脑炎或死亡。带状疱疹最常见的并发症是带状疱疹后神经痛(postherpetic neuralgia,PHN)。即使在皮疹消失后,神经痛也会发生在带状疱疹出现的区域,可能持续数月或数年[117]。
带状疱疹是皮肤科常见病,一般认为带状疱疹主要不是通过外源性感染,而是婴幼儿期患水痘后病毒潜伏性感染的再激活所致。带状疱疹常出现在年龄较大、免疫抑制或免疫缺陷的人群中,疾病痊愈后仍可复发,复发率为1%~6%[116]。研究证实,带状疱疹发病率与年龄增加紧密相关,全球普通人群、60岁人群、80岁人群带状疱疹发病率分别为每1 000人年3~5例、6~8例、8~12例[116,118]。带状疱疹的严重性也随年龄增长而增加,表现为随年龄增加PHN发生率增加、持续时间延长和其他并发症增多[116, 117, 118]。一项调查结果显示,中国每年新增带状疱疹患者约277万例[119]。
目前中国使用的带状疱疹疫苗为进口的重组带状疱疹疫苗(recombinant zoster vaccine,RZV)(CHO细胞),属于非免疫规划疫苗。
针对VZV的T细胞介导的免疫应答(VZV-T cell-mediated immunity,VZV- CMI)是维持病毒潜伏和预防带状疱疹的充分必要条件[120]。两项关键Ⅲ期临床研究的事后分析结果显示,97.8%的 RZV受试者和2.0%的安慰剂受试者表现出体液免疫应答;93.3%的RZV受试者和0.0%的安慰剂受试者表现出细胞免疫应答[121]。
全球18个国家和地区入组超过3万名受试者的两项关键Ⅲ期临床试验对≥50岁和≥70岁人群的疫苗效力进行评估,受试者以1∶1的比例随机接受疫苗或生理盐水安慰剂[122, 123]。结果显示,RZV在≥50岁人群中产生的保护效力为97.2%(95%CI:93.7%~99.0%),50~59岁和60~69岁年龄组人群中保护效力无显著性差异;在≥70岁人群中产生的保护效力为91.3%(95%CI:86.8%~94.5%),且疫苗接种4年内一直保持高水平保护效力。
长期随访研究表明,RZV诱导的免疫原性在首次疫苗接种后至少10年仍高于疫苗接种前水平。10年后体液免疫水平是接种前的6.0倍,细胞免疫水平是接种前的3.5倍。基于10年的观察数据建立数学模型,预测免疫原性在20年后仍高于接种前水平[124]。
RZV(CHO细胞)接种对象为≥50岁成年人,适用于预防带状疱疹,不适用于预防原发性水痘。
接种两剂,第2剂与第1剂间隔2个月接种。如需改变免疫程序,第2剂在第1剂后2~6个月之间接种。
首选接种部位为上臂三角肌肌内注射,每剂0.5 ml。
对疫苗中任一活性成分或辅料成分过敏者禁用。
常见的全身反应包括肌痛、疲乏、头痛、发热(≥37.5 ℃)、寒颤、胃肠道症状(恶心、呕吐、腹泻和腹痛)等;局部反应包括注射部位疼痛、发红、肿胀。大部分不良反应为轻至中度,且1~3 d可自行缓解。
包括血管性水肿、皮疹、荨麻疹等超敏反应。由于这些事件为规模不详人群的自发报告,因此不一定能够可靠地估计其发生率或确定其与疫苗之间的因果关系。
血小板减少症患者或任何凝血功能紊乱患者。
临床数据显示,具有带状疱疹史的个体接种RZV后能够产生并维持较高的免疫应答。2剂次疫苗接种1个月后有90.2%(95%CI:81.7%~95.7%)的受试者产生免疫应答[125]。
免疫功能低下人群是带状疱疹的高危人群,该人群接种带状疱疹疫苗具有重要意义。临床试验结果显示,受试者在自体造血干细胞移植后50~70 d接种RZV可以产生68.2%(95%CI:55.6%~77.5%)的保护效力[126];肾移植后4~18个月[127]、血液系统恶性肿瘤正在接受或已经完成免疫抑制治疗[128]、实体瘤正在接受或准备接受免疫抑制治疗[129]和HIV感染[130]的受试者接种RZV后均达到了主要免疫原性目标。
不能确定妊娠期和哺乳期接种RZV存在的相关风险,因此妊娠期和哺乳期妇女应避免接种。
人乳头瘤病毒(human papilloma virus,HPV)属乳头瘤病毒科,无包膜双链环状DNA病毒,由病毒蛋白衣壳和核心单拷贝的病毒基因组DNA构成。病毒衣壳由主要衣壳蛋白L1和次要衣壳蛋白L2组成,根据L1序列,目前HPV约有200种型别。
HPV呈高度组织特异性,可感染皮肤和黏膜的上皮细胞。根据HPV致癌性分为高危型HPV和低危型HPV,高危型HPV持续感染可引起子宫颈、阴道、外阴、肛门、阴茎、头颈等部位的癌前病变,病变可最终发展为浸润性癌;高危型HPV包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68。子宫颈癌主要由高危型HPV持续感染所致,在99.7%的子宫颈癌中都可检测到高危型HPV[134];高危型HPV的E6和E7蛋白在子宫颈癌组织内持续表达,是致癌的关键分子[135]。不同型别的高危型HPV致癌性不同[136],HPV16致癌性最强,其次是HPV18、31、33。低危型HPV感染可引起皮肤疣、肛门-生殖器疣和复发性呼吸道乳头状瘤等疾病,大约90%的肛门-生殖器疣由HPV6、11引起[137]。
高危型HPV持续感染引起的最常见疾病是下生殖道和肛周的上皮内病变,包括低级别和高级别病变。其中,子宫颈、阴道、外阴和肛周的高级别上皮内病变是恶性肿瘤的癌前病变。高级别病变未及时诊治,有可能导致相应部位肿瘤的发生。低危型HPV 持续感染会引起上述部位的良性病变、生殖器疣的发生。
HPV的传染源是患者和病毒感染者,传播途径主要为性途径传播、其次为母婴传播和皮肤黏膜接触传播。性生活过早、多性伴、吸烟、长期口服避孕药等是HPV感染的主要危险因素。HPV感染率高低主要取决于人群的年龄和性行为习惯,年轻的性活跃女性子宫颈部位HPV感染率最高,感染高峰年龄在20岁左右,第二个HPV感染高峰在40~45岁左右。
据WHO/国际癌症研究署(International Agency for Research on Cancer,IARC)2018 年数据显示,高危型HPV感染与全球约4.5%的癌症新发病例相关(约63 万例),其中女性57万例、男性6万例[138]。HPV对子宫颈癌的归因危险度百分比可达到100%[139, 140],而且全球每年由HPV导致的癌症中子宫颈癌所占比例最高,约占83%[141]。中国也面临着严峻的子宫颈癌疾病负担,据估计,2018年中国子宫颈癌新发病例近11万例,死亡近5万例,分别约占全球发病和死亡总数的20%和16%;且近年来发病率和死亡率呈现上升趋势。虽然HPV感染型别分布在不同地区、不同人群、不同级别子宫颈病变中有差别,但随着病变严重程度的升高,HPV16、18的比例显著升高;此外,与其他国家和地区相比,HPV52和58在亚洲人群中更为常见,研究表明,2级及以上子宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)HPV阳性妇女有24.1%归因于HPV33、52、58感染[142]。
中国已上市使用的HPV疫苗信息见表1。
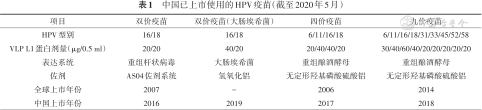
中国已上市使用的HPV疫苗(截至2020年5月)
中国已上市使用的HPV疫苗(截至2020年5月)
| 项目 | 双价疫苗 | 双价疫苗(大肠埃希菌) | 四价疫苗 | 九价疫苗 |
|---|---|---|---|---|
| HPV型别 | 16/18 | 16/18 | 6/11/16/18 | 6/11/16/18/31/33/45/52/58 |
| VLP L1蛋白剂量(μg/0.5 ml) | 20/20 | 40/20 | 20/40/40/20 | 30/40/60/40/20/20/20/20/20 |
| 表达系统 | 重组杆状病毒 | 大肠埃希菌 | 重组酿酒酵母 | 重组酿酒酵母 |
| 佐剂 | AS04佐剂系统 | 氢氧化铝 | 无定形羟基磷酸硫酸铝 | 无定形羟基磷酸硫酸铝 |
| 全球上市年份 | 2007 | - | 2006 | 2014 |
| 中国上市年份 | 2016 | 2019 | 2017 | 2018 |
中国9~45岁女性按照0、1、6个月的免疫程序接种3剂双价HPV疫苗1个月后,HPV16、18抗体阳转率可达99.4%~100%[143];9~17岁女性接种后的抗体浓度是18~25岁女性的2~3倍[143]。
中国9~45岁女性按照0、1、6个月免疫程序接种3剂疫苗后1个月,HPV16、18抗体阳转率均为100%,且9~17岁人群的抗体浓度均高于18~26岁人群[144, 145]。9~14岁人群按照0、6个月接种2剂疫苗后HPV16、18血清抗体阳转率均为100%[145]。
双价HPV疫苗在中国的疫苗上市前临床试验研究中显示出良好的保护效力[151]。在18~25岁HPV16、18中和抗体和DNA检测均阴性且完成3剂次疫苗接种的女性人群中,疫苗对HPV16、18相关的CIN1+和CIN2+的保护效力分别为93.2%(95%CI:56.1%~99.8%)和87.3%(95%CI:5.3%~99.7%);对6个月和12个月持续性感染的保护效力分别为96.3%(95%CI:85.9%~99.6%)、96.9%(95%CI:81.1%~99.9%)。
在18~45岁HPV16、18中和抗体和DNA检测均阴性且完成3剂次疫苗接种的中国女性中,疫苗预防HPV16、18相关的CIN2/3、原位腺癌(adenocarcinoma in situ,AIS)或宫颈癌的保护效力为100%(95%CI:55.7%~100%),预防6个月和12个月持续感染的效力分别为97.7%(95%CI:86.2%~99.9%)和95.3%(95%CI:70.7%~99.9%)[145]。
在20~45岁HPV6、11、16、18中和抗体和DNA检测均阴性且完成3剂次疫苗接种的中国女性中开展的临床试验显示[152],对HPV6、11、16、18相关的CIN1、2、3、AIS和子宫颈癌的保护效力为100%(95%CI:70.9%~100%);对HPV6、11、16、18相关的6个月和12个月子宫颈持续性感染的保护效力分别为91.6%(95%CI:66.0%~99.0%)、97.5%(95%CI:85.1%~99.9%),对HPV6、11、16、18相关的子宫颈细胞学异常的保护效力为94.0%(95%CI:81.5%~98.8%)。
疫苗上市后在真实世界中预防癌症的效果需要数十年才能观察到,中国尚缺乏疫苗在真实世界使用的效果数据。
最新发表的系统综述显示,HPV疫苗接种后5~8年,13~19岁和20~24岁女性中HPV16、18感染率分别下降83%和66%,13~19岁女性中HPV31、33、45感染率也显著下降54%。15~19岁、20~24岁和25~29岁女性中生殖器疣发病率分别下降67%、54%和31%。15~19岁和20~24岁男性中生殖器疣发病分别下降48%和32%。疫苗接种后5~9年,15~19岁和20~24岁筛查的女性中CIN2+发生率分别下降51%和31%。疫苗在年轻人群中的效果均优于年长人群[153]。
接种HPV疫苗的最终目标是通过预防主要致癌类型HPV感染进而达到预防浸润性子宫颈癌的发生。2020年一项瑞典近170万10~30岁女性的真实世界研究数据显示,与未接种人群相比,至少接种1剂四价HPV疫苗的女性浸润性子宫颈癌发病率在<17岁和17~30岁女性中分别下降88%和53%[154]。
最新研究结果显示,4种HPV疫苗均表现出较好的免疫持久性和长期保护效果,研究对象双价[155]和四价[135]HPV疫苗接种后12年、九价[149]HPV疫苗接种后7.6年、国产双价HPV疫苗[145]接种后5年疫苗相关型别抗体阳性率仍>90%,且未发现HPV疫苗型别相关癌前病变。疫苗的免疫持久性仍需继续观察。
HPV疫苗在国内外上市前临床试验中表现出良好的安全性,4种HPV疫苗的不良反应以局部反应为主,多表现为一过性轻至中度症状,常见局部反应包括疼痛、发红和肿胀,全身反应主要有发热、头痛、眩晕、肌肉痛、关节痛和胃肠道症状(恶心、呕吐、腹痛)等[145,151, 152,156, 157]。
全球其他国家在上市后安全性监测中有吉兰-巴雷综合征[158, 159]、复杂性区域疼痛综合征、体位性心动过速综合征等疾病的报告[160, 161, 162, 163],但尚未发现HPV疫苗接种与这些罕见疾病存在因果关系。此外,HPV疫苗在与其他疫苗同时接种[139,164],或用于自身免疫性疾病患者[165, 166, 167]、HIV感染者[168, 169]、妊娠妇女[170, 171]等人群中也未发现安全性风险增加。
WHO立场文件建议,由于子宫颈癌和其他HPV相关疾病是全球重要公共卫生问题,对未开始性生活的女孩进行HPV疫苗接种,将获得最佳的预防效果[172]。
适用于9~45岁女性。推荐于0、1和6月分别接种1剂次,共接种3剂。第2剂可在首剂后1~2.5个月之间接种,第3剂可在首剂后5~12个月之间接种。
适用于9~45岁女性。推荐9~14岁女性0、6月分别接种1剂次,间隔≥5个月,共接种2剂次。15~45岁女性0、1和6月分别接种1剂次,第2剂可在首剂后1~2个月内接种,第3剂可在首剂后5~8个月内接种,共接种3剂次。
四价HPV疫苗适用于9~45岁女性,九价HPV疫苗适用于16~26岁女性。推荐于0、2和6月分别接种1剂次,共接种3剂。首剂与第2剂的接种间隔至少1个月,第2剂与第3剂的接种间隔至少为3个月,所有3剂应在1年内完成。
上臂三角肌肌内注射,每剂次接种0.5 ml。
对疫苗的活性成分或任何辅料成分过敏者禁用;注射疫苗后发生过敏者不应再次接种疫苗。
常见的局部不良反应包括接种部位疼痛、发红和肿胀。常见全身不良反应包括发热、头痛、头晕、肌肉痛、关节痛和胃肠道症状(恶心、呕吐、腹痛等)[172]。
偶见注射部位硬结、局部感觉异常、超敏反应、皮疹等症状。
在上市后大规模人群接种监测中有吉兰-巴雷综合征、复杂性区域疼痛综合征、体位性心动过速综合征等不良事件,但全球疫苗安全咨询委员会仔细评估分析后认为,并无相关证据表明HPV疫苗与这些事件有明确因果关系。
在受种者患有急性严重发热疾病时应推迟接种HPV疫苗,仅有低热和轻度的上呼吸道感染并非接种的绝对禁忌;受种者为血小板减少症患者或者任何凝血功能紊乱患者时应谨慎使用。
(1)接种HPV疫苗前3个月内避免使用免疫球蛋白或血液制品。(2)妊娠期间应避免接种HPV疫苗。若女性已经或准备妊娠,建议推迟或中断接种程序,妊娠期结束后再进行接种。哺乳期妇女应谨慎接种HPV疫苗。HIV感染者和免疫力低下人群接种HPV疫苗可能无法诱导正常的免疫应答。(3)接种HPV疫苗不能取代常规子宫颈癌筛查。(4)不同厂家HPV疫苗不能互换使用[173]。
狂犬病病毒属于单股负链病毒目、弹状病毒科、狂犬病病毒属。至少有14种狂犬病病毒,根据遗传距离和血清学交叉反应特性将其分为两个遗传系谱。狂犬病病毒是一种不分节段、有包膜的RNA病毒,属于遗传系谱I[174]。基因组编码5种蛋白质,构成病毒颗粒的功能和结构成分。核糖核蛋白复合物是病毒复制和蛋白质翻译的必需成分,它包括与核酸结合的核蛋白(N)、依赖RNA的RNA聚合酶(L)和磷蛋白(P)。基质蛋白(M)和糖蛋白(G)与宿主细胞的脂质包膜相连接形成与宿主细胞受体结合的结构。这些病毒蛋白质中最重要的是G蛋白。G蛋白包含狂犬病疫苗诱导的抗体和免疫球蛋白(RIG)的靶向抗原位点[175]。
现代细胞培养和禽胚狂犬病疫苗(cell culture and embryonated egg-based rabies vaccine,CCEEV)是免疫原性较强的疫苗之一,对预防狂犬病非常有效[183]。CCEEV包含经禽胚(例如鸭胚或鸡卵)或细胞培养(例如原代鸡胚细胞、Vero细胞或人二倍体细胞)培养后灭活的狂犬病病毒。在Ⅱ级或Ⅲ级暴露于实验室确认的狂犬病动物后,暴露后预防的有效性可通过对CCEEV诱导的抗体水平进行评估。动物模型已被用于证明人工感染后CCEEV的效力[184]。所有CCEEV能对狂犬病病毒的G蛋白迅速诱导高水平的中和抗体[183]。
WHO规定的最低血清抗狂犬病中和抗体浓度为0.5 IU/ml,该浓度被广泛用作衡量接种疫苗后血清转化是否充分的标准。在大多数个体中,无论年龄、营养状况、是否同时使用狂犬病免疫球蛋白,在暴露后完成狂犬病疫苗免疫程序的第7~14 d,血清中和抗体浓度均可达到0.5 IU/ml。在接种后7 d出现中和抗体,接种14 d抗体阳转率达100%[185]。多项血清学研究显示,与狂犬病疫苗5剂次免疫程序相比,“2-1-1”免疫程序第7天抗体阳转率和血清抗体水平均更高,接种后14 d和42 d抗体水平无显著性差异[186, 187, 188]。中国国产纯化人Vero细胞狂犬病疫苗按照0、7、21 d各1剂次的程序进行暴露前免疫的研究显示,受试者血清中和抗体阳转率为100%[189]。
WHO 2018年版《狂犬病疫苗立场文件》中指出[190],不同种类狂犬病疫苗的安全性和耐受性整体较好。不良反应的出现与狂犬病疫苗的纯度、制备工艺、处方成分和剂型有关,并可能与产品各批次间的差异相关。此外,疫苗的使用方式(如肌内注射或皮内注射)和受种者的个体差异也有影响。据统计,35%~45%的受种者接种部位出现一过性轻微红疹、疼痛和/或红肿,在接种加强剂次时尤为显著。5%~15%的受种者曾观察到一过性发热、头痛、头晕、胃肠道症状等轻微全身不良反应,过敏、神经系统症状等严重不良反应罕见。
基础免疫:第0、7和21(或28)天分别接种1剂,共接种3剂。加强免疫:接触狂犬病病毒的实验室人员每6个月监测1次血清中和抗体水平,兽医、动物疫情控制部门等每2年监测1次血清中和抗体水平;当血清中和抗体浓度<0.5 IU/ml时需加强接种1剂。
WHO 2018年版《狂犬病疫苗立场文件》推荐暴露后采用“简易4剂次程序”,在安全性和有效性方面证据充分。中国人用狂犬病疫苗质量标准均符合WHO要求,采用“简易4剂次程序”不会降低保护效果,因此中国国家免疫规划专家咨询委员会(NIAC)推荐暴露后狂犬病疫苗的免疫程序包括:①5剂次程序:第0、3、7、14、28天各接种1剂,共接种5剂;②“2-1-1”程序:第0天接种2剂(左右上臂三角肌各接种1剂),第7天和第21天各接种1剂,共接种4剂(此程序只适用于中国已批准可以使用“2-1-1”程序的狂犬病疫苗);③简易4剂次程序:第0、3、7、14天各接种1剂,共接种4剂。
狂犬病暴露按照暴露性质和严重程度分为三级。在判定暴露级别后,应根据需要尽早进行伤口处理;在告知暴露者狂犬病危害和应当采取的处置措施并获得知情同意后,采取相应处置措施(表2)[175, 176,190, 191, 192]。

狂犬病暴露后免疫预防处置
狂犬病暴露后免疫预防处置
| 暴露级别 | 接触方式 | 暴露程度 | 暴露后免疫预防处置 |
|---|---|---|---|
| Ⅰ级 | 接触或喂养动物;完整皮肤被舔舐;完好的皮肤接触狂犬病动物或人狂犬病病例的分泌物或排泄物 | 无 | 确认接触方式可靠则不需处置 |
| Ⅱ级 | 裸露的皮肤被轻咬;无出血的轻微抓伤或擦伤 | 轻度 | 处理伤口;接种狂犬病疫苗 |
| Ⅲ级 | 单处或多处贯穿皮肤的咬伤或抓伤;破损的皮肤被舔舐;开放性伤口或黏膜被唾液污染(如被舔舐);暴露于蝙蝠 | 严重 | 处理伤口;注射狂犬病被动免疫制剂(抗狂犬病血清/狂犬病病例免疫球蛋白);注射狂犬病疫苗 |
(1)狂犬病疫苗:≥2岁儿童和成人在上臂三角肌肌内注射;<2岁儿童可在大腿前外侧肌注射。禁止在臀部肌内注射。每剂0.5 ml或1.0 ml。(2)狂犬病被动免疫制剂:严格按照体重计算剂量,一次性足量使用。
当患者需要狂犬病疫苗与破伤风疫苗同时接种时,应在左右上臂三角肌内接种,如同侧接种,则需要间隔2.5 cm以上。
狂犬病为致死性疾病,暴露后狂犬病疫苗使用无任何禁忌,但接种前应充分询问受种者个体基本情况(如有无严重过敏史、其他严重疾病等)。即使存在不适合接种疫苗的情况,也应在严密监护下接种疫苗。如受种者对某品种疫苗的成分有明确过敏史,应更换无该成分的疫苗品种。
(1)局部反应:接种疫苗后24 h内,注射部位可出现红肿、疼痛、发痒,一般不需处理即可自行缓解。(2)全身性反应:可有轻度发热、无力、头痛、眩晕、关节痛、肌肉痛、呕吐、腹痛等,一般不需处理即可自行消退。
(1)中重度发热:可先采用物理降温方法,必要时可以使用解热镇痛剂。(2)过敏性皮疹:接种疫苗后72 h内出现荨麻疹,应及时就诊,给予抗过敏治疗。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期、妊娠期妇女。
抗狂犬病血清或狂犬病病例免疫球蛋白不得与疫苗使用同一支注射器,不得在同侧肢体注射。使用皮质类固醇或免疫抑制剂治疗时可干扰抗体产生,并导致免疫接种失败。由于狂犬病是致死性疾病,无需注意与其他疫苗的接种间隔。暴露后免疫应遵循及时、足量、全程的原则,发生过敏者,可到医院就诊,进行抗过敏治疗,完成全程疫苗的注射。妊娠妇女几乎均能对狂犬病疫苗产生正常的免疫应答,且对胎儿不会造成不良影响[199]。
肾综合征出血热由汉坦病毒属的各型病毒引起。汉坦病毒属布尼亚病毒科,为负性单链RNA病毒。根据其抗原结构不同,汉坦病毒至少可分20多个血清型,其中Ⅰ、Ⅱ、Ⅲ型和多布拉伐病毒-贝尔格莱德病毒(DOBV)可引起人类肾综合征出血热,通常Ⅰ型和DOBV引起人类疾病的临床症状较重,Ⅱ型次之,Ⅲ型多为轻型。中国流行以Ⅰ型和Ⅱ型病毒为主[102]。
肾综合征出血热潜伏期为4~46 d,一般为7~14 d。典型病例病程包括发热期、低血压休克期、少尿期、多尿期和恢复期的五期经过,但非典型病例明显增加。轻型病例可出现越期现象,重症患者则可出现发热期、休克期和少尿期之间的互相重叠[102]。
建议肾综合征出血热疫区的居民和进入该地区的人员接种,主要对象为16~60岁高危人群。按0、14 d进行基础免疫接种2剂次,第6个月后加强接种1剂次[206]。
上臂外侧三角肌肌内注射,每剂次1.0 ml。
已知对该疫苗所含任何成分包括辅料和抗生素过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;患未控制的癫痫和其他进行性神经系统疾病者;妊娠及哺乳期妇女。
接种部位可出现局部疼痛、瘙痒、轻微红肿等,全身反应可有轻度发热、不适、疲倦等,一般不需处理可自行消退。
短暂中度以上发热,应采用物理方法或药物对症处理,以防高热惊厥或继发其他疾病。局部中度以上红肿,一般3 d内即可自行消退,不需任何处理,适当休息即可恢复正常;反应较重的局部红肿可用干净毛巾热敷,每天数次,每次10~15 min可助红肿消退。
(1)过敏性皮疹:一般接种疫苗后72 h内出现荨麻疹,及时就诊,给予抗过敏治疗。(2)过敏性休克:一般接种疫苗后1 h内发生,应及时采取注射肾上腺素等抢救措施进行治疗。(3)过敏性紫癜:出现过敏性紫癜时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。(4)周围性神经炎:应及时就诊。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
注射免疫球蛋白应至少间隔1个月以上接种疫苗,以免影响接种效果。
钩端螺旋体病是由致病性钩端螺旋体(钩体)引起的动物源性传染病。
钩体呈细长丝状,菌体的一端或两端弯曲成钩状,为革兰染色阴性、需氧型原核微生物。电镜下钩体结构包括圆柱形菌体、轴丝(又称鞭毛)和外膜3部分,外膜具有抗原性和免疫原性,其相应抗体为保护性抗体[102]。目前国际上将致病性钩体至少分为25个血清群、273个血清型,其中中国至少存在有19个血清群、75个血清型[207]。钩体的型别不同,其毒力和致病性也不同,某些钩体的细胞壁含有内毒素样物质,有较强的致病作用[102]。
钩体病的潜伏期为2~28 d,多为7~14 d。表现为急性起病,起病1~3 d早期表现为发热和全身感染中毒症状,全身酸痛,腓肠肌疼痛与压痛,腹股沟淋巴结肿大;起病后3~10 d为中期,为症状明显阶段,并发有肺出血、黄疸、肾损害、脑膜脑炎;起病后10 d为后期,多数患者热退之后各种症状逐渐消失趋于痊愈,少数患者退热后于恢复期可再次出现症状和体征(如后发热、眼后发症、反应性脑膜炎、闭塞性脑动脉炎等)[102]。
目前中国钩体疫苗通常选择当地主要流行菌型的钩体菌株,经培养、杀菌后,制成单价或多价疫苗[210],并推荐在发生钩体病疫情或发生洪涝灾害可能导致钩体病暴发流行时,对重点人群进行应急接种。
钩体外膜的脂多糖是钩体灭活疫苗的主要成分,具有较强的免疫原性和保护性,可诱发机体产生体液免疫应答而发挥作用[211]。国内研究研究数据发现数据显示,两价和多价外膜疫苗和菌体疫苗免疫后1个月和3个月时,各型抗体阳转率达到89.19%~100%,免疫后3个月时,各型抗体阳转率有不同程度的下降[212]。国内外研究数据显示,钩体抗体滴度在1∶10~1∶100即有保护作用,国内文献数据也发现抗体滴度≥1∶20是保护人体不发病的最低滴度[213]。在钩体病4月底或5月初流行前1个月对易感人群完成接种,接种后约1个月产生免疫力,该免疫力可保持1年左右[102]。
对自1986年以来在荆州地区开展的钩体疫苗预防接种进行的效果评价显示,钩体疫苗保护率达85.34%~100%,效果指数(对照组发病率/接种组发病率)达6.82~36.59[214]。
全程共接种2剂次,间隔7~10 d。
流行地区内有可能接触疫水或动物的7~60岁人群。
上臂外侧三角肌下缘附着处皮下注射;成人第1剂次注射0.5 ml,第2剂次注射1.0 ml;7~13周岁用量减半,必要时7周岁以下儿童可酌量注射,但不超过成人剂量的1/4;应在流行季节前完成注射。
已知对该疫苗的任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;妊娠期和哺乳期妇女;患脑病、未控制的癫痫和其他进行性神经系统疾病者。
接种后可出现短暂发热,注射部位可出现疼痛、触痛和红肿,多数情况2~3 d内自行消退。
出现过敏性皮疹应及时就诊。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
注射免疫球蛋白者应至少间隔1个月以上接种疫苗,以免影响免疫效果;月经期妇女暂缓注射。
炭疽杆菌是革兰阳性需氧粗大杆菌,有芽孢,无动力,菌体较大。芽孢有很强的抵抗力,可在动物尸体和土壤中存活数年至数十年。细菌的繁殖体对热和普通消毒剂非常敏感。
炭疽杆菌侵入机体的途径不同,潜伏期亦有差异,皮肤炭疽一般为1~5 d,也可短至数小时,长至2周左右。皮肤炭疽最多见,首先出现暴露皮肤(面、颈、肩、手和脚等)发痒,以后出现斑疹或丘疹,然后形成黑色焦痂;如果不进行治疗,易发展为严重的败血症。肺炭疽较少见,通常是致死性的而且诊断困难;病初有短期非特异流感样表现,可发生休克并在24 h内死亡,常并发败血症和脑膜炎。肠道炭疽极罕见,易并发败血症休克而死亡。炭疽败血症的全身毒血症状更为严重,如高热、寒战、衰竭;易发生感染性体克、弥漫性血管内凝血、脑膜炎等,病情迅速恶化而死亡。
炭疽的传染源主要为患病的草食动物,如牛、羊、马和骆驼等,其次是猪和狗。人与人之间的传播极少见,炭疽患者作为传染源意义不大。人类炭疽主要通过接触传播,常因肢体直接接触病畜或污染的畜产品、土壤、用具等感染。通过呼吸道吸入带芽孢的粉尘或气溶胶可引起肺炭疽;进食被炭疽杆菌污染的肉类和乳制品可引起肠炭疽;吸血昆虫、牛虻等叮咬病畜后,再叮咬人类,亦可能传播炭疽,但较少见。人群对炭疽杆菌普遍易感,特别是参与动物屠宰、制品加工、动物饲养、兽医等高危人群更易感染。病后可获得持久的免疫力。
目前中国使用皮上划痕人用炭疽减毒活疫苗,采用中国选育的A16R菌株生产[210]。
A16R菌株炭疽减毒活疫苗主要诱导体液免疫应答,而不能诱导有效的呼吸道和消化道黏膜免疫[217]。疫苗接种后1周开始产生免疫力,2周可达到保护水平,半年后开始下降,约可维持1年。
皮上划痕人用炭疽减毒活疫苗接种后的不良反应一般较轻微,接种后24 h内在划痕部位可出现疼痛和触痛,局部红肿浸润轻,多数情况2~3 d内自行消失。对出现不良反应者应注意观察,必要时给予适当对症治疗。
炭疽减毒活疫苗主要接种对象为牧民、兽医、屠宰牲畜人员、制革和皮毛加工人员、炭疽流行区的易感人群、参加防治工作的专业人员。发生炭疽疫情时,对病例或病畜间接触者和疫区周围高危人群接种1剂;对有感染危险者每年接种1次。
(1)接种前先将安瓿中的疫苗悬液充分摇匀,按无菌操作启开安瓿后,用灭菌注射器吸出疫苗。(2)于上臂外侧上部用75%乙醇棉球消毒皮肤,待干后于消毒部位滴疫苗2滴,相距3~4 cm。一手将皮肤绷紧,另一手持消毒划痕针在每滴疫苗处作“#”字划痕,每条痕长约1~1.5 cm,以划破表皮可见间断小血点为度。再用同一划痕针涂压10余次,使疫苗充分进入划痕皮肤。接种后局部应裸露5~10 min,然后用干棉球擦净。(3)接种后24 h划痕局部应有轻微红肿、浸润,若无任何反应(包括创伤反应),应重新接种。
已知对疫苗中任成分过敏者;患急性疾病、严重慢性疾病、慢性疾病急性发作期和发热者;免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者;妊娠期或6个月内哺乳期妇女;炭疽病例或病畜的直接接触者。
接种后24 h内在划痕部位可出现疼痛和触痛,局部红肿浸润轻,多数情况2~3 d内自行消失。接种后可出现一过性发热,其中大多数为轻度发热,持续1~2 d后可自行缓解,一般不需处理;对于中度发热或发热时间超过48 h者,可给予对症处理。
严重发热应给予对症处理,以防高热惊厥。
淋巴结肿大。
人用皮上划痕炭疽减毒活疫苗严禁作注射用;与抗生素同时使用时可能影响疫苗的免疫效果;注意保持划痕部位清洁卫生以避免感染。
注射免疫球蛋白者应至少间隔1个月以上才能接种炭疽减毒活疫苗。
戊型肝炎病毒(hepatitis E virus,HEV)呈球形,直径为30~32 nm,是包含有7.2 kb的单正链核糖核酸基因组的无包膜病毒,是肝病毒属的一种。病毒基因由一个短的5'端非编码区的帽子、3个彼此编码框架不同的开放阅读框(ORF)和一个由腺苷残基的支链作终点的短的3'端非编码区构成。其中,ORF1编码病毒非结构性蛋白,ORF2编码衣壳蛋白,ORF3编码一种可能与病毒从细胞中释放有关的小蛋白质。目前已发现4种以感染哺乳类为宿主的基因型,且属于同一种血清型。其中1型和2型只存在于人类,3型和4型在人类和猪中发现[57]。HEV在外环境中相对稳定,对热、氯化物和紫外线敏感[220]。
临床上不易对戊型肝炎(戊肝)及其他类型的病毒性肝炎予以区别。戊肝的潜伏期一般为15~60 d,平均40 d。HEV感染的严重程度从无症状感染到急性黄疸性肝炎,再到暴发性肝炎不等[220]。戊肝的主要临床表现包括疲倦、食欲减退、腹部疼痛和压痛、恶心、呕吐、发热和黄疸[57]。流行期间,暴发性戊肝在孕妇中呈不成比例的高病死率,一般人群戊肝病死率为0.1%~4%,而孕晚期孕妇中戊肝病死率可达10%~50%。已有慢性肝病的患者感染HEV后更易发展为重型肝炎,免疫抑制人群或由其他原因引起的严重免疫缺陷患者,感染HEV后具有发展为慢性戊肝的风险。
戊肝在世界范围内引起暴发或散发,全球每年戊肝发病数约340万例,死亡约7万例[220]。在发展中国家,HEV 1型和2型是戊肝的主要病原,主要影响青壮年(15~39岁)。中国是HEV高流行国家,自1997年戊肝纳入法定传染病报告以来,中国戊肝发病率逐年上升,不同地区差异显著。2017年中国戊肝报告发病数为29 014例,发病率为2.1/10万,其中以65~69岁年龄组发病率最高(2012-2017年为5.22/10万)[221]。2006年中国1~59岁人群HEV抗体阳性率为23.46%[222],2014年全国1~29岁人群HEV抗体阳性率为8.12%,高于部分发达国家(如美国、德国),低于某些欠发达国家(如孟加拉国)[223]。
2012年全球唯一批准使用的戊肝疫苗(hepatitis E vaccine,HepE)在中国上市。根据在16~65岁健康人群开展的Ⅲ期临床试验结果,该疫苗具有很高的免疫原性,按0、1、6个月间隔接种3剂后,几乎所有受试对象均出现了抗体阳转。其中疫苗接种组的IgG抗体浓度呈≥4倍升高者占98.7%,而对照组仅有2.1%。疫苗接种组IgG抗体几何平均浓度(geometric mean concentration,GMC)从0.14 WU/ml增长到19.0 WU/ml(95%CI:18.6~19.4 WU/ml)[220]。另对65岁以上老年人开展的疫苗安全性和免疫原性的最新研究显示,65岁以上老年人接种HepE同样具有良好的免疫原性,其中第3剂免疫后1个月的抗体阳转率为96.7%[224]。
接种对象为16岁及以上易感人群。重点推荐用于HEV感染的重点高风险人群,如畜牧养殖者、餐饮业人员、学生或部队官兵、育龄期妇女、疫区旅行者等。按“0、1、6月”接种程序共接种3剂次,第1剂接种后1个月接种第2剂,第1剂接种后6个月接种第3剂。
上臂三角肌肌内注射,接种剂量为30 μg/0.5 ml。
已知对该疫苗所含任何成分过敏者;有接种其他疫苗过敏史者;患血小板减少症或其他凝血障碍者;对卡他霉素或其他氨基糖甙类药物有过敏史者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;未控制的癫痫和患其他进行性神经系统疾病者。
大部分不良反应为接种部位的局部反应,如疼痛、红肿和发痒,全身反应常见为发热、疲倦无力和头痛。女性的局部和全身不良反应发生率高于男性。不同年龄组不良反应发生无规律性,61~65岁老年组不良反应发生率相对较低。未发现疫苗相关的严重不良反应。
严禁静脉注射。家庭和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者应慎用。注射免疫球蛋白者应至少间隔1个月以上接种本疫苗,以免影响免疫效果。对于孕妇和哺乳期妇女,目前尚无相关人群的研究数据,应充分权衡利弊后决定是否使用本品。
霍乱弧菌为革兰阴性杆菌,无侵袭性,有耐热的菌体(O)抗原和不耐热的鞭毛(H)抗原。根据菌体抗原不同可将霍乱弧菌分出200多个血清群,但仅有O1和O139血清群可引发霍乱流行,尚无证据表明这两个血清群之间具有交叉保护作用。O1群包括古典生物型和埃尔托生物型(ElTor)。O139群是1992年10月在印度和孟加拉国发现的引起霍乱流行的新变异株[227, 228],是埃尔托生物型的基因衍生株[229]。霍乱弧菌的致病力包括鞭毛运动、霍乱肠毒素、内毒素、黏蛋白溶解酶、黏附素、弧菌代谢产物和其他毒素[102]。
霍乱的潜伏期为1~3 d,多为急起发病,典型的临床表现是急性腹泻和剧烈呕吐,大多数以持续一天或几天的急性大量水样泻为特征。呕吐多在腹泻后出现,常为喷射性和连续性。由于频繁腹泻和呕吐,大量水和电解质丧失后患者会出现肾衰竭、代谢性酸中毒和低钾血症等并发症[230],如未予以治疗,可在24 h内死亡。
目前在中国上市使用的霍乱疫苗为重组B亚单位/菌体霍乱疫苗(肠溶胶囊),含重组霍乱毒素B亚单位与霍乱弧菌灭活菌体成分。
机体对霍乱的免疫保护主要是肠道分泌产生的抗菌、抗毒抗体作用的结果,接种霍乱毒素B亚单位-灭活霍乱弧菌全菌体 (BS-WC)疫苗可刺激产生抗菌和抗毒抗体,并刺激肠道产生分泌性IgA抗体[234, 235],观察显示口服霍乱疫苗是诱导产生这种抗体的最有效方式[236]。1993年6月到1994年1月对369人进行双盲法试验[237],采用高、低剂量重组霍乱毒素B亚单位-灭活霍乱弧菌全菌体(rBS-WC)疫苗免疫接种和安慰剂对照,接种后免疫组血清抗体和粪抗体阳转率、抗体水平均显著升高。1997年7月至1998年7月在广州军区、南京军区进行现场试验[238],将6 079人随机分为3组,采用双盲法分别接受高、低剂量rBS-WC疫苗和安慰剂,接种组83.4%~91.7%出现了抗体阳转,抗体阳转与另一项研究的结果相近[239]。霍乱疫苗对腹泻和产毒性大肠埃希菌感染也有交叉性保护作用[240]。
WHO立场文件中指出,接种霍乱疫苗后2年内可对霍乱提供显著的防护效力,在接种霍乱疫苗后第4~6个月、第1年和第2年所提供的保护效力分别为85%、62%和58%。
重组B亚单位/菌体霍乱疫苗(肠溶胶囊)用于≥2岁儿童、青少年和有接触或传播风险的成人。初次免疫者应接种3剂,分别于第0、7、28天口服,每次1粒,不能顺利吞咽的儿童可将疫苗与儿童用包装中附抗酸剂口服使用。接受过初次免疫的人员,可视疫情于流行季节前加强1次。
重组B亚单位/菌体霍乱疫苗的剂型为肠溶胶囊,供口服用,人用剂量为1粒/次,每粒胶囊装量240 mg,含灭活霍乱弧菌菌体5.0×1010个和重组霍乱毒素B亚单位1 mg。
发热、严重高血压、心/肝/肾脏病,艾滋病、活动性肺结核患者;孕妇和<2岁婴幼儿;已知对疫苗任何成分过敏或使用疫苗后发生不良反应者。
口服疫苗后一般无不良反应。常见不良反应主要以腹痛、腹泻等轻度胃肠功能障碍为主,也有部分出现荨麻疹等过敏反应和发热,不良反应呈一过性,持续时间较短,一般不需处理,短时间内即可自愈,如有严重不良反应,应及时诊治。
服苗后个别人发生头晕、头痛、乏力、恶心、心慌、便秘等,由于不良反应发生以主观陈述为主要依据,且在同时服苗的人群中有集中出现的现象,所以不能排除心因性反应的可能。所有发生的不良反应均在短时间内自愈,未出现严重不良反应[243, 244]。
目前尚无极罕见严重不良反应报告。
应于餐后2 h服苗,服苗后1 h勿进食;与抗酸剂配合使用时,服苗后1 h内勿服用饮料。服苗后2 d内忌食生冷、油腻、酸辣食品。疫苗在低温冻结后不能使用。疫苗胶囊经密封处理,裂开后不能使用。任何急性感染或发热性疾病患者需推迟口服疫苗,除非医生认为不服苗会导致更大危险。
其预防接种与免疫球蛋白使用的时间间隔无特殊要求。
伤寒是由肠道病原体伤寒杆菌引发的严重全身性感染[245]。伤寒杆菌属于肠道沙门菌肠道亚种伤寒血清型,无芽孢,有鞭毛,能运动,多数有菌毛,体外有荚膜多糖。为杆状、革兰阴性、需氧或兼性厌氧,营养要求不高。伤寒杆菌除H抗原外,还有菌体O抗原和Vi(毒力)荚膜抗原,具有诊断意义的是O抗原和H抗原[246]。
伤寒杆菌经摄入后可到达网状内皮系统并在巨噬细胞内繁殖[247]。在5~21 d潜伏期后,患者可出现乏力、头痛、腹痛和发热。大龄儿童和成人通常有便秘,而幼龄儿童可出现腹泻。以持续高热、全身痛、肝脾肿大、缓脉为主要体征,可出现玫瑰疹,严重者伴有脑功能障碍、谵妄和休克,偶有肠穿孔和出血。目前伤寒病例症状越来越不典型,发病周期和潜伏期长、易复发,且存在慢性带菌[248]。约1%~4%患者的其肠道和胆囊可继续携带伤寒杆菌达数月或数年(无症状带菌者)。
患者和带菌者是伤寒的传染源,带菌时间可达数年之久。伤寒杆菌仅感染人类,通常因摄入被伤寒患者或无症状带菌者排泄物污染的食物或水而感染。2015年起伤寒发病率≤0.65/10万[249]。人群普遍易感,高发年龄段为20~40岁,水型暴发多见,食物型暴发为10%~15%。伤寒总发病率呈逐年下降趋势,但每年仍有相当的发病数,小规模暴发流行时有发生。伤寒在许多发展中国家仍然是一个公共卫生问题,全世界每年伤寒患者约为2 100万人,死亡约20万人[250],约90%的死亡病例发生在亚洲。≤4岁伤寒患儿病死率(4.0%)是>4岁伤寒患儿病死率的10倍(0.4%),在未经治疗的病例中病死率可高达10%~20%[251]。
目前全球获准使用的伤寒疫苗包括伤寒结合疫苗(TCV)、伤寒Vi多糖疫苗(ViPS)和伤寒口服减毒活疫苗(Ty21a)。中国目前使用的是ViPS,国产伤寒全细胞灭活疫苗已不再使用。
伤寒Vi多糖疫苗可诱导非T细胞依赖性IgG应答,不能诱导肠黏膜免疫。伤寒Vi多糖疫苗在85%~95%的成人和2岁以上儿童中可诱导血清IgG Vi抗体应答。国产伤寒Vi多糖疫苗免疫1个月、6个月、12个月后抗Vi多糖抗体阳转率分别为98.36%、83.67%、83.67%[252]。江苏省2008年为810名5岁以上常住健康人群且无感染史和免疫史者接种伤寒Vi多糖疫苗,Vi抗体阳转率在85.96%~91.30%之间[253]。在中国西南部对13.1万名5~30岁人员接种剂量为30 μg的Vi多糖疫苗,接种19个月后69%的受种者具有保护力,第3年约50%仍有保护力[254]。
广西壮族自治区桂林市在1995-2006年期间每3年对学龄儿童、在校生、餐饮业者和暴发区居民复种一次伤寒Vi多糖疫苗,学生、其他目标人群平均接种率分别为60%~70%、80%~85%,总人群和学生的伤寒平均发病率从接种前的47/10万和61/10万,下降到2006年的0.2/10万~4.5/10万[254]。
伤寒Vi多糖疫苗用于≥2岁人群接种,接种1剂次。建议每3年复种一次。可与其他供国际旅行人员使用的疫苗(如黄热病疫苗和甲型肝炎疫苗)同时接种,也可与常规儿童免疫规划中的疫苗同时接种[257]。
上臂外侧三角肌肌内注射,每剂次接种0.5 ml。
已知对该疫苗的任何成分过敏者;患急性疾病、严重慢性疾病(严重心脏疾病、高血压、肝脏疾病、肾脏疾病)、慢性疾病急性发作期(活动性结核)和发热者;妊娠期妇女。
可出现短暂低热,局部稍有红肿、压痛感,有时有寒战、发热或头痛。一般可自行缓解,不需特殊处理。
过敏性皮疹一般在接种疫苗后72 h内出现,应及时就诊。
未发现。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女慎用。
伤寒Vi多糖疫苗不能用于<2岁儿童。多人份的伤寒Vi多糖疫苗开启后应立即使用,如需放置,应置2 ℃~8 ℃,并于1 h内用完,未用完者应废弃。
森林脑炎是由森林脑炎病毒所引起的急性中枢神经系统传染病,蜱为其传播媒介。森林脑炎病毒属于黄病毒科黄病毒属,为直径50 nm左右的球形颗粒,衣壳二十面体对称,外有包膜,含血凝素糖蛋白,核酸为单正链RNA,全长约10.7 kb,分子质量约为4×106 Da,沉降系数为218 S。
森林脑炎潜伏期为2~35 d,一般为10~15 d。前驱期一般数小时至3 d,部分患者和重型患者前驱期不明显。前驱期主要表现为低热、头晕、乏力、全身不适、四肢酸痛。大多数患者为急性发病,1~2 d内到高峰。急性期主要表现为发热、全身中毒症状、意识障碍和精神损害、脑膜受累、肌肉瘫痪、神经系统损害等。恢复期持续平均10~14 d,体温下降,肢体瘫痪逐步恢复,神志转清,各种症状消失。森林脑炎一般病程为14~28 d,少数患者可留有后遗症,如失语、痴呆、吞咽困难、不自主运动,少数病情迁延达数月或1~2年之久,表现为弛缓性瘫痪、癫痫和精神障碍。
森林脑炎是森林地区自然疫源性疾病,流行于中国东北和西北的原始森林地区、俄罗斯的远东地区和朝鲜北部林区。有严格的季节性,自5月上旬开始发病,6月高峰期,7-8月下降,呈散发状态。人群普遍易感,所有患者均有森林作业接触。
国内外研究结果显示,95%以上的受种者在接种完2剂次森林脑炎疫苗后,中和抗体滴度达免疫前的10倍以上[258, 259]。多数受种者,即使接种过1剂次森林脑炎疫苗,甚至在加强免疫前血清反应呈阴性的人,体内均有免疫记忆。
基础免疫后中和抗体GMT在第一年下降。加强免疫后,90%以上的受种者诱导的保护性抗体可维持3~5年[260, 261, 262]。受种者中发生“免疫保护突破病例”非常罕见,但有发生,特别是老年人中。
接种后不良反应一般轻微,个别有发热、头晕、皮疹、局部疼痛。对出现不良反应者应注意观察,必要时给予适当对症治疗。
在有森林脑炎发生的地区居住和进入该地区的8周岁以上人员,基础免疫为2剂次,于第0、14天各接种1剂次;以后可在流行季节前加强免疫1剂次。
上臂外侧三角肌肌内注射,每次接种1.0 ml。
发热、患严重疾病、慢性疾病急性发作期;患过敏性疾病、对卡那霉素或生物制品有过敏史者(由于生物制品制造工艺、残留物质均有其相似性,如接种者已经有其他生物制品过敏史,在接种本疫苗时应谨慎);哺乳期、妊娠期妇女。
注射部位可出现局部发痒、轻微红肿。全身可有轻度发热反应、不适、疲倦等,一般不需处理可自行消退。
短暂中度以上发热,应采用物理方法或药物对症处理,以防高热惊厥或继发其他疾病。局部中度以上红肿,一般3 d内即可自行消退,不需任何处理,适当休息即可恢复正常;反应较重的局部红肿可用干净的毛巾热敷,每天数次,每次一般10~15 min,可助红肿消退[263, 264, 265, 266]。
(1)过敏性皮疹:荨麻疹一般在接种疫苗后72 h内出现,应及时就诊,给予抗过敏治疗。(2)过敏性休克:一般在注射疫苗后1 h内发生。应采取及时注射肾上腺素等抢救措施。(3)过敏性紫癜:出现过敏性紫癜时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。(4)周围神经炎:应及时就诊。
家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
(1)由于疫苗中含有铝佐剂,使用时应充分摇匀,如出现摇不散的凝块、异物、疫苗瓶有裂纹、标签不清或失效者均不得使用,同时要注意严禁冻结。(2)疫苗瓶开启后应立即使用。(3)注射免疫球蛋白者应至少间隔1个月以上接种疫苗,以免影响免疫效果。(4)应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。接种疫苗后应在现场观察至少30 min。
本共识撰写专家:(1)流感病毒疫苗:中国疾病预防控制中心秦颖、刘怡,浙江省杭州市萧山区社区卫生服务中心沈伊娜;(2)肺炎球菌疫苗:江苏省苏州市疾病预防控制中心栾琳,中国疾病预防控制中心叶家楷;(3)含b型流感嗜血杆菌成分疫苗:天津市疾病预防控制中心陈伟,中国疾病预防控制中心张丽娜;(4)肠道病毒71型灭活疫苗:浙江省杭州市疾病预防控制中心刘艳,浙江省疾病预防控制中心胡昱;(5)轮状病毒疫苗:广西壮族自治区南宁市疾病预防控制中心唐金芳;(6)水痘减毒活疫苗:中国疾病预防控制中心王淼,贵州省疾病预防控制中心杜雯;(7)带状疱疹疫苗:北京市疾病预防控制中心虞睿,贵州省疾病预防控制中心杜雯;(8)人乳头瘤病毒疫苗:中国疾病预防控制中心李燕,广东省疾病预防控制中心孙立梅,上海市疾病预防控制中心李智;(9)人用狂犬病疫苗:云南省疾病预防控制中心李颖,浙江省疾病预防控制中心胡昱;(10)肾综合征出血热疫苗:中国疾病预防控制中心崔健,黑龙江省疾病预防控制中心高士锐;(11)钩端螺旋体疫苗:黑龙江省哈尔滨市疾病预防控制中心胡丽楠,黑龙江省疾病预防控制中心高士锐;(12)炭疽疫苗:山东省济南市妇幼保健院杆石桥社区卫生服务中心苗智莹,黑龙江省疾病预防控制中心高士锐;(13)戊型肝炎疫苗:中国疾病预防控制中心李媛秋、王富珍;(14)霍乱疫苗:四川省疾病预防控制中心马千里;(15)伤寒疫苗:广西壮族自治区南宁市疾病预防控制中心唐金芳;(16)森林脑炎疫苗:黑龙江省疾病预防控制中心高士锐
本共识提供建议和指导专家:中国疾病预防控制中心刘大卫、尹遵栋、安志杰、王华庆、李克莉、李艺星、刘燕敏、郝利新、张国民,天津市疾病预防控制中心张颖,山东省疾病预防控制中心张丽,上海市疾病预防控制中心黄卓英,安徽省疾病预防控制中心唐继海,四川省疾病预防控制中心漆琪,重庆市疾病预防控制中心王青,河南省疾病预防控制中心张延炀,湖南省怀化市疾病预防控制中心瞿中武,北京大学第三医院朴梅花,四川大学华西第二医院刘兴会,浙江大学医学院附属妇产科医院海宁分院徐鑫芬
所有作者均声明不存在利益冲突


























