
对2019新型冠状病毒(2019-novel Coronavirus,2019-nCoV)核衣壳蛋白(nucleocapsid protein,NP)进行原核表达、纯化与鉴定,并应用于2019-nCoV血清学诊断。
合成2019-nCoV NP基因,克隆至pET28a载体中,构建表达质粒,并进行诱导纯化。纯化蛋白经SDS-PAGE、间接ELISA、Western blot(WB)、免疫层析法进行鉴定。优化间接ELISA反应条件,进行血清抗体检测。
重组NP经镍柱纯化后SDS-PAGE电泳显示相对分子质量约50×103,与预期一致;间接ELISA、WB表明其能与2019-nCoV感染患者血清特异性结合;用免疫层析法发现对NP检测限为0.2 ng/ml;间接ELISA检测32份2019-nCoV感染者血清及对照血清,发现二者结果可见明显分群。
原核表达的NP具有良好的免疫原性,可用于制备血清学诊断试剂。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019年底至2020年初,2019新型冠状病毒(2019-novel Coronavirus,2019-nCoV)感染的急性肺炎首先在湖北武汉暴发,随即以极快的速度蔓延至全国所有省份[1,2]。其传染性强,传播途径广,特别是人传人的能力远超过2003年的严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)[3],引起世界卫生组织(World Health Organization,WHO)高度关注[4]。早期诊断是预防、控制2019-nCoV暴发的重要手段[5]。截止2020年4月初,我国新型冠状病毒疫情已经初步得到控制,但是境外疫情仍处于失控状态。研发血清学检测试剂,对感染现状评估及感染者诊断与排除具有重要意义。
2019-nCoV是单股正链RNA病毒,基因组大小约30 kb,与SARS-CoV相似性为79%,与蝙蝠体内分离的冠状病毒相似性最高约88%,是一种全新的感染人类并引起严重疾病的病毒[6,7]。2019-nCoV的核衣壳为螺旋对称型,主要结构蛋白是核衣壳蛋白(nucleocapsid protein,NP),NP全长420个氨基酸。NP在病毒结构蛋白中含量最多,在宿主感染早期大量表达,且免疫原性较强,能引起宿主强烈的免疫应答。因此,NP可作为2019-nCoV感染血清学诊断的主要靶标抗原。
本研究以2019-nCoV NP作为研究对象,表达纯化了该病毒NP,并且进行了规模化生产,对该蛋白的免疫原性和在血清学诊断中的应用做了初步探讨。
2019-nCoV NP基因序列(GenBank序列号:MT066176.1)以及相关引物合成和测序均由通用生物系统(安徽)有限公司完成;E.coli DH5α,BL21(DE3)感受态细胞购自通用生物系统(安徽)有限公司;鼠抗2019-nCoV NP多克隆抗体购自北京京天成生物公司;BamHⅠ和NotⅠ核酸内切酶购自New England Biolabs (NEB)公司;EX Taq酶购自TaKaRa公司;HRP标记抗人Fc抗体购自Sigma公司;其他化学试剂均为国产分析纯试剂;感染2019-nCoV患者血清由本中心收集及保存,全部为江苏省病例。
设计NP基因原核表达引物,上游引物带BamHⅠ酶切位点,下游引物带NotⅠ酶切位点。引物序列(5'-3')为:Cov2-NP-F:CGGGATCCTCTGATAATGGACCCCAAAATC; Cov2-NP-R: ATAAGAATGCGGCCGCAGGCCTGAGTTGAGTCAGCAC。使用EX Taq酶扩增NP基因,PCR反应程序为:94 ℃ 3 min;94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 80 s,共30个循环;72 ℃ 10 min。PCR产物经胶回收约1 300 bp目的片段,然后经BamHⅠ和NotⅠ双酶切后连接pET28a载体,转化E.coli DH5α感受态细胞。次日挑选单菌落测序正确后,提质粒转化原核表达菌E.coli BL21(DE3)感受态细胞。
将NP表达菌培养至OD600=0.6后,加入终浓度0.5 mmol/L的IPTG,16 ℃诱导6 h,收集菌体,超声破碎后离心收集包涵体。将包涵体溶于8 mol/L尿素中,然后用镍柱亲和层析纯化包涵体蛋白。纯化后梯度减少尿素含量,使蛋白透析复性至PBS中,最后经SDS-PAGE检测蛋白表达及纯化效果。小量表达成功以后即上100 L发酵罐进行大量发酵,发酵培养基为TB培养基(1%甘油),发酵参数为280 rpm,通气比为0.5 vvm(15 L/min),pH控制在6.8~7.2,罐压0.06 MPa~0.1 MPa,发酵温度为16 ℃,培养24 h。
将纯化NP按一定包被量包被至ELISA板中4 ℃过夜,次日用3% BSA封闭1 h后加入待测血清,从1∶100开始倍比稀释8个稀释度,37 ℃孵育30 min,然后PBST洗板后加入HRP标记抗人Fc抗体(1∶5 000),孵育30 min后,PBST洗涤,TMB显色。
纯化NP经SDS-PAGE后,转印至PVDF膜中,用5%脱脂牛奶封闭1 h后,用患者血清(1∶500稀释)作为一抗,同时用健康成人血清作为阴性对照,室温孵育1 h,用HRP标记抗人Fc作为二抗室温孵育30 min,PBST洗涤后用DAB显色。
将鼠抗2019-nCoV NP多克隆抗体包被在硝酸纤维素膜上,形成T线,抗鼠IgG抗体标记至C线处。NP系列稀释后加50 μl于样本孔中,样本孔下的结合垫上的标有色微球的鼠抗体与NP形成免疫复合物,然后通过层析作用迁移至T线处,与此处标记抗体结合固定,形成有色T线。其余鼠抗体再继续迁移至C线处,与抗鼠抗体结合,形成C线。以此来测定对NP的结合灵敏性。
从合成基因中扩增出NP全长基因,大小为1 260 bp,将此基因构建到pET28a载体中,利用载体N端的His tag进行纯化。NP全长加上载体中的His tag及其他附带氨基酸,预计蛋白相对分子质量约50×103。表达菌经IPTG诱导后,发现在50×103左右出现明显的条带。包涵体溶解后,过镍柱纯化,在150 mmol/L咪唑时有明显的洗脱峰。蛋白经透析复性后,经SDS-PAGE发现在同样的位置出现单一蛋白条带。此说明NP被成功诱导表达并且纯化后纯度较高。
用间接ELISA检测NP与患者血清的结合特异性,结果显示NP能与患者血清明显结合,并且OD450值随稀释度递减,而阴性血清与NP反应不显颜色(图1A)。为了优化ELISA反应条件,依次选择不同浓度的NP进行包被,发现100 ng和50 ng包被量能与阳性血清发生明显的颜色变化而对照阴性血清OD值较低(图1B)。因此,选择100 ng作为最终包被浓度,并对32份确诊患者血清标本进行筛选,发现阴性和阳性标本有明显的分群(图1C)。
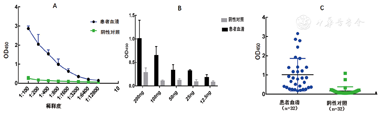

注:A. NP与血清间接ELISA结果;B.不同NP抗原包被量的ELISA结果;C. 100 ng包被NP量测病例与对照血清
Note: A. Identification of the binding specificity of NP by indirect ELSA;B. Optimal quantity of NP for coating; C. Using 100 ng NP to detect antibodies of patients and healthy person samples
纯化NP经SDS-PAGE后转印至PVDF膜后,与4例患者血清反应,用健康人血清作为对照。结果显示在相对分子质量50×103左右有明显的条带,与NP纯化后的相对分子质量大小一致(图2)。此结果进一步证明了纯化NP能特异性识别患者血清中相关抗体。
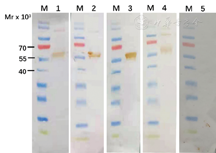

注:M.蛋白marker;1-4.待测患者血清样本;5.阴性成人血清
Note: M. Protein markers; 1-4. Four different patients serum samples; 5. Healthy person serum sample
采用有色微球标记抗体检测层析条对NP的检测限,NP经过系列稀释,用标记微球的鼠多抗检测。结果显示在稀释到0.2ng/ml时仍然能检测出明显的T线,此结果显示该NP能与鼠多抗特异性结合并且检测限可达到ng级别(图3)。
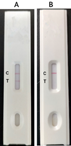

注:A为层析法检测NP;B为阴性血清对照;C质控线;T检测线
Note: A.To detect NP using immunochromatographic assay; B. Negative control samples; C. Control line; T. Test line
2019年12月在湖北武汉发现2019-nCoV感染病例,随即呈暴发趋势,并迅速扩散。为了防止疫情扩散,国内采取了一系列紧急应对措施,动员了空前的人力物力,虽然疫情发展势头得到有效遏制,但是国民经济受到了巨大的损失,人民生活也受到极大影响[8]。
由于特异性治疗药物及有效疫苗尚未研发成功,早期诊断成为防控疫情重要的措施,早期核酸诊断及临床诊断为确诊重要依据。目前,2019-nCoV感染的诊断主要依赖于核酸诊断[9]。虽然核酸诊断速度快、受采样质量的影响大,存在假阳性和假阴性,影响防控措施的落实。部分无症状感染者在病程晚期核酸检测也呈阴性,单凭核酸检测很容易出现漏诊。血清学诊断是检测病原感染后机体的免疫反应,持续时间长,免疫反应稳定,且免疫反应随着病程进展呈动态变化趋势。因此,血清学诊断特别是血清中IgM抗体的检测,同样也是早期诊断和感染现状评价的重要手段。
2019-nCoV属于β属冠状病毒,病毒核衣壳呈螺旋对称,理论上讲有更大的容纳核酸的空间,其核酸长度也比较长,达30 kb。病毒呈花冠状,其中明显的刺突蛋白(spike protein,SP)为表面蛋白,含有受体结合位点和中和抗体结合位点,承受机体免疫系统的压力。NP为包裹核酸的衣壳蛋白,在结构蛋白中含量比较高,且在病毒感染早期大量复制,可以引起强烈的免疫反应,是作为免疫诊断的理想靶抗原[10,11]。
本研究在疫情暴发早期就成功表达出2019-nCoV NP,并且用患者血清对此蛋白进行了一系列功能验证,建立了间接ELISA的方法用于血清抗体筛查,说明该蛋白具有良好的免疫原性,可以用于制备抗体诊断试剂。由于疫情初期收集到的感染病例血清盘数量有限,NP的特异性抗体检测方法的特异性仍有待进一步评价。
所有作者均声明不存在利益冲突



























