
报道1例急性感觉共济失调神经病患者的临床、电生理、神经病理特点及其预后。患者为32岁女性,临床表现为感觉异常、感觉性共济失调伴假性手足徐动及腱反射减低,脑脊液呈蛋白-细胞分离,肌电图及腓肠神经活组织检查符合急性重度活动性感觉轴索性周围神经病特点,经静脉注射丙种球蛋白联合大剂量激素冲击治疗,患者四肢烧灼刺痛感逐渐缓解。随访1年余,患者持物不稳症状缓慢改善,多次随访肌电图检查提示双下肢H反射波幅随临床症状改善而缓慢恢复。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
吉兰-巴雷综合征(Guillain-Barré syndrome, GBS)为一组累及周围神经系统的自身免疫性疾病。临床依据受累纤维的类型[运动和(或)感觉纤维]及受累细胞组分[神经轴索和(或)其髓鞘]的不同,将GBS谱系疾病可大致分为经典型和变异型[1, 2, 3, 4]。经典型GBS患者出现运动纤维伴或不伴感觉纤维受累,临床表现为急性起病四肢迟缓性瘫痪,结合电生理检查可进一步分为急性炎性脱髓鞘性多发神经根神经病(acute inflammatory demyelinating polyradiculoneuro- pathy,AIDP)以及急性运动轴索神经病(acute motor axonal neuropathy,AMAN)与急性运动感觉轴索神经病(acute motor sensory axonal neuropathy,AMSAN)[1, 2, 3, 4]。仅累及感觉纤维的GBS相对罕见[5, 6, 7, 8],通常被认为是不完全型Miller-Fisher综合征(Miller Fisher syndrome,MFS)[2, 9]。Uncini和Yuki[10]认为,与运动纤维受累为主的经典型GBS类似,感觉型GBS也可分为脱髓鞘型和感觉轴索/神经元型,在治疗反应和远期预后方面二者可能存在差异。我们报道1例经神经电生理和神经病理证实为感觉轴索受损的急性感觉共济失调神经病患者的临床及电生理随访研究结果。
临床资料 患者女性,32岁,小学教师,主因“四肢感觉异常伴持物不稳1个月”于2017年11月24日入住中日友好医院神经内科病房。患者约1个多月前因咳嗽、发热诊断为上呼吸道感染,自服头孢类抗生素好转;数天后出现左颈部、面部疼痛感,触摸左面时感觉异常(触茧感);随即出现左臂内侧发木、刺痛感及全身游走性疼痛;于入院前20 d出现双下肢(小腿及足部)麻木、疼痛,足底烧灼感和足面肿胀感,右侧稍重于左侧;随后出现右前臂内侧麻木、胀痛伴烧灼感,平卧位用力伸肘时加重,因疼痛不能做梳头洗脸等动作;同时伴右手持物不稳和书写不能。患者自发病以来仍可独立行走,但有踩棉花感及行走速度减慢。否认肢体力弱或肉跳感,否认眼肌麻痹及吞咽困难等症状;无躯体束带感及尿便障碍;否认体位变化时头晕或晕厥。既往史和个人史无特殊,否认家族遗传病史。入院时体检:一般内科系统体检未见异常,脑神经体检未见明确异常,右前臂内侧较对侧痛觉过敏,双下肢音叉震动觉减低,右侧指鼻运动欠稳准,右上肢假性手足徐动,双下肢跟膝胫运动欠稳准,四肢肌力Ⅴ级,左侧肱二头肌腱反射减低、肱三头肌腱反射未引出,右上肢及双下肢腱反射未引出,Romberg征阳性,双侧病理征阴性。
辅助检查:入院后完善血尿便常规、生化全套、术前感染筛查(包括乙型肝炎、艾滋病、梅毒等)、血清叶酸/维生素B12水平、血糖、红细胞沉降率、肿瘤标志物、血管炎抗体谱[包括抗核抗体(antinuclear antibody)、干燥综合征A抗体(Sjögren′s syndrome A antibody)、干燥综合征B抗体(Sjögren′s syndrome B antibody)及抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic autoantibodies)等]均在正常范围;血尿λ/κ轻链及免疫固定电泳(在北京协和医院完成)均阴性;血尿毒物及重金属筛查(在解放军第307医院完成)未见明显异常。腰椎穿刺测脑脊液压力为135 mmH2O(1 mmH2O=0.009 8 kPa),脑脊液白细胞数6×106/L(正常值<10×106/L),蛋白定量为3.687 g/L(正常值0.15~0.45 g/L);脑脊液细胞学检查示0.5 ml收集白细胞总数为300,可见激活淋巴细胞;血清及脑脊液寡克隆区带、TORCH[弓形虫、其他(梅毒)、风疹、巨细胞病毒、单纯疱疹病毒]抗体、副肿瘤抗体(包括抗Hu抗体等)、神经节苷酯抗体[包括GM1(单唾液酸四已糖神经节甘脂)、GM2(单唾液酸神经节苷脂)、GQ1b(四唾液酸神经节苷脂)及GD1b(双唾液酸神经节苷脂)等]均阴性。妇科B超、胸部CT、PET-CT均未见明显异常。头颅MRI、颈椎MRI、腰椎MRI平扫未见明显异常。
患者入院后肌电图检查(2017年11月24日)示双侧胫神经、左侧腓神经、右侧尺神经、正中神经运动传导速度及波幅在正常范围;双侧胫神经、左侧腓神经、右侧尺神经、正中神经感觉传导感觉神经动作电位(sensory nerve action potential,SNAP)波幅减低,传导速度在正常范围(表1);双侧胫神经H反射波幅减低;双侧胫神经F波潜伏期及出现率在正常范围;瞬目反射测定双侧R1潜伏期在正常范围。体感诱发电位检查(2017年11月29日)结果表明,右侧正中神经及右侧胫神经体感诱发各波均未引出波形。交感皮肤反应测定示双下肢记录及双上肢记录潜伏期、波幅在正常范围。
感觉型吉兰-巴雷综合征患者肌电图随访结果(左侧/右侧)
Follow-up results of electromyography in a patient with sensory Guillain-Barré syndrome (left side/right side)
感觉型吉兰-巴雷综合征患者肌电图随访结果(左侧/右侧)
Follow-up results of electromyography in a patient with sensory Guillain-Barré syndrome (left side/right side)
| 项目 | 入院后第1天 | 入院后第14天 | 门诊随访3个月后 | 门诊随访7个月后 | 门诊随访12个月后 |
|---|---|---|---|---|---|
| 正中神经CMAP(mV) | NA/13.3 | 14.1/12.2 | NA/12.4 | NA/15.0 | 16.4/17.8 |
| 尺神经 CMAP(mV) | NA/10.1 | 8.3/9.9 | NA/8.3 | NA/10.4 | 13.5/11.1 |
| 胫神经 CMAP(mV) | 17.9/19.9 | 12.2/11.2 | 20.8/16.1 | 11.8/13.3 | 12.8/16.9 |
| 正中神经SNAP_指1(μV) | NA/1.26 | 20.6/NR | NA/NR | NA/NR | 22.1/NR |
| 正中神经SNAP_指3(μV) | NA/1.26 | NR/NR | NA/NR | NA/NR | 0.43/NR |
| 尺神经SNAP(μV) | NA/2.9 | NR/NR | NA/NR | NA/NR | NR/NR |
| 胫神经 SNAP(μV) | 1.58/1.17 | NR/NR | NR/NR | NR/NR | NR/NR |
| H反射潜伏期(ms) | 32.5/32.9 | NR/NR | 32.2/32.5 | 32.3/32.3 | 30.9/30.6 |
| H反射波幅(mV) | 0.16/0.12 | NR/NR | 0.17/0.11 | 0.19/0.14 | 0.36/0.20 |
| F波潜伏期a (ms) | 49.8/51.3 | 51.3/50.9 | 51.1/51.4 | 52.3/51.5 | 52.2/51.1 |
注:CMAP:复合肌肉动作电位;SNAP:感觉神经动作电位;NA: 未检查;NR: 未引出波形;a下肢胫后神经F波测定
患者于2017年11月28日在局部麻醉下行右侧腓肠神经活组织检查,神经病理检查结果(图1)提示有髓神经纤维中重度丢失,大量不同时期轴索变性,包括伴随空泡结构的有髓神经纤维Wallerian变性、脱失后残留的空洞样结构,未见薄髓鞘神经纤维、有髓神经纤维的再生簇以及洋葱球样结构,未见典型血管炎病理改变及刚果红阳性异常物质沉积;免疫组织化学染色显示不同直径有髓神经纤维和无髓神经纤维重度丢失,神经内衣可见较多CD68+巨噬细胞浸润。神经病理改变符合急性重度活动性轴索性周围神经病特点。
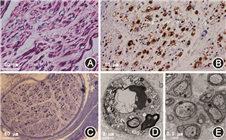

患者于2017年11月29日接受静脉注射丙种球蛋白0.4 g·kg-1· d-1,连续5 d治疗,同时辅以维生素B1、甲钴胺营养神经,加巴喷丁、草酸艾司西酞普兰等对症治疗后自觉四肢感觉异常改善不明显。2017年12月7日复查肌电图提示双侧胫神经、尺神经、右侧正中神经感觉传导未引出波形,左侧正中神经指3刺激感觉传导未引出波形(图2);双侧胫神经H反射未引出波形。2017年12月7日开始静脉点滴甲泼尼龙1 g/d,连续5 d治疗后改为口服泼尼松60 mg/d快速减量(1个月减停)方案,患者四肢烧灼刺痛感逐渐缓解。随访近2年,患者肢体感觉异常、右上肢持物不稳及步态异常等症状逐渐改善,未有肢体力弱表现,未再有急性加重或波动,多次复查肌电图提示双侧胫神经H反射波幅缓慢恢复(表1)。

文中报道1例以急性起病的肢体感觉异常伴感觉性共济失调为主要表现的青年患者,其神经电生理及神经病理符合急性感觉轴索神经病特点,结合发病前上呼吸道感染前驱病史,脑脊液蛋白细胞分离,符合Uncini和Yuki[10]报道的以感觉轴索受累为主的感觉型GBS。类似病例国内外仅偶有报道[11, 12],但长期临床及电生理随访研究尚缺乏。有关此类患者具体病变部位究竟是感觉神经元还是感觉轴索,抑或二者并存,尚存在争议。多数专家认为肌电图显示感觉SNAP波幅下降同时伴有脊髓核磁后索受损时提示感觉神经元病变[12, 13, 14, 15],也有报道指出病程早期不出现脊髓后索异常不排除感觉神经元病[12]。
需要指出的是,虽然本例患者入院时颈髓核磁未见明确后索所累,但本例患者以下临床特点支持存在近段感觉神经(包括感觉神经根和神经元)受累而不仅是逆行坏死的末梢型感觉轴索神经病:(1)患者以躯干近段感觉异常起病;(2)患者感觉性共济失调及假性手足徐动症右上肢较左上肢明显,其受累的不对称性现象符合感觉神经元病特点[13];(3)患者第二次肌电图显示左侧正中神经运动传导正常,感觉传导(腕部记录)指1刺激SNAP波幅及传导速度正常而指3刺激SNAP波幅未引出(此特点1年后复查仍存在),结合患者体检左侧肱二头肌腱反射可引出而肱三头肌腱反射未能引出,提示不同神经根(神经元)受累不均一(C7重于C6)。
与急性感觉髓鞘型GBS不同,急性感觉轴索型GBS临床诊断时需与其他多种病因所致急性感觉神经元病(sensory neuronopathy, SSN)相鉴别[16]。SSN临床亦可表现为四肢感觉异常、感觉性共济失调,可出现脊髓MRI后索T2高信号。经过详细排查,本例患者并无副肿瘤、干燥综合征、中毒及感染等因素所致SSN证据。此外,本例患者尚需与慢性炎性脱髓鞘性多发性感觉神经根病(chronic immune sensory polyradiculopathy, CISP)相鉴别,该病以慢性复发性需免疫维持治疗的感觉性共济失调为主要表现[16]。然而,本例患者为急性起病、迅速出现感觉传导SNAP波幅下降直至不能引出波形、单相病程而不需免疫维持治疗,与典型CISP不符。
目前,尚无评估急性感觉轴索型GBS预后的可靠疾病监测指标。通过对本例患者1年余随访,经治疗后患者感觉异常症状消失、感觉性共济失调症状缓慢改善,随访肌电图检查其感觉传导SNAP波幅在起病后1年随访时仍不能引出波形。我们发现,在疾病早期病情加重时,患者胫神经H反射波幅明显下降至不能引出,但随着病情缓慢恢复,患者H反射波幅出现并逐渐增加,因此我们推测H反射波幅可作为急性轴索型GBS随访病情的客观有效生物标志物。H反射是单突触反射,传入纤维为肌梭的Ⅰa类感觉纤维,经脊髓中间神经元换元,传出纤维为α运动纤维至效应器产生肌肉收缩反应,反映的是近段神经感觉及运动纤维的功能。然而,此现象尚需更多样本观察以证实。
综上所述,我们报道了1例临床罕见的以急性感觉性共济失调为主要症状、感觉轴索受累为主的感觉型GBS患者的临床、神经电生理及神经病理学特点。此型患者临床恢复相对慢,早期免疫治疗可改善患者临床症状。
所有作者均声明不存在利益冲突
None declared



























