
酮症性偏侧舞蹈症是高血糖酮症引起的偏侧舞蹈症,临床上非常罕见,尤其在老年2型糖尿病患者中国内外未见报道。文中报道2例酮症性偏侧舞蹈症患者,均为老年2型糖尿病患者,1例为86岁女性,初发糖尿病,单侧肢体受累;另1例为85岁男性,长期血糖控制不佳,双侧肢体受累。结合相关文献对其临床及影像学表现进行分析,以提高对该病的认识。

偏侧舞蹈症(hemichorea,HC)是一种少见的运动障碍疾病,常由基底节区或其联系纤维受损引发锥体外系症状。引起HC的原因很多,包括脑血管病和神经退行性、感染性、药物性、代谢性、免疫相关性疾病等,其中以脑血管病最常见。既往报道的糖尿病非酮症性偏侧舞蹈症(hemichorea associated with non-ketotic hyperglycemia,HC-NH)在临床上就比较少见,而酮症性偏侧舞蹈症更罕见,国内外报道[1] 仅见于年轻人1型糖尿病酮症酸中毒患者,而在老年2型糖尿病患者中未见报道,极易被误诊为脑血管病[2, 3],从而延误治疗。现将我院收治的2例酮症性偏侧舞蹈症病例报道如下。
临床资料 例1 患者女性,86岁,因“右侧肢体舞蹈样动作7 d”于2018年9月11日入院。患者7 d前无明显诱因出现右下肢舞蹈样不自主动作,幅度大、无规律,逐渐波及右上肢和右侧面部(下颌),可短时间自控,入眠后消失。既往左上肢骨折术后6年,恢复可。个人及家族史无特殊。入院体检:体温36.4 ℃,脉搏90次/min,呼吸17次/分,血压155/69 mmHg(1 mmHg=0.133 kPa),意识清楚,精神差,言语流利,K-F环(-),右侧肢体及下颌舞蹈样不自主运动,共济体检欠配合,双侧病理征未引出,余神经系统体检未见阳性定位体征。辅助检查:颅脑CT:左侧基底节区片状略高密度影(CT值51 HU)(图1A)。颅脑MRI(图1B~D):左侧基底节区不规则T1WI高信号、T2WI低信号、DWI低信号影,边界清;无强化现象;MRA未见明显血管狭窄。颈动脉血管彩超:双侧颈动脉内-中膜增厚伴斑块形成、双侧锁骨下动脉及椎动脉结构及血流未见明显异常。心电图正常。心脏彩超:三尖瓣轻度反流,射血分数值62%。随机血糖29.4 mmol/L。血酮体(++)。总胆固醇6.10 mmol/L。红细胞沉降率30 mm/h。尿常规:尿糖(+++)、尿蛋白(+)、尿酮体(++)。血气、血常规、凝血、C-反应蛋白、肝肾功能、心肌标志物、尿便常规、病毒五项、甲状腺功能三项、血同型半胱氨酸、电解质、脑钠肽、铜蓝蛋白、血管炎相关免疫全套未见异常。治疗:小剂量胰岛素泵入控制血糖,补液,氟哌啶醇(1 mg、3次/d)对症治疗;第3天血糖正常而改用30/70混合重组人胰岛素注射液,第4天血酮体转阴,第7天舞蹈症状完全控制,患者自动出院。随访:患者出院后因经济条件限制未坚持胰岛素治疗,5 d后右侧肢体舞蹈样动作再次出现,14 d后对侧出现类似舞蹈样症状,最终死于急性肾衰竭。
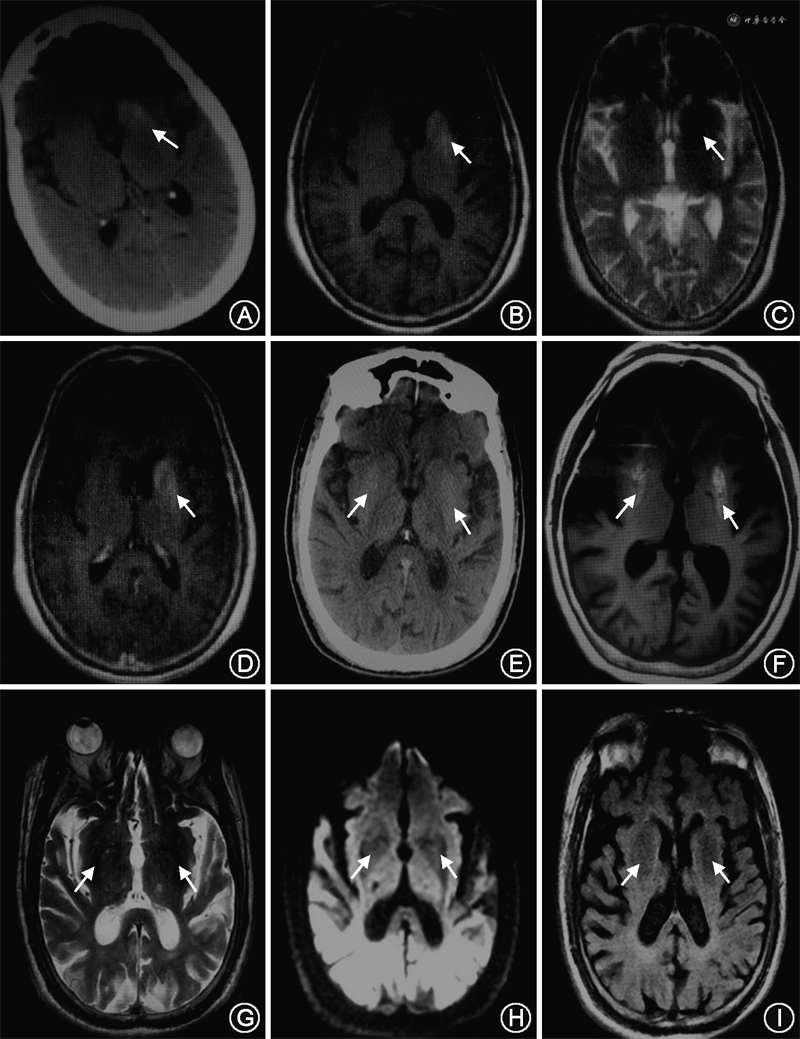

例2 患者男性,85岁,因“发现行为异常3 d”于2020年10月31日入院。患者3 d前无明显诱因出现双上肢舞蹈样不自主运动、身体不自主扭动,幅度大、无规律,逐渐出现扭头耸肩、双手指伸展抓握、面部挤眉弄眼,紧张时加重,不能自控,入眠后消失。既往有2型糖尿病病史10年,未规律胰岛素治疗,血糖控制差;颈椎椎管狭窄术后3年,恢复可。个人及家族史无特殊。入院体检:体温36.5 ℃,脉搏70次/min,呼吸19次/min,血压165/86 mmHg,意识清楚,精神差,言语流利,K-F环(-),双上肢舞蹈样不自主运动、身体不自主扭动,幅度大、无规律,逐渐出现扭头耸肩、双手指伸展抓握,面部挤眉弄眼,不能自控;共济体检欠配合,双侧病理征未引出,余神经系统体检未见阳性定位体征。辅助检查:颅脑CT:双侧基底节区稍高密度影(CT值49 HU)(图1E)。颅脑MRI(图1F~I):双侧基底节区可见T1WI高信号、T2WI稍低信号、DWI低信号影;无强化现象;MRA未见明显血管狭窄。颈动脉血管彩超:双侧颈动脉内-中膜增厚伴斑块形成、右侧锁骨下动脉起始段内-中膜增厚伴斑块形成、双侧椎动脉结构及血流未见明显异常。心电图正常。心脏彩超:二尖瓣轻度反流,射血分数值60%。空腹血糖22.7 mmol/L,血酮体(++)。尿常规:尿糖(++++)、尿蛋白(-)、尿酮体(+)。血气、血常规、凝血、C-反应蛋白、降钙素原、肝肾功能、心肌标志物、尿便常规、红细胞沉降率、血脂、病毒五项、甲状腺功能三项、血同型半胱氨酸、血氨、电解质、脑钠肽、血管炎相关免疫全套检查未见异常。治疗:小剂量胰岛素泵入控制血糖,氟哌啶醇(1 mg、3次/d)对症治疗,补液,阿司匹林肠溶片(0.1 g、1次/d)抗血小板聚集,舒血宁(20 ml、1次/d)改善循环,阿托伐他汀钙片(20 mg、每晚睡前服用)降脂稳定斑块;血酮体转阴后改为赖脯胰岛素(早5 U、午7 U、晚5 U)、甘精胰岛素(睡前10 U)控制血糖。第5天舞蹈症状完全消失,氟哌啶醇逐渐减量至停药,于第9天出院。随访:出院后15 d内,患者血糖控制在正常范围,未再出现舞蹈样不自主运动。
1960年Bedwell首次报道糖尿病性偏侧舞蹈症(diabetic hemiballism hemichorea,DHB-HC),呈急性起病,女性多见,男女比1.0∶1.8[4],以东亚居多[5],可为糖尿病的首发症状[6, 7],也可在急性高血糖后发作[8];好发年龄70岁以上[6],发病时血糖水平高、酮体多呈阴性,舞蹈症状可随血糖控制而减轻或消失[9]。Mayo等的研究结果表明在所有HC中DHB-HC仅占1%[10],HC-NH发病率更是低于1/10万[6],提示为少见或罕见病。而酮症性偏侧舞蹈症的报道更罕见,目前国内外仅报道有年轻1型糖尿病酮症酸中毒患者,在老年人中未见报道。文中2例糖尿病患者发病年龄均超过80岁,1例为女性,初发糖尿病;1例为男性,长期血糖控制不佳。
既往文献报道的HC-NH多累及单侧肢体,极少数双侧受累,多以病变部位对侧肢体近端不自主运动为主要表现,面部及手部的不自主运动相对少见[11, 12],可表现为扭头耸肩、手指伸展抓握、上下肢关节内收、外展、旋转等动作,面部可见扮鬼脸、挤眉弄眼等表情。在紧张时加重,安静时减轻,睡眠时完全消失[13]。文中2例患者的临床表现与HC-NH基本相同。
HC-NH主要累及基底节区,以单侧为主,双侧少见。影像学具有特征性:颅脑CT可见基底节区高密度影(CT值约50 HU),易被误诊为脑出血,给患者带来不必要的经济和心理负担。绝大多数病例磁共振T1WI呈高信号,T2WI信号随检查时间变化表现不一、呈稍低或等信号,DWI呈低信号,增强扫描无强化、不具特征性;不符合通常血肿的时间演变规律,无明显水肿及占位效应,边界清。上述2例患者的发病部位及影像学表现与HC-NH基本相同。
高血糖性偏侧舞蹈症的发病机制迄今尚不明确,目前有几种学说[14],均认为高血糖导致黑质纹状体系统多巴胺功能增强,从而产生舞蹈症状。(1)代谢紊乱学说:正常情况下,大脑中抑制性的氨基酸递质γ氨基丁酸(γ-amino butyric acid,GABA)与兴奋性的递质多巴胺处于平衡状态。当纹状体系统受损时,GABA减少,多巴胺能神经元脱抑制而过度活跃,从而发生HC。Kumar等[15]发现病灶侧纹状体处于葡萄糖低代谢状态;Tan等[16]的研究结果显示,高血糖可破坏血脑屏障,脑局部葡萄糖代谢下降或衰竭(尤以纹状体为著),以无氧代谢为主,需GABA为能量来源,非酮症时GABA快速耗竭又无法重新合成,合成GABA的乙酰乙酸耗尽导致乙酰胆碱合成障碍,GABA、乙酰胆碱、多巴胺平衡破坏,产生HC-NH。但酮体阳性患者乙酰乙酸并不缺乏,GABA含量也不会轻易减少,其具体发病机制尚有待进一步研究。(2)多巴胺超敏现象:高血糖状态时多巴胺能神经元活性改变,使多巴胺受体上调,抑制多巴胺的降解,导致多巴胺神经功能相对亢进,从而引起HC-NH。这一学说可否解释机制1中酮体阳性患者,还有待进一步证实;但可以解释本文中2例患者在控制血糖的同时合用多巴胺受体拮抗剂氟哌啶醇能一定程度上改善症状。(3)灌注不足学说:Suzuki等[17]通过单光子发射计算机断层成像术发现DHB-HC患者纹状体区域灌注明显下降,考虑其发病可能与缺血有关,从而证实了这一学说。(4)微出血学说:Nath等[18]尸检发现HC-NH患者病灶处微量出血,但其出血不同于一般脑出血,血肿局限于豆状核及壳核,不压迫内囊及邻近结构,无水肿及占位效应,且MRI不符合脑出血时间演变规律。(5)神经变性因素:长期慢性的高血糖或高渗性会导致纹状体区内的蛋白质发生华勒变性,变性过程出现的蛋白质脱水可以解释HC-NH影像学变化[19]。
综上所述,酮症性偏侧舞蹈症发病部位及临床表现与HC-NH基本相同,主要累及纹状体,以单侧为主,也可双侧受累;引起病变部位对侧肢体近端、面部及手部不自主运动。影像学特点为颅脑CT基底节区高密度影,磁共振T1WI高信号、T2WI稍低或等信号、DWI低信号、无强化现象。治疗的基础及关键是控制血糖,多数患者的舞蹈症状在数天或数周内随血糖的控制而逐渐好转消失;但如果对血糖控制不积极,可复发甚至累及双侧。对于顽固性病例,可加用多巴胺受体拮抗剂氟哌啶醇,有助于控制舞蹈症状。而该病的具体发病机制尚需进一步研究。我们在临床工作中应对此提高认识,避免误诊误治。
所有作者均声明不存在利益冲突
None declared



























