
副肿瘤神经综合征(PNS)是恶性肿瘤继发的自身免疫反应所致的一组异质性疾病,可累及神经系统的任何部分。抗两性蛋白抗体为PNS高风险抗体之一,常伴发小细胞肺癌及乳腺癌,而肺外神经内分泌癌少见。我们报道1例伴发食管神经内分泌癌的抗两性蛋白抗体相关副肿瘤性脑干脑炎患者。通过氟脱氧葡萄糖正电子发射体层摄影发现肿瘤,由胃镜活组织检查病理证实。患者经人免疫球蛋白和糖皮质激素治疗后,神经系统症状部分改善。最终预后与伴发肿瘤密切相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
副肿瘤神经综合征(paraneoplastic neurologic syndrome,PNS)是恶性肿瘤继发的自身免疫反应所致的一组异质性疾病,可累及神经系统的任何部分。约0.3%的恶性肿瘤患者并发PNS[1]。PNS发病与特异性抗神经元抗体的产生密切相关。抗两性蛋白(amphiphysin)抗体为PNS高风险抗体之一,该抗体阳性患者临床可表现为僵人综合征、脑脊髓炎、周围神经病、脑干脑炎等多种神经综合征,常伴发小细胞肺癌及乳腺癌[2, 3]。我们报道1例伴发食管神经内分泌癌的抗两性蛋白抗体相关副肿瘤性脑干脑炎患者,以提高对本病的认识。
临床资料 患者男性,66岁,主因“头晕、行走不稳半个月余,意识障碍3 d”于2021年8月19日入我院。2021年8月2日患者饮酒后出现头晕、行走不稳,否认肢体无力。此后,头晕加重伴恶心、呕吐,渐出现双手精细动作不稳,构音欠清,音调低沉,双眼视物模糊。外院头颅MRI示小脑脑沟略增宽,余未见明显异常。考虑“后循环卒中,前庭神经炎不除外”,予抗血小板、降脂、甲泼尼龙40 mg 1次/d 静脉输液(疗程不详),症状仍加重。8月13日于我科急诊就诊,体格检查:体温36.5 ℃,轮椅入室,意识清楚,构音欠清、吟诗样语言,左右注视时双眼持续细小眼震,余脑神经(-);四肢肌力近Ⅴ级,双下肢病理征(±);双手指鼻欠稳准。考虑韦尼克脑病不除外,予维生素B1 500 mg 1次/d 静脉输液 × 3 d,无明显改善。8月16日出现尿潴留,急查残余尿量约275 ml,留置尿管;完善血常规、肝肾功能、凝血、肿瘤标志物大致正常;行腰椎穿刺,脑脊液压力150 mm H2O(1 mm H2O=0.009 8 kPa),白细胞142× 106/L、单个核细胞 98.6%,蛋白 0.62 g/L;考虑病毒性脑炎可能,予阿昔洛韦0.5 g 1次/8 h 静脉输液,症状持续加重。8月17日出现嗜睡,辅助无法站立,不能言语、进食、遵嘱,间断违拗,并出现咳嗽咳痰,体温正常,复查血常规:白细胞10.75×109/L,中性粒细胞83.0%,肺部CT示:双肺多发斑片影,头颅MRI大致同前;常规脑电图示:α节律解体,各导联可见较多散在θ节律及活动,未见δ节律;拟诊为“免疫介导性脑干小脑炎不除外,肺部感染可能”,予甲泼尼龙80 mg 1次/d及盐酸莫西沙星0.4 g 1次/d静脉输液。8月19日回报血及脑脊液抗两性蛋白抗体阳性,血及脑脊液抗CV2/坍塌反应调节蛋白5(CV2/collapsin response-mediator protein 5,CV2/CRMP5)、Ma2、Hu、Yo、Ri抗体均阴性,为进一步诊治收入院。发病以来,患者体重无明显变化。既往史、个人史、家族史:高血压病20余年;20年前因下腔静脉狭窄行支架置入术,术后支架移位至右心,行开胸取支架术及心脏修补术;输血2次;长期大量吸烟饮酒史;余无特殊。入院体格检查:体温36.4 ℃,卧床、昏睡,格拉斯哥量表评分睁眼反应3分、语言反应1分、肢体运动4分。双侧瞳孔等大,直径3 mm,对光反射存在,双眼可见自发眼震,方向不固定。四肢可见下意识活动,双上肢肌张力偏低;疼痛刺激有反应;双上肢腱反射偏低,双下肢腱反射活跃;双侧霍夫曼征阴性,巴宾斯基征阳性。颈软无抵抗。
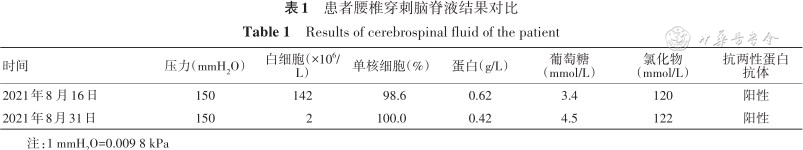
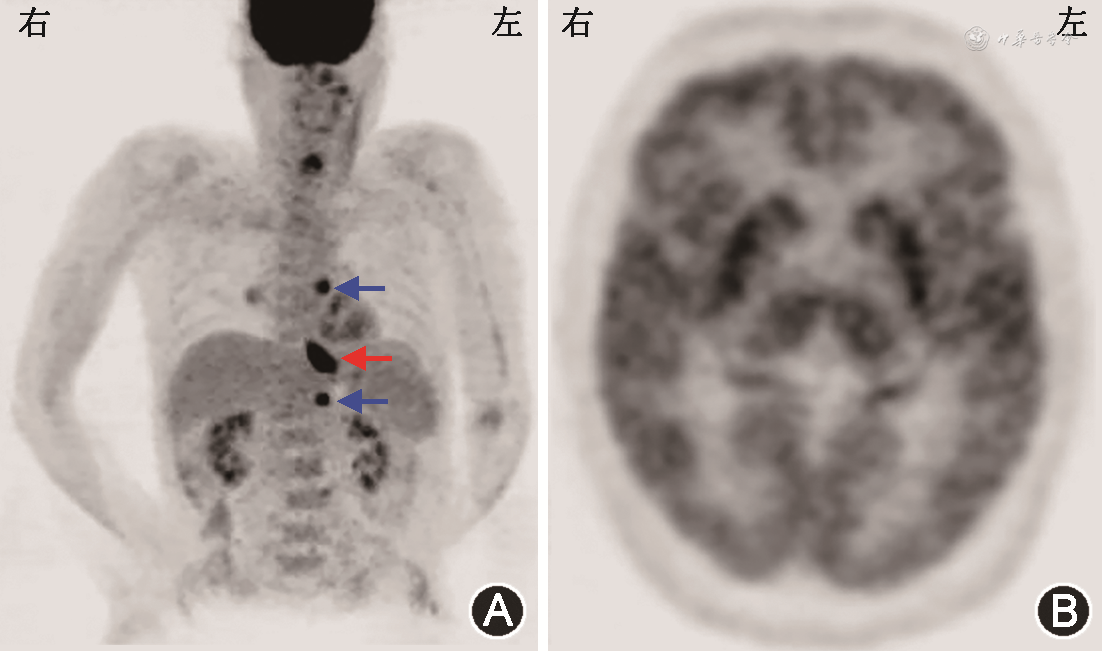
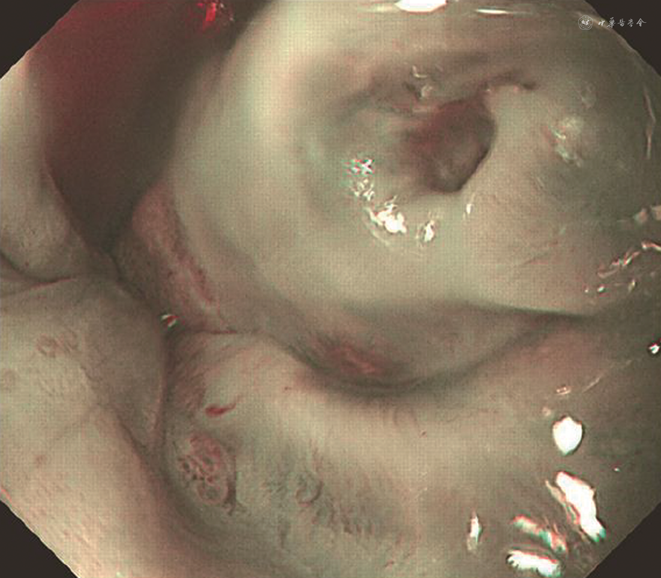
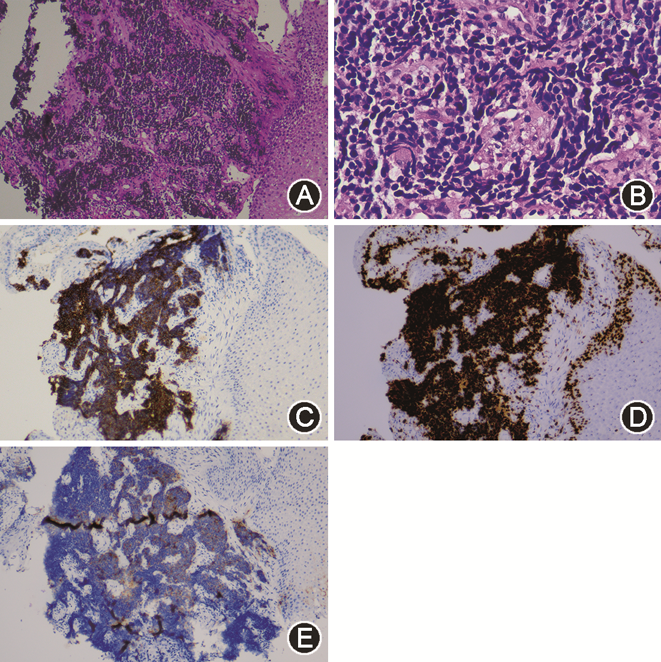
患者入院后完善胸、腹及盆腔CT平扫未见肿瘤性病变。复查腰椎穿刺(表1),脑脊液炎性反应较半个月前明显减轻;血及脑脊液抗两性蛋白抗体阳性,血及脑脊液抗CV2/CRMP5、Ma2、Hu、Yo、Ri抗体均阴性。9月1日行氟脱氧葡萄糖正电子发射体层摄影(FDG-PET;图1)示食管下段近贲门代谢增高灶,范围约2.7 cm × 2.1 cm,最大标准化摄取值(maximum standardized uptake value,SUVmax)14.1,恶性病变可能性大,伴T7水平食管左旁、肝胃间隙、上腹部腹膜后淋巴结转移,最大者短径约0.8 cm,SUVmax 7.3,建议行胃镜检查明确病理;双侧枕叶及小脑代谢减低,双侧颞叶内侧代谢不均匀稍增高,双侧基底节及丘脑代谢增高,脑干代谢不均匀稍增高,符合自身免疫性脑炎表现。9月9日胃镜(图2)示食管下段近贲门处后壁侧小孔样改变,局部无脓液溢出、黏膜稍充血、窄带成像下尚可,取活组织检查(活检)组织1块,质软。病理回报(图3)食管下段黏膜下见小团异型小蓝圆细胞浸润,结合免疫组织化学检查结果,符合神经内分泌癌(小细胞性)。
患者腰椎穿刺脑脊液结果对比
Results of cerebrospinal fluid of the patient
患者腰椎穿刺脑脊液结果对比
Results of cerebrospinal fluid of the patient
| 时间 | 压力(mmH2O) | 白细胞(×106/L) | 单核细胞(%) | 蛋白(g/L) | 葡萄糖 (mmol/L) | 氯化物 (mmol/L) | 抗两性蛋白抗体 |
|---|---|---|---|---|---|---|---|
| 2021年8 月16日 | 150 | 142 | 98.6 | 0.62 | 3.4 | 120 | 阳性 |
| 2021年8月31日 | 150 | 2 | 100.0 | 0.42 | 4.5 | 122 | 阳性 |
注:1 mmH2O=0.009 8 kPa



在定位诊断方面,患者头晕,眼震,构音不清、吟诗样语言,指鼻不稳,行走不稳,考虑小脑及其联系纤维受累。意识障碍,最重时浅昏迷,后随治疗有所好转,但仍存在谵妄、理解障碍等,考虑脑干网状结构及(或)以上投射纤维受累,可能累及大脑皮质;双下肢腱反射活跃、病理征阳性,结合前述脑干水平以上及小脑体征,考虑脑干或以上锥体束受累;综合定位于脑干、小脑及可能皮质受累。在定性诊断方面,患者为老年男性,急性起病,进行性加重,存在较广泛的中枢神经系统受累症状和体征,结合患者实验室检查脑脊液白细胞增多、蛋白升高,诊断考虑脑干脑炎综合征。在病因方面,根据2021年更新的副肿瘤神经综合征诊断标准[3],患者存在中风险表型(脑干脑炎)、高风险抗体抗两性蛋白抗体阳性以及存在表型和抗体一致的肿瘤,确诊为“副肿瘤神经综合征”。
在免疫治疗方面,8月18日起甲泼尼龙80 mg 1次/d,后同时静脉输液人免疫球蛋白27.5 g 1次/d × 5 d,患者意识状态渐好转。9月3日甲泼尼龙减量至40 mg 1次/d。鼻饲入喹硫平100 mg 1次/晚+氯硝西泮1 mg 1次/晚控制夜间躁动。在营养支持方面,患者胃管鼻饲呕吐明显,遂行空肠营养管置入术,予肠内营养乳剂1 000 ml 1次/d肠内营养支持。胃镜活检病理结果回报后,胸外科会诊无手术指征;肿瘤内科会诊,患者目前卧床、意识障碍、难以耐受化疗,如一般情况改善、口服激素神经系统症状稳定,可再考虑化疗。向患者家属充分交代病情、化疗相关获益及风险,患者家属决定转回当地医院继续治疗,于9月23日出院。
患者出院时意识状态较入院时明显好转,夜间间断喊叫、躁动。体格检查:卧床,意识尚清楚,格拉斯哥量表评分睁眼反应4分、语言反应3分、肢体运动6分,左右注视见双眼水平眼震,四肢自主活动可,肌力近Ⅴ级,余神经系统体格检查基本同入院。2022年2月21日电话随访,患者已从当地医院出院返回家中,目前对症支持为主,已拔除胃管,可经口进食酸奶等半流食,无明显呕吐。患者卧床,间断发热,白天可间断睁眼,仍较躁动,言语含混不清。
两性蛋白于1992年被首次描述,是位于神经末梢突触前膜的细胞内蛋白,直接参与网格蛋白介导的突触囊泡内吞作用,是一种重要的内吞调节蛋白[4, 5]。恶性肿瘤或通过异位表达两性蛋白,体液免疫产生抗两性蛋白抗体,从而对神经元细胞内两性蛋白抗原产生交叉免疫反应;此外,尸检病理研究结果提示可能同时存在细胞毒性T细胞相关的细胞免疫机制[4]。抗两性蛋白抗体通过干扰突触囊泡的内吞作用,使可释放的囊泡池减少,γ-氨基丁酸(GABA)能突触功能受损、抑制作用减弱,导致相应神经系统症状。两性蛋白和GABA能神经元分布广泛,或能解释抗两性蛋白抗体阳性患者较多样的神经系统表现[2]。
抗两性蛋白抗体相关PNS的首次报道是在伴有副肿瘤性僵人综合征的乳腺癌患者中[6]。此后陆续发现了多种抗两性蛋白抗体相关的神经综合征。在2021年最新的PNS诊断标准中,抗两性蛋白抗体相关的神经系统表型包括边缘叶脑炎、多发性神经根神经病、感觉神经病、脑脊髓炎和僵人综合征。本例患者主要表现为脑干脑炎合并小脑功能受损,既往国内外的病例研究中均有抗两性蛋白抗体阳性患者表现为副肿瘤性脑干脑炎、小脑综合征,且同一患者可出现多部位的神经系统症状和体征,包括脑干、小脑及边缘系统[2,7],故考虑本例患者临床表型与抗体相符。
抗两性蛋白抗体阳性患者约80%合并恶性肿瘤,主要为小细胞肺癌和乳腺癌。既往报道的其他合并肿瘤还包括黑色素瘤、非小细胞肺癌、胃癌、食管癌、卵巢癌和宫颈癌,但均仅有1、2例患者的报道[2,8]。我科在2016年曾对13例抗两性蛋白抗体相关副肿瘤神经综合征患者的总结发现,共6例患者存在恶性肿瘤,其中5例为小细胞肺癌,1例为乳腺癌。食管小细胞性神经内分泌癌是一种罕见肿瘤,约占食管恶性肿瘤的0.5%~2.8%[9]。我们仅检索到1例抗两性蛋白抗体阳性患者合并食管癌的报道,其具体病理类型不详[2]。抗Hu抗体相关副肿瘤神经综合征患者中曾有食管小细胞癌的病例报道[10, 11]。本例患者胸、腹及盆腔CT并未发现肿瘤,胃镜下亦未见典型的肿瘤病灶,FDG-PET对其肿瘤的发现、活检定位均起到了重要作用。在神经内分泌肿瘤的病理诊断中,常用的反映神经内分泌和神经分化的标志物包括突触素(synaptophysin)、嗜铬粒蛋白和CD56。Ki-67标记指数则在神经内分泌肿瘤的分级中起重要作用,Ki-67指数>20%提示高级别肿瘤。本例患者病理HE染色见异型小蓝圆细胞浸润,免疫组织化学突触素部分阳性,CD56阳性,Ki-67指数90%,符合神经内分泌癌(小细胞性)诊断。考虑肺外小细胞癌与小细胞肺癌病理学上的一致性,符合2021年PNS诊断标准中与抗体一致的肿瘤[3]。
根据2021年共识,副肿瘤性自身免疫性脑炎往往对基础肿瘤的治疗反应最好,而免疫抑制治疗疗效欠理想[12]。大部分副肿瘤性抗体为神经元胞内蛋白的抗体,其发病机制以T细胞介导的炎症为主,故而此类副肿瘤性脑炎免疫治疗首选糖皮质激素(甲泼尼龙1 g 1次/d,3~7 d),一般不推荐免疫球蛋白和血浆置换;对于糖皮质激素治疗无反应的患者,二线治疗可考虑环磷酰胺[12]。本例患者由于合并肺部感染,存在激素冲击治疗禁忌,故仅使用了中等剂量甲泼尼龙治疗。如前文所述,两性蛋白虽为胞内蛋白,但已有研究者认为两性蛋白抗体在副肿瘤神经综合征的发病机制中可能有重要作用[2,4],故而我们试验性加用了人免疫球蛋白治疗。本例患者经人免疫球蛋白和糖皮质激素联合治疗后,神经系统症状部分改善。但副肿瘤神经综合征患者预后与合并肿瘤密切相关。食管小细胞癌进展迅速预后差,5年总体生存率约为6.7%~18.0%,标准化治疗方案仍存在争议[9]。患者家属最终决定转至当地医院对症支持治疗,目前随访时间距出院仅5个月,需长期随访患者病情及预后。
综上所述,抗两性蛋白抗体相关神经综合征患者筛查肿瘤时,需考虑到肺外神经内分泌癌作为可能的恶性肿瘤之一,FDG-PET对发现此类肿瘤具有重要意义。免疫治疗能帮助部分患者改善神经系统症状,但疾病预后与合并肿瘤密切相关。
所有作者声明不存在利益冲突
None declared



























