
评价急性ST段抬高型心肌梗死(STEMI)患者接受直接经皮冠状动脉介入治疗时机对预后的影响。
连续入选初发急性STEMI患者344例,按照急诊再灌注策略分为3组:未行急诊冠状动脉造影的患者110例为A组,发病至梗死相关血管开通时间在6 h之内的118例为B组,超过6 h而小于12 h的116例为C组,对3组患者临床资料、住院期间心血管事件以及长期预后进行比较。
A、B和C 3组患者血糖分别为(8.4±4.7)mmol/L、(7.7±3.3)mmol/L和(7.7±4.6)mmol/L (P=0.002);血脂异常发生率分别为24.5%、5.9%和33.6% (P=0.008);具有多重心血管危险因素(≥3个)的比例分别为25.5%、9.5%和43.1% (P=0.014);冠状动脉单支病变(25.5%、46.9%和31.4%)、双支病变(33.6%、24.5%和33.3%)以及3支病变(40.9%、28.6%和35.3%)的比例差异有统计学意义(P=0.027);住院期间主要不良心血管事件(MACE)发生率分别为12.7%、2.5%和12.9%(P=0.016)。经过36个月的随访,3组累积MACE发生率分别为20.9%、10.2%和23.3%(P=0.011);Cox回归分析显示年龄、肌酐、入院时心率、前壁心肌梗死和发病至梗死相关血管开通时间>6 h(RR: 2.268, 95% CI: 1.124~4.578,P=0.022)是MACE的独立危险因素。
急性STEMI患者6 h以后开通梗死相关血管未能改善远期预后,应该采取更有效的措施保证其发病6 h内接受再灌注治疗。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
急诊经皮冠状动脉介入术(percutaneous coronary intervention, PCI)已经成为急性ST段抬高型心肌梗死(ST segment elevation myocardial infarction, STEMI)再灌注治疗的主要手段,可以有效开通梗死相关血管(infarct-related artery, IRA),减少梗死面积,降低死亡率。临床指南中推荐急诊PCI作为STEMI症状发生后12 h内首选治疗措施[1]。然而,国内外有关研究表明,冠状动脉闭塞后6 h可存活的心肌仅有16%[2];Sheiban等[3]研究发现,6 h以后再通IRA未能有效挽救濒死心肌;徐广马等[4]研究显示,急诊发病至IRA开通时间>6 h是影响急性STEMI早期预后的独立危险因素。因此,尽管6 h以内开通IRA已经被证实能够显著改善患者长期和短期生存率,但对于急性心肌梗死(AMI)发病6~12 h的患者,行急诊PCI能否显著改善患者的预后尚存疑问。本研究收集首都医科大学宣武医院初发STEMI患者临床资料并进行分析,评价STEMI患者直接PCI时机对长期预后的影响。
连续入选2009年4月26日至2010年8月15日入住首都医科大学宣武医院心脏监护病房344例STEMI患者,发病时间超过12 h未行急诊冠状动脉造影而行择期冠状动脉造影及PCI的患者110例为A组,发病至IRA开通时间在6 h之内的118例为B组,超过6 h而小于12 h的116例为C组。
(1)通过询问病史及病例资料取得基线资料:年龄、收缩压、舒张压、心率、疾病史(糖尿病、高血压、血脂异常、吸烟、冠心病早发家族史); (2)实验室检查:入院24 h内清晨空腹采集静脉血测量白细胞计数、低密度脂蛋白胆固醇(LDL-C)、肌酸激酶同工酶(CK-MB)峰值、血糖、血肌酐,入院24 h内超声心动图测量左心室射血分数;(3)住院期间主要不良心脏事件(major adverse cardiovascular events, MACE):心原性死亡、心肌梗死、支架内血栓形成和再狭窄。
STEMI诊断标准:典型胸痛或其他非典型症状发作≥30 min;心电图≥2个相邻胸前导联ST段抬高≥0.2 mV、肢体导联≥0.1 mV或者新出现的左束支传导阻滞;CK-MB≥正常上限的2倍;满足上述两个条件即可诊断。排除标准:因侵入性诊疗操作引发冠状动脉血流中断引起的心肌梗死;既往有心肌梗死病史;并非动脉粥样硬化,而是其他疾病导致冠状动脉血流中断所致的AMI。
糖尿病诊断标准:空腹血糖≥7.0 mmol/L 2次以上和(或)正在进行降糖治疗。
高血压诊断标准:血压≥140/90 mmHg,或者正在进行降压治疗。
采用标准的经右股动脉径路(Judkins法)或经右侧桡动脉径路。对所有患者进行急诊CAG或择期CAG,每个病变均由相互垂直的两个以上投照体位来确定,由两名介入心脏病医师来判定,狭窄程度按冠状动脉内径狭窄来表示。计算冠状动脉病变数按左冠状动脉前降支(left anterior descending, LAD)、左冠状动脉回旋支(left circumflex branch, LCX)及右冠状动脉(right coronary artery, RCA)3个系统,对角支病变计入LAD,钝圆支病变计入LCX,左室后支和后降支病变计入RCA。
干预策略:AMI存在多支病变时,急诊PCI仅干预IRA,择期干预非梗死血管;A组患者择期第1次仅干预IRA,第2次再干预非IRA。按常规方法操作:经动脉鞘送入指引导管及0.014英寸冠状动脉导丝至IRA远端,对IRA高血栓负荷患者应用血栓抽吸导管反复抽吸血栓至血栓影消失或减少,前向血流改善,根据血管病变情况使用球囊扩张后置入药物洗脱支架或进行直接药物洗脱支架置入术。
随访方式:定期电话随访和门诊随访;患者出院之日为随访起点;随访终点:出现MACE,患者出现MACE并发生心原性死亡时随访结束。随访36~60个月,中位数时间为36个月。
所有统计分析使用SPSS 13.0软件,计量资料用 ±s表示,正态分布资料采用先行方差检验再行t检验,非正态分布资料采用秩和检验;计数资料用率表示,采用χ2检验;患者出院后随访36个月的MACE发生和死亡/心肌梗死发生率比较采用生存分析Kaplan-Meier法;使用多变量的Cox回归分析多个变量与长期预后的关系。以P<0.05为差异有统计学意义。
±s表示,正态分布资料采用先行方差检验再行t检验,非正态分布资料采用秩和检验;计数资料用率表示,采用χ2检验;患者出院后随访36个月的MACE发生和死亡/心肌梗死发生率比较采用生存分析Kaplan-Meier法;使用多变量的Cox回归分析多个变量与长期预后的关系。以P<0.05为差异有统计学意义。
3组患者血糖、血脂异常、具有多重危险因素(≥3个危险因素)、病变血管支数比较,差异有统计学意义(均为P<0.05),见表1。
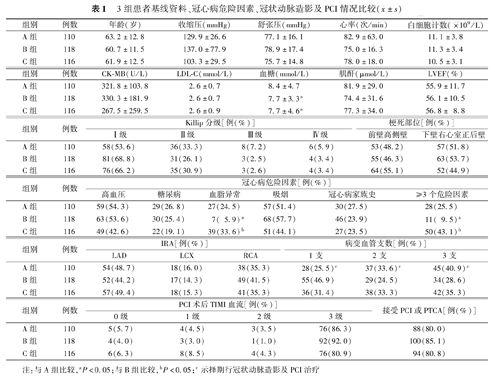
3组患者基线资料、冠心病危险因素、冠状动脉造影及PCI情况比较( ±s)
±s)
3组患者基线资料、冠心病危险因素、冠状动脉造影及PCI情况比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 收缩压(mmHg) | 舒张压(mmHg) | 心率(次/min) | 白细胞计数(×109/L) |
|---|---|---|---|---|---|---|
| A组 | 110 | 63.2±12.8 | 129.9±26.6 | 77.1±16.1 | 82.9±63.0 | 11.1±3.8 |
| B组 | 118 | 60.7±11.5 | 137.0±77.9 | 78.9±17.4 | 75.0±16.3 | 11.3±3.4 |
| C组 | 116 | 61.9±12.5 | 103.3±29.5 | 75.7±14.8 | 78.0±18.0 | 10.5±3.1 |
| 组别 | 例数 | CK-MB(U/L) | LDL-C(mmol/L) | 血糖(mmol/L) | 肌酐(μmol/L) | LVEF(%) |
|---|---|---|---|---|---|---|
| A组 | 110 | 321.8±103.8 | 2.6±0.7 | 8.4±4.7 | 81.9±29.0 | 55.9±11.7 |
| B组 | 118 | 330.3±181.9 | 2.6±0.7 | 7.7±3.3a | 74.4±31.6 | 56.1±10.5 |
| C组 | 116 | 267.5±259.5 | 2.6±0.9 | 7.7±4.6a | 77.3±34.0 | 56.8± 8.8 |
| 组别 | 例数 | Killip分级[例(%)] | 梗死部位[例(%)] | ||||
|---|---|---|---|---|---|---|---|
| Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 前壁高侧壁 | 下壁右心室正后壁 | ||
| A组 | 110 | 58(53.6) | 36(33.3) | 8(7.2) | 6(5.9) | 53(48.2) | 57(51.8) |
| B组 | 118 | 81(68.8) | 31(26.1) | 3(2.5) | 4(3.4) | 55(46.3) | 63(53.7) |
| C组 | 116 | 76(66.2) | 35(30.9) | 3(2.6) | 4(3.4) | 64(55.1) | 52(44.9) |
| 组别 | 例数 | 冠心病危险因素[例(%)] | |||||
|---|---|---|---|---|---|---|---|
| 高血压 | 糖尿病 | 血脂异常 | 吸烟 | 冠心病家族史 | ≥3个危险因素 | ||
| A组 | 110 | 59(54.3) | 29(26.8) | 27(24.5) | 57(51.4) | 30(27.5) | 28(25.5) |
| B组 | 118 | 63(53.6) | 30(25.4) | 7( 5.9)a | 68(57.7) | 46(23.9) | 11( 9.5)a |
| C组 | 116 | 49(42.6) | 22(19.1) | 39(33.6)b | 51(44.1) | 27(23.5) | 50(43.1)b |
| 组别 | 例数 | IRA[例(%)] | 病变血管支数[例(%)] | ||||
|---|---|---|---|---|---|---|---|
| LAD | LCX | RCA | 1支 | 2支 | 3支 | ||
| A组 | 110 | 54(48.7) | 18(16.0) | 38(35.3) | 28(25.5)c | 37(33.6)c | 45(40.9)c |
| B组 | 118 | 52(44.2) | 17(14.3) | 49(41.5) | 55(46.9) | 29(24.5) | 34(28.6) |
| C组 | 116 | 57(49.4) | 18(15.3) | 41(35.3) | 36(31.4) | 38(33.3) | 42(35.3) |
| 组别 | 例数 | PCI术后TIMI血流[例(%)] | 接受PCI或PTCA[例(%)] | |||
|---|---|---|---|---|---|---|
| 0级 | 1级 | 2级 | 3级 | |||
| A组 | 110 | 5(5.7) | 4(4.5) | 3(3.5) | 76(86.3) | 88(80.0) |
| B组 | 118 | 4(4.0) | 3(3.0) | 1(1.0) | 92(92.0) | 100(85.1) |
| C组 | 116 | 6(6.3) | 8(8.5) | 4(4.3) | 76(80.9) | 94(80.8) |
注:与A组比较,aP<0.05;与B组比较,bP<0.05;c示择期行冠状动脉造影及PCI治疗
住院期间MACE发生率:A组12.7%、B组2.5%和C组12.9%(P=0.016),3组之间两两比较:A组与B组、B组与C组比较差异有统计学意义(P=0.008和P=0.006),A组与C组比较差异无统计学意义(P=0.924,见表2)。住院期间死亡率:A组10.9%、B组2.5%和C组8.6%(P=0.017),3组之间两两比较:A组与B组、B组与C组比较差异有统计学意义(P=0.006和P=0.037),A组与C组比较差异无统计学意义(P=0.497,表2)。
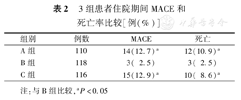
3组患者住院期间MACE和死亡率比较[例(%)]
3组患者住院期间MACE和死亡率比较[例(%)]
| 组别 | 例数 | MACE | 死亡 |
|---|---|---|---|
| A组 | 110 | 14(12.7)a | 12(10.9)a |
| B组 | 118 | 3( 2.5) | 3( 2.5) |
| C组 | 116 | 15(12.9)a | 10( 8.6)a |
注:与B组比较,aP<0.05
3组患者出院后随访累积MACE发生率分别为A组20.9%、B组10.2%和C组23.3%(图1),差异有统计学意义(P=0.011)。3组患者出院后累积死亡/心肌梗死联合终点事件发生率分别为A组11.8%、B组2.5%和C组10.3%(图2),差异有统计学意义(P=0.021)。
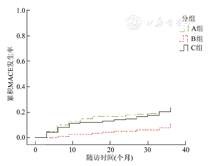

3组累积MACE发生率比较,P=0.011;A组与B组比较,P=0.004;B组与C组比较,P=0.016;A组与C组比较,P=0.428
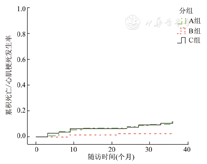

3组累积死亡/心肌梗死发生率比较,P=0.021;A组与B组比较,P=0.007;B组与C组比较,P=0.012;A组与C组比较,P=0.896
进入Cox比例风险回归模型的变量包括:年龄、入院时心率、射血分数、血肌酐、急诊PCI时机、吸烟、高血压病史、糖尿病病史。进行Cox回归分析显示发病至IRA开通时间>6 h(RR=2.268,95%CI:1.124~4.578,P=0.022)增加STEMI患者MACE的发生,见表3。
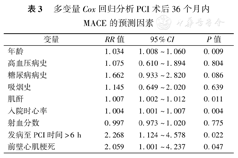
多变量Cox回归分析PCI术后36个月内MACE的预测因素
多变量Cox回归分析PCI术后36个月内MACE的预测因素
| 变量 | RR值 | 95%CI | P值 |
|---|---|---|---|
| 年龄 | 1.034 | 1.008~1.060 | 0.009 |
| 高血压病史 | 1.075 | 0.610~1.894 | 0.804 |
| 糖尿病病史 | 1.662 | 0.933~2.820 | 0.086 |
| 吸烟史 | 1.145 | 0.649~2.020 | 0.639 |
| 肌酐 | 1.007 | 1.002~1.012 | 0.011 |
| 入院时心率 | 1.004 | 1.001~1.007 | 0.004 |
| 射血分数 | 0.997 | 0.973~1.020 | 0.775 |
| 发病至PCI时间>6 h | 2.268 | 1.124~4.578 | 0.022 |
| 前壁心肌梗死 | 2.059 | 1.001~4.237 | 0.047 |
近年来,随着急诊PCI的广泛开展,STEMI患者在随机临床试验中的早期病死率明显下降。急诊再灌注治疗的获益与IRA开通是否及时显著相关。Hochman等[5]研究发现,AMI<6 h行急诊PCI的患者30 d病死率比内科稳定组同类患者显著降低。尽管指南推荐12 h以内的STEMI患者均应接受再灌注治疗,但本研究显示,STEMI患者未行急诊PCI和发病至IRA开通时间>6 h者住院期间和长期MACE发生率较6 h内接受再灌注治疗的患者显著增高;其中,未行急诊PCI者远期MACE发生是发病至IRA开通时间<6 h者2.059倍,发病至IRA开通时间>6 h者是<6 h者2.268倍。提示发病至IRA开通时间在6~12 h的急诊PCI并未带来远期预后的获益。其原因可能是:(1)6 h以后绝大多数心肌细胞已经发生坏死,因此开通IRA后挽救的濒死心肌极其有限,导致获益不明显。Sheiban等[3]研究发现,在心肌梗死发病4 h内行冠状动脉成形术(percutaneous coronary angioplasty, PTCA)使冠状动脉再通能明显挽救心肌功能,6 h后再通的意义仅在于防止左心室重构。Terkelsen和Sorensen[6]研究表明,再灌注时间与患者死亡率呈正相关,随着症状至球囊扩张时间的延误,病死率增加,每延误60 min,死亡相对危险为1.10;徐广马等[4]研究显示,急诊PCI术后30 d死亡率的多变量Logistic回归分析中发病至IRA开通时间>360 min与死亡密切相关(RR:1.530,95%CI: 1.250~2.840,P<0.001);发病至IRA开通时间>6 h是影响急性STEMI早期预后的独立危险因素。(2)6~12 h开通IRA,容易出现无复流或慢血流,Zhao等[7]研究发现,发病至IRA开通时间在12 h内与无复流或慢血流呈正相关,Logistic回归分析显示再灌注时间(OR=1.600,95%CI: 1.020~2.730)是PCI术后发生无复流或慢血流的独立危险因素。本研究显示,B组PCI术后无再流或慢血流的发生率为8.0%,而C组为19.1%,表明发病至IRA开通时间>6 h组无再流及慢血流发生率较<6 h组高。由于急诊PCI术后血流未达TIMI 3级是未来心血管事件的独立危险因素,因此,两组预后的差异可能与术后血流恢复的程度有关;结果与文献报道类似。
Müller等[8]报道1 146例急诊PCI患者IRA开通中位数时间为168 min,四分位间距为(119~245)min,住院期间总死亡率4.3%。本研究显示,IRA开通中位数时间为285 min,四分位间距为(212~386)min,长于文献报道[8],住院期间总死亡率7.6%也高于文献报道[8];B组死亡率明显低于C组,结果与文献报道一致。因此,我们的数据显示,AMI的再灌注治疗仍然存在着明显的延迟,而且有相当一部分患者由于各种原因未能接受再灌注治疗。因此,对STEMI患者应采取一切措施缩短自胸痛或其他症状出现至有效再灌注(包括急诊PCI和溶栓)实施的时间,尤其是发病时间接近6 h就诊的患者,更应该积极采取有效的再灌注措施来缩短IRA开通的时间。
本研究Cox回归分析中也提到了与预后相关的变量:入院时心率、肌酐和年龄。心率是心肌耗氧量的主要决定因素,在AMI急性期心率增加反映了交感神经、内分泌功能紊乱,影响心肌灌注,加重心肌再灌注损伤,是影响AMI患者预后的重要因素;本研究提示肾功能不全与STEMI患者的MACE和死亡相关,表明肾功能不全对STEMI患者预后的影响独立于其他因素之外,这可能与肾功能不全特有的病理生理学状态如血液高凝、炎症、氧化应激、钙磷代谢障碍、血脂异常、贫血、高半胱氨酸血症、低蛋白血症、蛋白尿、血尿酸升高等有关,这些因素加速动脉粥样硬化和内皮功能受损,增加心血管事件的风险。Stebbins等[9]研究显示,心率每增加10次/min对STEMI患者的90 d死亡率风险增加1.45倍,而肌酐超过90 μmol/L者每增加10 μmol/L死亡风险增加1.23倍,对于年龄每增加10岁其死亡风险增加2.03倍。本研究与此结果类似。
本研究属单中心、非随机化分组、小样本的研究,且研究中患者依从性差,可能会影响AMI患者IRA的及时开通;此外本文未对急诊PCI延迟原因和未行急诊PCI原因进行分析。综上所述,AMI的再灌注治疗仍然存在显著的延迟,尽可能保证STEMI患者在6 h内开通IRA,是患者长期获益的前提。






























