
除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
1-磷酸鞘氨醇(sphingosine 1-phosphate, S1P)是近年来发现的在心血管研究中具有重要生理功能的一种膜磷脂类代谢产物。S1P通过与细胞表面的受体即1-磷酸鞘氨醇受体(sphingosine-1-phosphate receptos,S1PRs)作用而发挥其广泛的生物学效应。S1PR是G蛋白耦联受体家族成员之一,包括S1PR1、S1PR2、S1PR3、 S1PR4、S1PR5,这些受体主要与G蛋白α亚基耦联而发挥不同的生物学功能[1]。S1P对心血管系统发挥重要的生物学功能,如血管发生、内皮保护、心肌缺血再灌注损伤、抑制黏附分子表达、免疫功能等,这些都与细胞内信号密切相关。本文将讨论S1PR2在心血管系统中的作用。
S1PR2广泛表达于各种组织和细胞中,在成年鼠的许多器官如心、肺、脑、肝、肾、脾和其他组织中都能观察到S1PR2的表达。在人血管细胞和单核巨噬细胞、血管内皮细胞、平滑肌细胞均表达S1PR2。S1PR2的功能是多方面的,可影响心脏的发育、免疫系统以及抑制神经突触物的产生等[2]。如研究斑马鱼突变的S1PR2类似受体时,发现其对心脏中间线两侧组织形成关系密切;敲除S1PR2基因能显著提高皮质锥形神经元的兴奋性;S1PR2的缺失可引起耳聋[3]。
见图1。S1PR2的特性是复杂的,它具有调节多种细胞的增殖、生存及迁移等功能。S1PR2与G蛋白不同的α亚基耦联激活不同的信号途径而发挥不同的生物学功能,已证明S1PR2主要结合Gαi、Gαq和Gα12/13蛋白[4]。目前认为,S1PR2能够首先激活Gα12/13途径来调节多种关键细胞内信号通路,诸如Rho GTP酶和Rho相关蛋白激酶ROCK,还可抑制Rac途径,抑制细胞的迁移。有研究证实S1P诱导GTP- RhoA的大量增长,Rac的细胞抑制,以及细胞的迁移是通过S1PR2/Gα12/13/Rho这条通路来实现的[5]。S1PR2激活Gαi可导致① PI3K/Rac途径激活,促进细胞骨架结构重排和迁移;②PI3K/Akt途径激活,促进NO合酶磷酸化,舒张血管,抑制细胞凋亡和炎症反应等;③Ras/ERK/MAPK途径激活,调控血管发生发育和免疫细胞迁移促进增殖;④磷脂酶C(phospholipase C,PLC)途径激活,可增加细胞内钙离子浓度,引起血管收缩。S1PR2与Gαq蛋白耦联主要激活PLC途径,调节肌醇三磷酸的形成和增加细胞内钙离子浓度。还能激活PKC和下游的信号通路,NF-κB就是其中的一条通路。
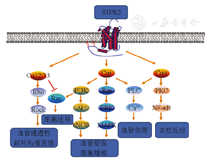

S1PR2 ; Gα12/13、Gαi、Gαq: G蛋白;Rho: Rho蛋白激酶;PI3K:磷脂酰肌醇3-激酶;Rac: Rac蛋白激酶;Akt:蛋白激酶B ; eNOS:内皮型一氧化氮合酶;Ras:Ras蛋白激酶;ERK:胞外信号调节激酶; PLC:磷脂酶C; PKC:蛋白激酶C;NF-κB:核因子κB
S1PR2在调控血管的通透性、血管的紧张度等方面具有重要的作用,它通过影响血管内皮细胞屏障的通透性、平滑肌细胞的迁移功能、血管的发生发育等影响血管稳态和促进炎症反应,进而对心血管系统发挥重要影响。
内皮细胞屏障功能的障碍和血管通透性的升高是急慢性炎症性病理变化的始动环节和标志性事件。内皮细胞中普遍存在S1PR1、2受体,S1P与S1PR1结合后主要通过激活Rac通路,Rac的激活可增强内皮细胞的屏障功能。S1PR1和S1PR3在内皮细胞中还可激活PI3K/Akt信号通路,促进NO合酶的磷酸化,起到舒张血管、抑制炎症反应等作用[6]。总之,S1PR1和S1PR3可以保护血管内皮的正常功能。而S1P与S1PR2结合后通过激活GTP/Rho/p160-ROCK途径显著地抑制了S1P诱导内皮细胞的迁移和蛋白激酶B/Akt的磷酸化,还可引起细胞内钙离子浓度升高,使内皮细胞的通透性增高,导致内皮屏障功能的降低[7]。同时,内皮细胞中S1PR2还可以使血管的紧张度增高、参与血管收缩药的作用[8]。有研究报道从年轻的和老龄的大鼠体内分离出来的肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMECs),发现来源于老龄大鼠的PMECs中S1PR2的表达是显著增加的。老龄大鼠PMECs的成管能力、损伤愈合能力和趋化性却明显低于年轻大鼠的PMECs;下调该细胞的S1PR2,其上述能力得以恢复[9]。此外,有研究报道脂多糖和肿瘤坏死因子诱导的肿胀和水肿产生皮肤微血管通透性增加,也归因于S1PR2表达的增加[12]。这些都表明S1PR2的高表达会影响血管内皮细胞的正常功能。
血管平滑肌细胞的迁移和过度增殖是影响心血管的重要步骤。有研究报道S1PR2对肌肉细胞具有趋化性,可引起平滑肌细胞的增殖,分化和收缩[10]。相关的研究观察发现S1P对肿瘤细胞、血管内皮细胞和血管平滑肌细胞都具有促进和抑制迁移的双重作用。有研究表明S1PR1和S1PR3是趋化受体,能够诱导血管平滑肌细胞的迁移,而S1PR2是趋化抑制受体,介导对迁移的抑制[10,11]。进一步对大鼠主动脉血管平滑肌细胞研究的报道提出,S1P通过S1PR2及其耦联的Gα12/13和Gαq,激活小GTP酶Rho,抑制血管平滑肌的迁移和增殖[10,12]。在血管内膜病变中,通常可观察到平滑肌细胞的增殖和迁移的增加,这是由于Rho依赖诱导动脉平滑肌细胞的增殖和分化,这增加了血管的阻塞和血栓的形成。因此,S1PR2的激活被认为是有益于阻止这些病变的形成和生长,提示S1PR2在血管平滑肌细胞里对心血管系统具有保护的作用。
在血管新生中,敲除S1PR2的基因对鼠的表型基本没有影响,S1PR2对正常的血管发育也没有明显的影响[13]。但在一些病理条件下,S1PR2却能明显影响血管的形成和发育。如敲除小鼠的S1PR2基因,缺氧诱导的小鼠玻璃体内新生的血管形成明显减少,但视网膜内血管的再生却相对增加[14]。研究还发现S1PR2-/-鼠移植的Lewis肺癌或B16黑色素瘤具有更快的肿瘤生长和血管生成速度[15],提示S1PR2具有负性调节肿瘤血管生成和肿瘤生长的作用。进一步的研究发现S1PR2-/-的内皮细胞和肿瘤细胞一起注入WT鼠的体内,肿瘤的生长和血管发生都相对增强;S1PR2-/-鼠也较其WT鼠具有更高效的募集CD11b阳性的骨髓源细胞到肿瘤位置的能力。这些结果表明,S1PR2在内皮细胞和骨髓源细胞上具有抑制肿瘤血管发生的能力[16]。
动脉粥样硬化(atherosclerosis,AS)的形成、发展与并发症的出现,都与血管内的炎症细胞反应有关。S1PR1可抑制白细胞黏附聚集到内皮,进而抑制血管炎症反应、平滑肌细胞增殖以及脂质斑块的生成等,提示S1PR1可抑制炎症的发生,起到抑制AS的发生发展的作用[6]。S1PR2具有明显的促AS作用[17]。目前已证实S1PR2参与炎症反应。敲除S1PR2的小鼠,内毒素诱导的炎性细胞因子IL-β和IL-18在血清中的水平显著降低。而且,野生型的小鼠用S1PR2的抑制剂JTE-013处理后,则抑制了血浆中IL-β和IL-18的水平[17]。IL-β和IL-18对人血管平滑肌细胞具有趋化活性,可刺激血管平滑肌细胞向内皮迁移,从而参与AS的形成。巨噬细胞的炎症活动在动脉粥样斑块的形成中具有重要的作用,有研究者发现apoE-/-S1PR2-/-鼠巨噬细胞的炎症活动与apoE-/-S1PR2+/+鼠相比较,明显受到抑制,AS斑块面积和脂质沉积量也明显减少。进一步的研究发现,apoE-/-S1PR2-/-鼠血管壁中的巨噬细胞明显减少了,提示S1PR2调节了斑块中的巨噬细胞滞留。在S1PR2-/-的巨噬细胞中,炎性介质如IL-6、TNF-α、IFN-γ、MCP-1等以及黏附分子如血管内皮细胞黏附分子1 (vascular cell adhesion molecule 1,VCAM-1)的表达减少,吞噬氧化低密度脂蛋白数量减少,刺激胆固醇的流出增加[18]。表明S1PR2可以起到促进血管炎症反应的作用。有研究显示,S1PR2通过S1PR2/Gα12/13/cAMP/PKA信号通路来抑制体内巨噬细胞的迁移,但对迁移的方向并无影响[19]。在内皮细胞中,S1PR2通过激活NF-κB信号通路诱导TNF-α的表达,促进VCAM-1和ICAM-1的释放[20]。
S1PRs是S1P发挥生物学作用的主要途径,干预S1PRs更是开发药物和研究S1P作用机制的重要靶点。S1PR1和S1PR3的激动剂FTY720能够在多种动物器官移植模型中显示出明显的免疫抑制作用,减轻免疫排斥反应,延长移植物及移植受体的存活时间。已有学者初步研究了FTY720在造血干细胞移植中的作用,其作为治疗多发性硬化症的药物已完成临床研究。S1PR1的特异性激动剂SEW-2871等已作为免疫抑制剂应用于异体移植Ⅲ期临床试验。有研究显示S1P和S1PR2受体拮抗剂JTE-013联合局部注射可促进糖尿病小鼠的伤口愈合,这可能与促进肉芽组织血管生成,增强成纤维细胞化学趋化性等有关[21]。也有研究报道S1PR2的特异性抑制剂JTE-013使神经祖细胞向大脑的梗死区域的迁移显著增加。因此,JTE-013对卒中的患者可以作为一个新的药物靶点。有观察发现,敲除S1PR2或S1PR3基因的小鼠其心脏缺血/再灌注损伤的面积与野生型小鼠相比较没有明显变化。同时敲除小鼠S1PR2和S1PR3基因,观察到心肌缺血/再灌注损伤面积相对于野生型小鼠明显增加,表明S1PR2和S1PR3在心肌保护方面具有协同作用,这种效应可能与S1PR2和S1PR3依赖的AKT/eNOS/NO信号通路有关[22]。S1PR2还可通过调节血管的紧张度,调节血管的稳态等对心血管免疫系统发挥重要影响。最近的研究还发现S1PR2的拮抗剂可抑制肾小动脉血管的收缩起到对肾脏的保护作用[23]。
S1PR2在心血管系统中发挥着重要的作用。它调节内皮细胞的通透性、抑制血管平滑肌细胞的迁移和增殖、对一些病理条件下的血管新生和发育发展的机制密切相关、尤其是影响AS等的病理生理过程。然而,它在心血管系统的作用机制极其复杂,还有大量的S1PR2功能需要进一步研究探讨才能阐明和应用。尽管如此,对其特异性的受体激动剂、拮抗剂的研发,未来可能成为新的研究热点,并很可能作为治疗抗AS等心血管相关疾病的新型药物应用于临床。


























