
除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
负荷超声心动图检查对于冠心病患者具有重要的诊断和预后意义。负荷超声心动图常用负荷方法包括运动负荷和药物负荷。负荷超声心动图的综合敏感性、特异性及预测值>80%。其中多巴酚丁胺负荷超声心动图是公认的检测存活心肌的方法之一。对比观察负荷超声心动图静息状态和负荷状态的室壁反应类型,可以推测相应的临床状况:①没有冠心病或可能性很小;②心肌缺血;③心肌梗死,没有存活心肌;④冬眠心肌、顿抑心肌等(表1)[1]。
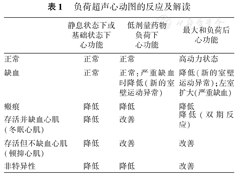
负荷超声心动图的反应及解读
负荷超声心动图的反应及解读
| 静息状态下或基础状态下心功能 | 低剂量药物负荷下心功能 | 最大和负荷后心功能 | |
|---|---|---|---|
| 正常 | 正常 | 正常 | 高动力状态 |
| 缺血 | 正常 | 正常:严重缺血时降低(新的室壁运动异常) | 降低(新的室壁运动异常);左室扩大(严重缺血) |
| 瘢痕 | 降低 | 降低 | 降低 |
| 存活并缺血心肌(冬眠心肌) | 降低 | 改善 | 降低(双期反应) |
| 存活但不缺血心肌(顿抑心肌) | 降低 | 改善 | 改善 |
| 非特异性 | 降低 | 降低 | 改善 |
对比超声心动图最初用于检查心内分流。随着技术的进步,目前静脉使用的造影剂与超声心动图相结合在临床工作中使用越来越广泛,对冠心病心肌缺血和心肌梗死的诊断和预后都有重要的意义。对比超声心动图提高了冠心病的诊断敏感性,荟萃分析显示,与冠脉造影诊断冠心病相比,对比超声心动图诊断冠心病的敏感度可达83%(95%CI:78%~88%),特异度80%(73%~87%),对比超声心动图诊断冠心病的敏感性高于心肌核素SPECT[2]。对比超声心动图明显增强心内膜边界的清晰程度,更有利于对整体和局部左室收缩功能的评价,有利于清楚显示左心室血栓;同时,对比超声心动图可以评价心肌灌注以及微循环的情况(心肌活性),提供关于心肌活性的有价值信息,对于临床预后的判断有重要价值。
心内膜边界的识别:造影剂充填心腔可以更加清晰地显示心内膜边界,因此可以使左心室容量和左室射血分数(LVEF)评价的重复性更好,对于节段性室壁运动异常的评价也更为准确。Malm等[3]在110例患者中,采用对比超声心动图和超声心动图谐波显像测量左心室容量、LVEF,评价其重复性和准确性,以磁共振(MRI)作为独立的"金标准"。结果发现:超声心动图谐波显像低估左心室容量,对比超声心动图可以减轻此低估。当使用造影剂时超声心动图测量的左心室容量和LVEF与MRI测量值之间的差异更小。
Reilly等[4]在70例声窗欠佳的重症监护室患者中评价对比超声心动图发现左室节段室壁运动异常的情况。采用16节段模型,分别观察标准超声心动图显像、谐波超声心动图显像和对比超声心动图三种不同条件的室壁运动。发现标准超声显像显示的无法判断的节段为5.4段/例患者,谐波超声显像为4.4段/例患者(P=0.2),对比超声心动图为1.1段/例患者(P<0.0001)。肯定诊断的节段标准超声显像平均为7.8段,谐波超声显像平均为9.2段(P=0.1),对比超声心动图为13.7段(P<0.0001)。所以,在声窗不佳的患者,对比超声心动图可以明显提高评价左心室功能和室壁运动的准确性。
心肌活性的判断:对比超声心动图除了可以增强心内膜边界的清晰程度和清楚显示左心室血栓外,还可以评价心肌灌注以及微循环的情况(心肌活性)。最初的动物试验采用对比超声心动图评价灌注缺损。Cheirif等[5]研究15条开胸的犬,冠状动脉短时结扎,对比超声心动图发现14条犬有灌注缺损,且与心肌核素显示的缺损范围一致性很好(r=0.58,P<0.05)。Meza和Kaul等[6,7]的研究也发现对比超声心动图和心肌核素二者在判断心肌活性方面有非常好的一致性。一项荟萃了20项研究共738例患者的报告中,对比超声心动图预示心肌活性的敏感性为85%,特异性为70%[2]。
心肌梗死后预测心肌功能的恢复:针对心肌梗死患者的随访发现,心肌梗死后心肌灌注缺损的程度和严重性与心肌功能恢复的可能性呈负相关[8,9,10]。如果心肌梗死患者存在较大的灌注缺损(预示心肌没有活性),其以后心肌功能恢复的可能性很小。如果节段性室壁运动异常的区域有潜在的灌注(说明有存活心肌),则在今后的随访中这种心肌的功能常常能够恢复[8,9]。Main等[10]研究了35例急性心肌梗死的患者,心肌梗死2 d后行静息二维超声心动图检查判断节段性室壁运动异常,随后行对比超声心动图检查判断灌注情况,2个月后检查心肌功能恢复情况。发现90%室壁运动异常但有灌注的节段在随访中功能都有所恢复。
Janardhanan等[11]发现对比超声心动图可以预测心肌梗死再灌注患者心肌功能恢复的情况。50例心肌梗死以后7~10 d的患者接受了对比超声心动图检查。基线评估室壁增厚和增厚指数的情况,3个月后再次评估。发现84%心肌有灌注的节段功能恢复较好,而93%灌注缺损明显的节段功能恢复欠佳。多因素分析显示对比超声心动图结果可以独立预测心肌功能的恢复。
Ito等[12]研究了39例急性前壁心肌梗死行急诊PCI的患者,PCI后即刻行对比超声心动图检查,PCI后1 d和1个月分别检测LVEF。对比超声心动图显示30例(77%)患者的梗死相关节段存在灌注。其余9例(23%)患者梗死相关部分显示灌注缺损。有灌注的患者基线LVEF高。随访期间,LVEF在有灌注的患者较灌注减低或缺损的患者明显提高(有灌注的患者LVEF基线42.3%,提高到56.4%,P<0.001;灌注减低或缺损的患者LVEF基线34.7%,随访后42.7%,相比没有差别)。此研究表明对比超声心动图显示的急性心肌梗死患者成功PCI后的灌注情况可以预测该患者整体心功能的恢复。
有研究显示,急性心肌梗死后心肌灌注缺损的严重程度和以后心室扩张重构相关。在急性心肌梗死造影研究(AMICI)中,Galiuto等[13]研究了110例首次ST段抬高心肌梗死并成功灌注治疗的患者。成功急诊PCI后,评价肌酸激酶、ST段回落、TIMI血流和心肌呈色分级等指标。灌注治疗后1 d对比超声心动图评估灌注缺损(没有活力的心肌)情况。6个月后随访观察室壁运动积分指数(WMSI),室壁运动异常的程度、左室舒张末期容积(LVEDV)和LVEF等指标。6个月随访时发现,27例(25%)患者有左室重构。多因素分析显示,只有TIMI血流<3级和对比超声心动图显示的灌注缺损是左室重构的独立危险因素。
急性心肌梗死后的预后意义:多个研究显示了对比超声心动图在急性心肌梗死后的预后意义。心肌灌注减低与预后不良相关。Khumri等[14]研究发现首次前壁心肌梗死灌注异常的患者在长期随访中有死亡的高危险性。该研究者对167例急性前壁心肌梗死入院2 d的患者行对比超声心动图检查,计算其灌注积分指数,平均随访39个月,发现灌注积分指数是死亡的强预测因子,并且在临床表现和血管造影参数等基础上提供进一步的预后价值。Dwivedi等[15]进一步证实了对比超声心动图的预后意义。Dwivedi等[15]研究了95例急性心肌梗死后病情稳定的患者,在发病后7 d行对比超声心动图检查。在随访的46个月的时间中,发生15宗事件(8宗心原性死亡,7宗非致死性心肌梗死)。在临床特征、生化检查、心电图、超声心动图和冠脉造影等众多有关预后的指标中,对比超声心动图结果独立预测心脏死亡(P=0.01)和心脏性死亡或急性心肌梗死(P=0.002)。
彩色多普勒技术的进步使得评价冠状动脉血流(冠脉血流储备CFR)成为可能,特别是针对前降支的血流评价。CFR定义为最大充血状态下舒张期血流速度(腺苷注射后)与静息状态下舒张期血流速度的比值。无创性评价CFR对稳定性冠心病和急性心肌梗死的患者均提供了重要的诊断和预后信息。
Voci等[16]证实经胸超声心动图评价CFR是可行的。他们的研究共入选44例不同严重程度的冠心病患者,检查前降支和后降支的CFR情况。根据冠脉造影,患者分为3组:1组(0%~29%狭窄),2组(30%~69%狭窄),3组(≥70%狭窄)。前降支1组平均CFR为3.31(SD:0.54,15例患者),2组为2.49(SD:0.71,10例患者),3组1.12(SD:0.49,19例患者,P<0.0001);后降支CFR1组为2.62(SD:0.25,17例患者),2组2.33(SD:0.32,9例患者),3组1.40(SD:0.54,18例患者,P<0.0001)。CFR<2在前降支和后降支均可识别≥前降支狭窄。
同时,Rigo等[17,18]的研究也证实,负荷超声心动图阴性但确诊或怀疑冠心病的患者,CFR检查可以对预后分层提供额外的信息,CFR减低的患者长期预后欠佳。
有关急性心肌梗死后早期CFR价值的研究还不是很多,但是目前有证据表明急性心肌梗死后前降支CFR与受损心肌的活性相关。Ueno等[19]研究了29例急性前壁心肌梗死并成功PCI的患者,经胸超声心动图评价静息和三磷腺苷负荷后前降支远端的血流速度,分别在再血管化后即刻和24 h计算冠状动脉的血流储备。同时在再血管化之前和出院时[心肌梗死后(20 d)]观察节段性室壁运动异常并计算WMSI。再血管化后即刻和24 h的冠脉血流速度储备与出院时WMSI显著相关(分别为r=-0.58,P<0.001和r=-0.80,P<0.0001)。再血管化后24 h的冠脉血流储备预测存活心肌的最佳界值为1.5,敏感度达94%,特异度91%。其他的研究也显示急性心肌梗死后早期评价的CFR与以后心肌活性相关[20]。
三维超声心动图在临床工作中的应用越来越广泛,特别是在左心室容量和射血分数的评价中。对于节段性室壁运动异常的患者,左心室形状不规则,3D超声心动图可以提供准确的左室容量和LVEF的信息[21]。
3D超声心动图在预示急性心肌梗死后左心室扩张方面发挥了作用。Mannaerts等[22]评价了33例急性心肌梗死的患者,分别在基线时(心肌梗死后6 d)和6个月以及12个月时进行3D超声心动图检查。将LVEDV增加≥20%作为左心室重构的标准。3D超声心动图计算的球形指数是左室扩张的极佳预测指标。
Li等[23]研究62例急性心肌梗死的患者,心肌梗死后(72±5) h和6个月时进行3D超声心动图检查。左心室重构定义为6个月时LVEDV较基线值增加20%。研究发现基线时左心室圆锥指数(即以二尖瓣瓣环内径为直径,左室长轴为高的圆锥体积)是预测左心室重构的良好指标。
实时3D超声心动图不仅能显示整个心室的立体形状和运动,而且可准确计算出某一节段室壁的局部心搏量及EF。Collins等[24]将左心室分为36个节段应用实时3D超声心动图对室壁运动异常进行评估,评估正确率73%。郭薇等[25]研究表明,利用实时3D超声心动图获取实时三维全容积图像,进行左室容积-时间曲线的定量分析,实时显示16节段左心室容积变化曲线,测量心肌缺血时心室运动的整体和局部容积、峰值时间及EF等参数。他们发现心肌缺血组的容积-时间曲线图形不规则,节段运动不一致。左室整体收缩末期容积(ESV)增加、EF值降低,反映整体心肌收缩力和射血能力减弱;局部ESV最大值和最小值增加、局部EF值降低,反映局部心肌的收缩力和射血能力减弱。研究表明实时3D超声心动图左室容积-时间曲线参数能全面反映心肌缺血时整体和局部心室容积、室壁运动及心室功能的动态变化,为心肌缺血的诊断与治疗提供更完整可靠的定量信息。
综上所述,超声心动图在冠心病心肌缺血和心肌梗死的诊断治疗中,具有独特的优势和巨大的价值。随着超声新技术的不断出现并逐步应用到临床,超声心动图能更加精确的测量心脏的结构和功能,对局部心肌灌注情况、冠状动脉血流、心腔内压力和血流动力学等参数以及预后等的评价都有越来越重要的作用,是临床不可或缺的工具[26]。
无


























