
探讨心包积液现有检查对良恶性心包积液的诊断价值。
回顾性分析2011年1月至2017年11月北京大学人民医院行心包穿刺并完善相关检查的50例住院患者资料,将其分为良、恶性心包积液组,每组25例,比较心包穿刺检查的差异及相关指标的诊断价值。
与良性心包积液组比较,恶性心包积液组多为血性(91.7%比52.2%,χ2=9.155,P=0.003)、总细胞(个/μL)更多[731 600(25 168,1 871 580)比25 520(248,1 202 095),P=0.035]、白细胞(个/μL)更多[1 800(1 075,3 302)比860(56,2 450),P=0.032]、LDH(U/L)更高[902.5(345.5,3 068.5)比296.0(144.0,1 274.0),P=0.019],且心包积液与血清LDH比值更高[2.97(1.58,8.04)比1.17(0.71,5.03),P=0.021]。恶性心包积液组的肿瘤标记物中CEA、CA19-9、CYFRA21-1和NSE均高于良性心包积液组(均为P<0.05)。总细胞、白细胞和NSE对恶性心包积液的诊断价值较低[ROC曲线下面积(AUC)<0.7],LDH、心包积液与血清LDH比值、CEA、CA19-9和CYFRA21-1对恶性心包积液的诊断价值为中等(AUC=0.702~0.814,P<0.05),CYFRA21-1的诊断价值最高(AUC=0.814,95%CI:0.667~0.961,P=0.002)。而心包积液细胞病理检查的敏感度仅为41.7%~62.5%,特异度为100%。
心包积液现有常规与生化检查的诊断价值均存在不足,而细胞病理学特异性良好,却敏感性低。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
心包积液在临床上较为常见,经超声心动图检查诊断的心包积液患病率为9%[1]。心包积液的症状隐匿、病因复杂、诊断困难,其中,肿瘤性心包积液占心包积液病因的12%~23%[2],甚至是肿瘤患者的首发症状,并迅速出现心脏压塞,造成血流动力学不稳定及死亡[3]。因此,快速精确地鉴别出肿瘤性心包积液具有重要的治疗及预后意义。目前,通过心包穿刺直接获取积液,以鉴定其理化性质和细胞学成分,仍是诊断恶性积液的最主要手段。然而,前者检测指标缺乏特异性,且其结果的判读参照胸腔积液Light标准区分渗出液或漏出液,将其应用于心包积液的判读尚缺乏证据[4,5],而后者作为诊断"金标准",敏感性显得不足[6]。针对上述问题,国内外研究均较少涉及,故本研究旨在阐明心包积液现有检测指标对恶性心包积液的诊断价值。
本研究为回顾性研究。选取2011年1月至2017年11月于北京大学人民医院临床诊断为"心包积液/心包炎/心包填塞/多浆膜腔积液/心包积血"的住院患者614例,其中行心包穿刺术的患者70例,排除因介入手术行紧急心包穿刺的患者17例,以及未完善研究相关指标的患者3例,最终纳入50例。其中男性29例(58.0%),女性21例(42.0%)。中位年龄64(55.8,74.8)岁。本研究经医院伦理委员会批准(伦理批号:2017PHB049)。
收集患者的心包积液检查相关资料,包括:(1)常规:性状(血性/非血性)、pH、比重、总细胞、白细胞、单个核细胞比例、多核细胞比例、李凡他试验(阳性/阴性);(2)生化:总蛋白、白蛋白、乳酸脱氢酶(LDH)、腺苷脱氢酶(ADA)、葡萄糖;(3)肿瘤标记物:癌胚抗原(CEA)、甲胎蛋白(AFP)、CA19-9、CYFRA21-1、神经元特异烯醇化酶(NSE);(4)心包蛋白/血清蛋白、心包LDH/血清LDH、心包积液性质(渗出液/漏出液),其中心包积液性质的判断参照Light标准:心包蛋白/血清蛋白>0.5或心包LDH/血清LDH>0.6为渗出液,否则为漏出液[5];(5)病理。
根据心包积液病因,将患者分为恶性心包积液组25例(50.0%)和良性心包积液组25例(50.0%)。病因诊断由两名心内科专家分别根据病史、理化检查等临床资料独立得出,若不一致,则由第3名专家判读。其中,恶性心包积液定义:心包组织或心包积液病理发现肿瘤细胞;影像学、活检发现原发性心包肿瘤的存在;存在全身恶性肿瘤证据,且患者临床表现符合肿瘤性心包积液特点(血性,可为大量,病情进展快,积液增长快,虽经引流仍反复渗出积聚)[7,8]。其他病因均列为良性心包积液。
应用IBM SPSS 22.0统计学软件进行分析。正态分布的计量资料以 ±s表示,两组间比较采用独立样本t检验;偏态分布的计量资料以中位数(四分位数间距)[M(Q25,Q75)],两组间比较采用非参数Mann-Whitney U检验;计数资料以百分构成比或率表示,组间比较采用卡方检验。以双侧检验P<0.05为差异有统计学意义。指标的诊断价值判断应用受试者工作特征曲线(ROC),计算曲线下面积(AUC)、最佳cut-off值(约登指数最大)。
±s表示,两组间比较采用独立样本t检验;偏态分布的计量资料以中位数(四分位数间距)[M(Q25,Q75)],两组间比较采用非参数Mann-Whitney U检验;计数资料以百分构成比或率表示,组间比较采用卡方检验。以双侧检验P<0.05为差异有统计学意义。指标的诊断价值判断应用受试者工作特征曲线(ROC),计算曲线下面积(AUC)、最佳cut-off值(约登指数最大)。
入选的心包积液患者病因前3位:恶性25例(50.0%),结核性8例(16.0%),特发性7例(14.0%),其他包括右心衰竭/布加综合征/上腔静脉阻塞5例(10.0%),慢性移植物抗宿主病2例(4.0%),心包切开术后综合征1例,起搏器导线穿孔相关1例,心包玻璃样变(可能性大)1例。25例恶性心包积液患者中,原发性心包肿瘤2例,分别为心包血管肉瘤和上皮样梭形细胞恶性肿瘤;继发性恶性心包积液23例,其中肺癌9例、乳腺癌3例、淋巴瘤3例、生殖系统肿瘤(前列腺癌、睾丸癌、卵巢癌)3例、胸腺癌1例和来源不明(病理见肿瘤细胞,但无法明确肿瘤来源)4例。
恶性心包积液较良性心包积液外观血性更多见(91.7%比52.2%,χ2=9.155,P=0.003);恶性心包积液中总细胞和白细胞数量(个/μL)更多[21例:731 600(25 168,1 871 580)比20例:25 520(248,1 202 095),P=0.035;22例:1 800(1 075,3 302)比21例:860(56,2 450),P=0.032];良恶性心包积液的pH、比重、单个核细胞和多核细胞比例、李凡他试验阳性比例比较,差异均无统计学意义(均为P>0.05)。
恶性心包积液的LDH(U/L)更高[22例:902.5(345.5,3 068.5)比23例:296.0(144.0,1 274.0),P=0.019],且心包积液与血清LDH比值更高[22例:2.97(1.58,8.04)比23例:1.17(0.71,5.03),P=0.021],但两组间渗出液所占比例及总蛋白、白蛋白、葡萄糖、ADA、心包积液与血清总蛋白比值比较,差异均无统计学意义(均为P>0.05)。
恶性心包积液中肿瘤标记物浓度较良性心包积液偏高,其中CEA(ng/ml)[18例:3.98(0.95,71.09)比17例:0.64(0.52,1.29),P=0.003]、CA19-9(U/ml)[14例:22.13(9.45,48.27)比14例:5.16(1.71,22.54),P=0.039]、CYFRA21-1(ng/ml)[17例:247.50(63.84,500.00)比18例:64.42(16.40,95.07),P=0.001]和NSE(ng/ml)[17例:18.22(4.67,253.15)比18例:5.75(1.57,65.54),P=0.048]比较,差异均有统计学意义。
将良恶性心包积液中有差异的实验室指标(总细胞、白细胞、LDH、心包积液与血浆LDH比值、CEA、CA19-9、CYFRA21-1和NSE)绘制ROC曲线,结果显示所有指标P值均大于0.05,但总细胞、白细胞、NSE对恶性心包积液的诊断价值较低(AUC<0.7),LDH、心包积液与血清LDH比值、CEA、CA19-9、CYFRA21-1对恶性心包积液的诊断价值为中等(AUC:0.702~0.814,P<0.05),其中以CYFRA21-1诊断价值最高(AUC:0.814,95%CI:0.667~0.961,P=0.002),见表1。总体来说,这些指标的诊断价值均不够理想,敏感性、特异性均偏低。
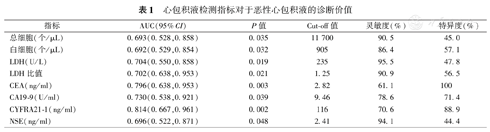
心包积液检测指标对于恶性心包积液的诊断价值
心包积液检测指标对于恶性心包积液的诊断价值
| 指标 | AUC(95%CI) | P值 | Cut-off值 | 灵敏度(%) | 特异度(%) |
|---|---|---|---|---|---|
| 总细胞(个/μL) | 0.693(0.528,0.858) | 0.035 | 11 700 | 90.5 | 45.0 |
| 白细胞(个/μL) | 0.692(0.529,0.854) | 0.032 | 905 | 86.4 | 57.1 |
| LDH(U/L) | 0.704(0.550,0.858) | 0.019 | 235 | 95.5 | 47.8 |
| LDH比值 | 0.702(0.638,0.953) | 0.021 | 1.25 | 90.9 | 56.5 |
| CEA(ng/ml) | 0.796(0.638,0.953) | 0.003 | 2.82 | 61.1 | 100 |
| CA19-9(U/ml) | 0.730(0.538,0.921) | 0.039 | 9.46 | 78.6 | 71.4 |
| CYFRA21-1(ng/ml) | 0.814(0.667,0.961) | 0.002 | 116 | 70.6 | 88.9 |
| NSE(ng/ml) | 0.696(0.522,0.871) | 0.048 | 2.41 | 94.1 | 44.4 |
根据Light标准,将心包积液分为渗出液/漏出液。22例完善生化检查的恶性心包积液患者全部为渗出液;23例完善生化检查的良性心包积液患者中仅有1例为漏出液(2.2%),其病因为慢性移植物抗宿主病,其他均为渗出液,包括5例传统意义上被认为应为"漏出液"的患者(右心衰竭/布加综合征/上腔静脉阻塞)。
临床上诊断恶性心包积液的25例患者中,完善病理检查的24例,通过病理结果明确为恶性心包积液的10例(41.7%),疑似恶性心包积液5例(20.8%),9例(37.5%)病理结果未发现恶性指征。而良性心包积液的25例患者中,17例完善病理检查,病理结果均为阴性。心包积液细胞病理检查的敏感度为41.7%~62.5%,特异度为100%。
心包穿刺是获取心包积液以进行病因诊断的唯一办法,文献报道超声引导下心包穿刺的并发症发生率为1.3%~1.6%,而无引导穿刺相关的致命性并发症发生率可达20.9%[9]。因此,临床中获取满足诊断用途的心包积液标本尤为不易。本研究共纳入50例心包穿刺患者,虽样本量较小,结果却具有一定代表性。
目前,对于心包积液理化检测结果的解读,临床实践中普遍参照胸腔积液Light标准,用于区别漏出液或渗出液。据此,本研究中仅1例患者(2.0%)为漏出液,其他均为渗出液(98.0%),包括5例传统意义上被认为应为"漏出液"的患者(右心衰竭/布加综合征/上腔静脉阻塞)。Akyuz等[11]报道,除结核性心包积液外,区分漏出液和渗出液并无助于病因诊断。另外,2015年欧洲心脏病学会关于心包疾病的指南中亦指出,Light标准用于心包积液尚未被确认[5]。
除此,本研究发现肿瘤标志物CYFRA21-1诊断恶性积液价值较高,可能与研究中所纳入的肺癌患者比例较高相关。但迄今为止CYFRA21-1对于恶性心包积液的诊断价值仍未被深入研究。另一方面,由于胸腔积液获取容易,开展了较多的新型标志物研究。例如,文献报道survivin蛋白对恶性胸腔积液具有较高的诊断价值(AUC=0.9485)[12],同样值得在心包积液中进一步探索。
本研究中,证实细胞学检查虽特异性良好,敏感性却不高。美国学者Dragoescu等[13]亦得出相似结论,其6年内获取的128份心包积液中,检出恶性肿瘤的敏感度为71%,特异度高达100%。其敏感性低下的原因可能与标本取样、病理技术等相关,因此,亦有研究指出,心包积液至少60 ml以上才能保证细胞学检查具有较高的灵敏度[10]。在相同队列中,心包积液细胞学检查优于心包活检,后者病理学检查的敏感度为64%,特异度为85%[13]。由此,提示临床中即使病理学检查中未见肿瘤细胞,亦不能轻易除外恶性心包积液的可能性,且暂不必积极开展心包活检。
总之,基于上述研究证据,目前临床上心包积液现有检测项目诊断价值有限,关于新型标志物的研究较少且进展缓慢,亟待突破现有的诊断困境。
无



























