
评估急性心肌梗死(AMI)患者新发心房颤动(NOAF)的危险因素,并分析其预后。
对2017年6月至2018年6月于吉林大学第一医院就诊的435例AMI患者进行分析。NOAF定义为入院时或住院期间心电图上检测到的心房颤动。收集患者的人口统计学、临床、实验室、超声心动图和冠状动脉造影数据。采用多变量逻辑回归分析确定AMI患者NOAF和总死亡率的独立危险因素。
在435例AMI患者中,有46例NOAF,发生率为10.6%。多变量分析显示,年龄>60岁(OR=1.072,95%CI:1.013~1.124,P=0.025)、左心室射血分数≤40%(OR=4.895,95%CI:1.826~13.605,P=0.004)和左心房直径>40 mm(OR=1.141,95%CI:1.037~1.261,P=0.012)是AMI患者NOAF的独立危险因素。当综合评估住院和随访死亡率(总死亡率)时,NOAF与预后较差相关(15.2%比7.7%,χ2=4.925,P=0.011)。多变量分析显示,年龄>60岁、糖尿病病史、NOAF和心功能Killip分级Ⅲ/Ⅳ级均为AMI患者总死亡率的独立危险因素(均为P<0.05)。
老年、左心室收缩功能不全和左心房直径增大是AMI患者NOAF的危险因素,出现NOAF的AMI患者预后较差。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
在急性心肌梗死(acute myocardial infarction,AMI)患者中新发心房颤动(new-onset atrial fibrillation,NOAF)很常见,其通常会导致严重的血流动力学障碍,已被证实是AMI患者死亡率的独立预测因子[1]。并且,在NOAF患者中,卒中、出血和再梗死的发生率均高于无NOAF患者[2]。目前认为,心房收缩、房室同步性受损和不规则RR间期引起的心排血量二次下降可能是NOAF患者预后不良的部分原因[3]。然而,NOAF潜在的机制可能很复杂,而且尚未得到明确描述。在AMI患者中,确定AF发展的危险因素将有助于高危患者预防性抗心律失常治疗。因此,本研究探讨AMI患者NOAF的危险因素并评估其预后,以期为临床提供更多参考依据。
本研究为回顾性、观察性和非随机队列研究。连续纳入2017年6月至2018年6月于吉林大学第一医院就诊的435例AMI患者,其中男性338例,女性97例,年龄46~85岁,平均(67.2±13.0)岁。AMI诊断标准参照中华医学会心血管病学分会等制订的准则[4]:(1)缺血性胸痛的临床病史;(2)心电图的动态演变;(3)心肌坏死的血清心肌标记物浓度的动态改变,必须至少符合其中2条方可确诊。NOAF定义为入院时或住院期间首次出现的AF,既往无持续性、阵发性AF或心房扑动病史[5]。此外,排除未经证实的心肌梗死诊断(肺栓塞、主动脉夹层、急性心包炎)和入院前永久性AF。本研究经医院伦理委员会批准(伦理批号:2016JL030-2),所有患者均签署知情同意书。
收集患者的人口统计学、临床、实验室、超声心动图和冠状动脉造影数据。实验室数据包括入院后24 h内获得的血浆N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)和胱抑素C水平,肌酐峰值取住院期间的最大值。采集入院后进行的第1次超声心动图数据,其中左心室射血分数(left ventricular ejection fraction,LVEF)根据美国超声心动图学会的标准分为正常(≥55%)、轻度减少(40%~55%)、中度减少(30%~40%)和严重减少(<30%),在二维成像的指导下,用M型超声心动图测量左心房的大小。采集住院期间进行的冠状动脉造影结果,冠状动脉疾病定义为冠状动脉造影上的左主干至少有一处病变狭窄≥50%,其他冠状动脉至少有一处病变狭窄≥70%。多支血管病变定义为两支或多支主要心外膜动脉的显著狭窄。
所有患者于出院后1年内接受电话或门诊随访,记录患者死亡情况。
采用SPSS 18.0统计学软件进行分析。计量资料用 ±s表示,组间比较采用t检验;计数资料用百分构成比表示,组间比较采用卡方检验。将单变量分析中差异具有统计学意义的变量纳入多变量逻辑回归分析,用于确定NOAF和总死亡率(住院和随访)的独立危险因素。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;计数资料用百分构成比表示,组间比较采用卡方检验。将单变量分析中差异具有统计学意义的变量纳入多变量逻辑回归分析,用于确定NOAF和总死亡率(住院和随访)的独立危险因素。P<0.05为差异有统计学意义。
研究人群的基线特征如表1所示。在435例AMI患者中,有46例发生NOAF,发生率为10.6%。与无NOAF组相比,NOAF组的老年、高血压以及既往有心脏瓣膜病、冠状动脉旁路移植术史和阿司匹林治疗的患者比例明显增加(均为P<0.05),其他心血管危险因素或病史无显著差异(均为P>0.05)。
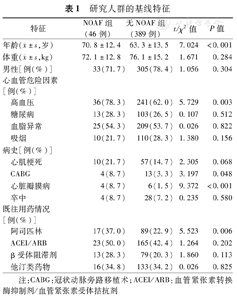
研究人群的基线特征
研究人群的基线特征
| 特征 | NOAF组(46例) | 无NOAF组(389例) | t/χ2值 | P值 | |
|---|---|---|---|---|---|
年龄( ±s,岁) ±s,岁) | 70.8±12.4 | 63.3±13.5 | 7.024 | <0.001 | |
体重( ±s,kg) ±s,kg) | 72.1±12.8 | 76.1±15.2 | 1.671 | 0.284 | |
| 男性[例(%)] | 33(71.7) | 305(78.4) | 1.056 | 0.304 | |
| 心血管危险因素[例(%)] | |||||
| 高血压 | 36(78.3) | 241(62.0) | 5.729 | 0.003 | |
| 糖尿病 | 13(28.3) | 103(26.5) | 0.107 | 0.512 | |
| 血脂异常 | 25(54.3) | 209(53.7) | 0.026 | 0.822 | |
| 吸烟 | 10(21.7) | 110(28.3) | 1.380 | 0.156 | |
| 病史[例(%)] | |||||
| 心肌梗死 | 10(21.7) | 57(14.7) | 2.305 | 0.068 | |
| CABG | 4(8.7) | 13(3.3) | 3.197 | 0.048 | |
| 心脏瓣膜病 | 4(8.7) | 6(1.5) | 9.372 | <0.001 | |
| 卒中 | 4(8.7) | 28(7.2) | 0.235 | 0.580 | |
| 既往用药情况[例(%)] | |||||
| 阿司匹林 | 17(37.0) | 89(22.9) | 5.523 | 0.006 | |
| ACEI/ARB | 23(50.0) | 165(42.4) | 1.264 | 0.202 | |
| β受体阻滞剂 | 13(28.3) | 79(20.3) | 1.860 | 0.113 | |
| 他汀类药物 | 16(34.8) | 133(34.2) | 0.026 | 0.825 | |
注:CABG:冠状动脉旁路移植术;ACEI/ARB:血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂
研究人群的住院数据如表2所示。住院期间,NOAF组患者的心率显著高于无NOAF组(P<0.001),并且呼吸道感染和心力衰竭的患病率显著升高(均为P<0.05)。在实验室数据方面,NOAF组患者的平均NT-proBNP、胱抑素C和肌酐峰值显著高于无NOAF组(均为P<0.05)。超声心动图显示,NOAF与左心房直径增大、二尖瓣显著反流(Ⅱ/Ⅳ级)和LVEF≤40%相关(均为P<0.001)。此外,NOAF组中有显著冠状动脉病变及行冠状动脉血运重建的患者比例显著低于无NOAF组(均为P<0.05)。两组多支血管病变的发生率相似。
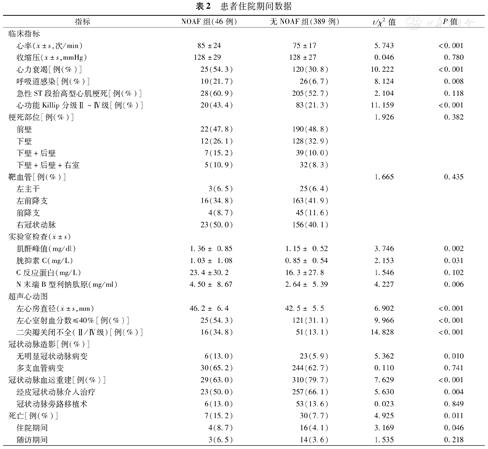
患者住院期间数据
患者住院期间数据
| 指标 | NOAF组(46例) | 无NOAF组(389例) | t/χ2值 | P值 | |
|---|---|---|---|---|---|
| 临床指标 | |||||
心率( ±s,次/min) ±s,次/min) | 85±24 | 75±17 | 5.743 | <0.001 | |
收缩压( ±s,mmHg) ±s,mmHg) | 128±29 | 128±27 | 0.046 | 0.780 | |
| 心力衰竭[例(%)] | 25(54.3) | 120(30.8) | 10.222 | <0.001 | |
| 呼吸道感染[例(%)] | 10(21.7) | 26(6.7) | 8.124 | 0.008 | |
| 急性ST段抬高型心肌梗死[例(%)] | 28(60.9) | 205(52.7) | 2.104 | 0.118 | |
| 心功能Killip分级Ⅱ~Ⅳ级[例(%)] | 20(43.4) | 83(21.3) | 11.159 | <0.001 | |
| 梗死部位[例(%)] | 1.926 | 0.382 | |||
| 前壁 | 22(47.8) | 190(48.8) | |||
| 下壁 | 12(26.1) | 128(32.9) | |||
| 下壁+后壁 | 7(15.2) | 39(10.0) | |||
| 下壁+后壁+右室 | 5(10.9) | 32(8.3) | |||
| 靶血管[例(%)] | 1.665 | 0.435 | |||
| 左主干 | 3(6.5) | 25(6.4) | |||
| 左前降支 | 16(34.8) | 163(41.9) | |||
| 前降支 | 4(8.7) | 45(11.6) | |||
| 右冠状动脉 | 23(50.0) | 156(40.1) | |||
实验室检查( ±s) ±s) | |||||
| 肌酐峰值(mg/dl) | 1.36± 0.85 | 1.15± 0.52 | 3.746 | 0.002 | |
| 胱抑素C(mg/L) | 1.03± 1.08 | 0.85± 0.54 | 2.153 | 0.031 | |
| C反应蛋白(mg/L) | 23.4±30.2 | 16.3±27.8 | 1.546 | 0.102 | |
| N末端B型利钠肽原(mg/ml) | 4.50± 8.67 | 2.64± 5.39 | 4.227 | 0.006 | |
| 超声心动图 | |||||
左心房直径( ±s,mm) ±s,mm) | 46.2± 6.4 | 42.5± 5.5 | 6.902 | <0.001 | |
| 左心室射血分数≤40%[例(%)] | 25(54.3) | 121(31.1) | 9.966 | <0.001 | |
| 二尖瓣关闭不全(Ⅱ/Ⅳ级)[例(%)] | 16(34.8) | 51(13.1) | 14.828 | <0.001 | |
| 冠状动脉造影[例(%)] | |||||
| 无明显冠状动脉病变 | 6(13.0) | 23(5.9) | 5.362 | 0.010 | |
| 多支血管病变 | 30(65.2) | 244(62.7) | 0.110 | 0.741 | |
| 冠状动脉血运重建[例(%)] | 29(63.0) | 310(79.7) | 7.629 | <0.001 | |
| 经皮冠状动脉介入治疗 | 23(50.0) | 257(66.1) | 5.630 | 0.004 | |
| 冠状动脉旁路移植术 | 6(13.0) | 53(13.6) | 0.023 | 0.849 | |
| 死亡[例(%)] | 7(15.2) | 30(7.7) | 4.925 | 0.011 | |
| 住院期间 | 4(8.7) | 16(4.1) | 3.169 | 0.046 | |
| 随访期间 | 3(6.5) | 14(3.6) | 1.535 | 0.218 | |
多变量分析显示,年龄>60岁(OR=1.072,95%CI:1.013~1.124,P=0.025)、LVEF≤40%(OR=4.895,95%CI:1.826~13.605,P=0.004)和左心房直径>40 mm(OR=1.141,95%CI:1.037~1.261,P=0.012)是AMI患者NOAF的独立危险因素。
平均随访(191±69)d,NOAF组患者有更高的死亡发生趋势(6.5%比3.6%,χ2=1.535,P=0.218)。当综合评估住院和随访死亡率(总死亡率)时,NOAF与预后较差相关(15.2%比7.7%,χ2=4.925,P=0.011)。多变量分析显示,年龄>60岁、糖尿病病史、NOAF和心功能Killip分级Ⅲ/Ⅳ级均为AMI患者总死亡率的独立危险因素(均为P<0.05),见表3。
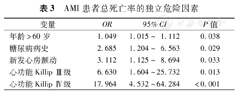
AMI患者总死亡率的独立危险因素
AMI患者总死亡率的独立危险因素
| 变量 | OR | 95%CI | P值 |
|---|---|---|---|
| 年龄>60岁 | 1.049 | 1.015~ 1.112 | 0.038 |
| 糖尿病病史 | 2.685 | 1.204~ 6.563 | 0.029 |
| 新发心房颤动 | 3.112 | 1.125~ 8.694 | 0.033 |
| 心功能Killip Ⅲ级 | 6.630 | 1.604~25.732 | 0.013 |
| 心功能Killip Ⅳ级 | 17.964 | 4.532~64.284 | <0.001 |
本研究试图探讨AMI患者NOAF的危险因素并评估其预后,NOAF的发病率为10.6%,与文献描述相似[6]。研究表明:(1)年龄>60岁、LVEF≤40%和左心房直径>40 mm是AMI患者NOAF的独立危险因素;(2)NOAF与住院期间更差的临床表现相关;(3)NOAF与住院期间死亡率和总死亡率更高相关,与随访期间死亡率升高趋势相关。
NOAF是一种常见的AMI心律失常并发症,并且与预后不良有关。在AMI患者中,促进AF发生发展的机制复杂且往往是多因素的,包括心包炎、心房缺血或梗死、儿茶酚胺增加、代谢异常、炎症和心房压力增加等[7]。动物实验和临床观察表明,增加心房压力和(或)引起急性心房扩张可能起到重要作用,心房压力增加使心房不应期缩短,大大增加了AF的易感性[8,9]。此外,AF往往与心力衰竭的症状和体征有关。在最近一篇系统综述和荟萃分析中,Gao等[10]在多变量分析后报告了与NOAF相关的几个因素,包括高龄、更高的Killip分级或心力衰竭、低血压、更高的心率、高血压史、卒中史、女性、肌酐峰值增加和C反应蛋白水平增加。在本研究中,上述变量中的一些因素(心力衰竭、心率升高、高血压病史和肌酐峰值增加)在单变量分析中与NOAF发生有关,但在多变量分析中,只有老年和左心室功能障碍仍然是NOAF发生的危险因素。AF与这些因素之间关系的机制包括年龄相关的心房心肌丢失和传导障碍、心房压力和容量过载增加、继发性瓣膜功能障碍和慢性神经激素刺激,这些刺激发生在左心室功能障碍和心力衰竭中[11]。
除了上述已知的危险因素外,在本研究中,左心房直径增大也是NOAF发生的独立危险因素。左心房直径是左心房心肌进行性扩张和重构的标志,可作为AF开始和维持的基质[12]。一项动物研究发现,心房扩张可拉伸心脏组织中的离子通道,并被心房内压升高所激活,从而诱发AF,而通过阻断被拉伸的通道则降低了AF的诱导性[8]。此外,这种关联也可通过其他危险因素的存在来解释,如高血压和AF相关并发症等公认的危险因素,以及心脏瓣膜病均可能导致左房扩大。在经胸超声心动图上,左心房直径是一个很容易获得的参数,这可能有助于对AMI患者NOAF的风险进行分层。此外,呼吸道感染在多变量分析中几乎达到统计学意义(P=0.061)。已知炎症和活动性感染可促进细胞因子的释放和单核细胞上Toll样受体2表达的上调,这可能是AF的触发因素[13]。
住院期间,NOAF与更差的实验室和超声心动图表现相关。记录显示,与肾功能不全(肌酐峰值和胱抑素C)和心力衰竭(NT-proBNP)相关的生物标记物升高。除上述超声心动图参数(LVEF≤40%)外,冠状动脉造影显示NOAF与无冠状动脉病变和低血运重建率之间存在关联。前者可能是血栓栓塞事件后早期再灌注的结果,也可能仅仅是由快速性心律失常引起的心肌供氧和供氧不平衡的结果;后者则可能与经皮冠状动脉介入治疗率较低有关,其他学者也报道了这一发现[3],可能是上述假设的次要因素,但也可能与严重合并症或弥漫性冠状动脉疾病不适于血运重建的最佳医疗选择有关。
AF与AMI患者死亡率的关系已被广泛证实。AF的存在与住院期间的不良结果相关,并且以往研究的结果普遍表明AF是住院死亡率增加的独立预测因子[14]。本研究中出现NOAF的AMI患者总死亡率(住院+随访)显著高于无NOAF患者,与以往的文献一致[11]。Mcmanus等[15]报告的一项纳入了59 032例AMI住院患者的大型研究中,也同样发现了NOAF与住院总死亡率升高相关。但值得注意的是,本研究中NOAF患者的住院死亡率(8.7%)显著低于上述研究报道的14.5%,这可能是本研究针对NOAF患者进行了强化治疗(包括查明导致AF发生的原因、给予转复窦性心律治疗),从而降低了患者的短期死亡率。而在多变量分析中,NOAF仍然是总死亡率的独立危险因素。由于NOAF患者常出现心力衰竭和其他已知对AMI预后不利的因素,导致患者的总体临床状况较差。因此,临床医生应重视对此类患者的长期管理。
在解释我们的研究时,有几个限制要考虑。首先,这是在一家医院进行的一项回顾性、观察性和非随机研究,因此,已确定和未确定的混杂因素可能会影响结果。例如,没有AF病史的患者在入院时出现心律失常,无法确定NOAF的持续时间,因此他们可能被错误分类。事实上,不同时间的AF患者可能有不同的临床特征和预后。第二,NOAF患者的研究人数较少,这可能限制了独立预测因素的确定和结果的一致性。
总之,出现NOAF的AMI患者在住院期间具有更差的临床表现,并对住院及整个随访期间产生不利的预后影响。
无



























