
探讨左心耳容积与心房颤动(房颤)射频消融术后复发的关系。
选择2016年1月至2018年6月于绵阳市中心医院心内科首次成功接受射频消融治疗的185例非瓣膜性房颤患者。术前通过冠状动脉CT血管造影测量患者左心耳容积。术后随访12个月评估患者房颤是否复发。采用单因素和多因素logistic回归分析评估房颤射频消融术后复发的危险因素。利用受试者工作特征曲线选取评估房颤射频消融术后复发的左心耳容积的最佳预测值。
随访期间48例(25.9%)患者房颤复发。房颤复发组患者的左心耳容积显著大于未复发组[(11.9±4.3)ml比(9.7±3.6)ml,t=-3.262,P=0.002]。多因素回归分析显示,左心耳容积(OR=1.180,95%CI:1.024~1.360,P=0.022)与左房内径、持续性房颤同为房颤患者射频消融术后复发的独立危险因素。左心耳容积>9.85 ml为最佳预测值(灵敏度72.9%,特异度59.9%)。在持续性房颤患者中,单因素分析显示左心耳容积(OR=1.141,95%CI:1.006~1.293,P=0.039)与房颤术后复发相关。在阵发性房颤患者中,左心耳容积与房颤术后复发无明显关联。
左心耳容积对房颤射频消融术后复发具有一定的预测作用,可作为评估房颤术后复发及术前筛选适宜患者的新指标。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
心房颤动(简称"房颤")是临床上最常见的心律失常之一[1],可显著增加患者发生卒中、心力衰竭乃至死亡的风险[2,3,4,5]。对抗心律失常药物治疗无效或不耐受且症状反复的房颤患者应优先考虑射频消融治疗(Ⅱa,B)[1]。然而,房颤射频消融手术复发率较高[6],且手术结果受多种因素影响[7,8,9,10,11]。左心耳是左心房前侧壁的盲端结构[12],其形态与房颤患者心房内血栓形成有关[13],同时也是房性心律失常产生和维持的重要部位[14,15]。随着左心耳封堵技术的进一步普及与成熟,左心耳与房颤患者的预后已逐渐成为研究的热点。有研究表明,左心耳容积与房颤患者射频消融术后复发有关[16,17,18,19]。然而上述研究样本量较小,且未对左房容积、房颤类型做进一步校正,因此有关左心耳容积与房颤射频消融术后复发的关系仍需进一步验证。尤其是在不同房颤亚组中,上述关系尚无相关报道。冠状动脉CT血管造影(简称"冠脉CTA")在评估房颤患者左房及左心耳结构方面具有较高的准确性[20,21]。因此,本研究旨在通过冠脉CTA对房颤患者术前左心耳容积等指标进行测量,分析其在房颤及房颤亚组患者中与射频消融术后房颤复发的关系。
本研究为回顾性队列研究。选择2016年1月至2018年6月于绵阳市中心医院心血管内科首次成功接受心内电生理检查及射频消融治疗的185例非瓣膜性房颤患者,其中男性106例,女性79例,年龄41~80岁,平均(61.8±9.1)岁。排除标准:(1)患有先天性心脏病、心肌病、严重心脏瓣膜病变、严重肝肾功能不全、甲状腺功能异常、恶性肿瘤者;(2)处于脑血管病、急性冠状动脉综合征、感染急性发作期,或3个月内有外科手术史;(3)既往曾接受心内电生理检查或射频消融手术治疗;(4)患者入院或随访资料不全。本研究已通过绵阳市中心医院医学伦理审查。
通过电子病历浏览系统查阅患者个人资料及详细病史,记录患者基本情况、伴随疾病、用药情况、术前实验室检查数据等。计算患者CHA2DS2-VASc评分。所有患者术前均完善常规经胸超声心动图(transthoracic echocardiograghy,TTE)、经食道超声心动图(transesophageal echocardiograghy,TEE)和冠脉CTA检查。收集患者术前由TTE、TEE测得的相关数据。冠脉CTA影像用于重建左心房及左心耳三维图像,并对左心耳容积、左心耳开口径线、左心耳开口面积和左房容积做进一步测量。
MIMICS(Materialise's interactive medical image control system)是比利时Materialise公司设计的交互式医学影像控制系统,可利用CT数据集的横断面、矢状面、冠状面3个正交平面重建局部解剖三维结构,准确测量目标区域的几何参数[22,23]。将患者冠脉CTA影像导入MIMICS 17.0软件中,选择心动周期中心室收缩期(此时心房处于最大容积)相位窗图像作为三维重建原始数据。先后利用软件中的阈值切割、区域增长、模块编辑、三维计算、三维编辑等功能,重建患者左心房、左心耳及肺静脉三维模型(图1),并对相关数据进行测量(图2)。患者冠脉CTA中左心房、左心耳的所有数值均在非同日重复测量2~3次,取所有测量值的平均值。
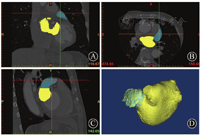

A、B、C分别为冠脉CTA冠状面、横断面、矢状面3个正交平面,D为利用上述3个正交平面重建的左心房及左心耳三维结构
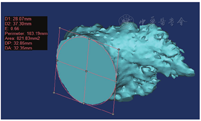

D1、D2为左心耳开口径线,Area为左心耳开口面积。如图所示,该患者左心耳开口长径为37.30 mm,开口短径为28.07 mm,开口面积为821.83 mm2
所有患者均在三维电解剖标测系统下成功进行左房基质改良及环肺静脉消融。术前或术中出现典型心房扑动者应行下腔静脉至三尖瓣环峡部的线性消融,直至实现跨越三尖瓣峡部传导的双向阻滞。若环肺静脉电隔离后仍能检测到房颤律,则进一步于左房顶部两个隔离环间及左下肺静脉至二尖瓣环间行线性消融。若房颤仍持续,则继续标测复杂碎裂心房电图部位,进行碎裂电位消融,直至其电压低于0.1 mV或下降超过80%。若检测到早于右心房电位的上腔静脉电位,且后者为连续的快速电活动,则进行上腔静脉隔离。若心内标测显示异位心动过速起源于非肺静脉部位,则进行相应部位的点消融。若经上述射频消融方法后患者仍持续为房颤心律,则行体外电复律以终止房颤、恢复窦律。术中额外消融为术中除环肺静脉隔离外同时进行了线性消融、碎裂电位消融或点消融等治疗。
患者分别于术后3、6和12个月至我院心内科门诊复查,并进行相应电话随访。随访内容包括患者日常症状、用药情况、常规体格检查、生化检查、心电图、24 h动态心电图等,记录随访期间患者发生房颤复发、卒中、心血管死亡、全因死亡等不良事件的情况。若患者有胸闷、心悸等不适,或自觉房颤再次发作,需随时至医院就诊复查心电图或Holter以明确是否房颤复发。房颤复发定义为在接受射频消融手术3个月的空白期之后,无论有无症状,由心电图或Holter记录到任何形式的持续超过30 s的快速性房性心律失常(包括房颤、心房扑动、短阵房性心动过速)。若在随访12个月期间,未记录到上述心电图改变,则认为患者无房颤复发。
采用SPSS 20.0统计软件进行分析。计量资料用 ±s表示,组间比较采用独立样本t检验。计数资料用百分构成比表示,根据分类变量理论频数的具体数值,采用卡方检验、连续性校正卡方检验或费舍尔精确检验进行组间比较。采用Spearman相关分析评估左心耳容积与其他临床指标的相关性。利用二分类logistic回归分析评估房颤射频消融术后复发的危险因素,单因素logistic回归分析中P<0.05的变量可进一步行多因素logistic回归分析。利用受试者工作特征(receiver operating characteristic,ROC)曲线选取评估房颤射频消融术后复发的左心耳容积的最佳预测值并计算曲线下面积(area under the curves,AUCs)。所有检验均为双侧检验,P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验。计数资料用百分构成比表示,根据分类变量理论频数的具体数值,采用卡方检验、连续性校正卡方检验或费舍尔精确检验进行组间比较。采用Spearman相关分析评估左心耳容积与其他临床指标的相关性。利用二分类logistic回归分析评估房颤射频消融术后复发的危险因素,单因素logistic回归分析中P<0.05的变量可进一步行多因素logistic回归分析。利用受试者工作特征(receiver operating characteristic,ROC)曲线选取评估房颤射频消融术后复发的左心耳容积的最佳预测值并计算曲线下面积(area under the curves,AUCs)。所有检验均为双侧检验,P<0.05为差异有统计学意义。
入选患者中有阵发性房颤112例(60.5%),持续性房颤73例(39.5%),两组基本临床资料见表1。
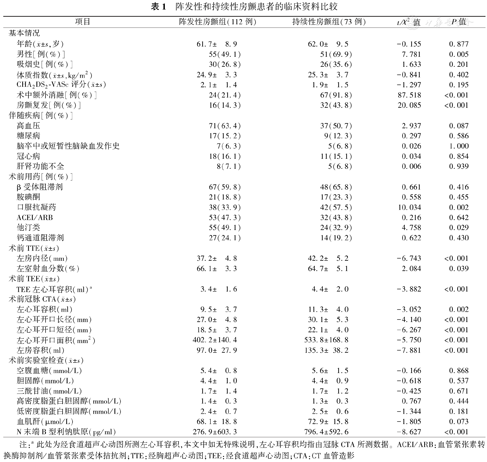
阵发性和持续性房颤患者的临床资料比较
阵发性和持续性房颤患者的临床资料比较
| 项目 | 阵发性房颤组(112例) | 持续性房颤组(73例) | t/χ2值 | P值 | |
|---|---|---|---|---|---|
| 基本情况 | |||||
年龄( ±s,岁) ±s,岁) | 61.7± 8.9 | 62.0± 9.5 | -0.155 | 0.877 | |
| 男性[例(%)] | 55(49.1) | 51(69.9) | 7.781 | 0.005 | |
| 吸烟史[例(%)] | 30(26.8) | 26(35.6) | 1.633 | 0.201 | |
体质指数( ±s,kg/m2) ±s,kg/m2) | 24.9± 3.3 | 25.3± 3.7 | -0.841 | 0.402 | |
CHA2DS2-VASc评分( ±s) ±s) | 2.1± 1.4 | 1.9± 1.5 | -1.297 | 0.195 | |
| 术中额外消融[例(%)] | 24(21.4) | 67(91.8) | 87.518 | <0.001 | |
| 房颤复发[例(%)] | 16(14.3) | 32(43.8) | 20.085 | <0.001 | |
| 伴随疾病[例(%)] | |||||
| 高血压 | 71(63.4) | 37(50.7) | 2.937 | 0.087 | |
| 糖尿病 | 17(15.2) | 9(12.3) | 0.297 | 0.586 | |
| 脑卒中或短暂性脑缺血发作史 | 7(6.3) | 5(6.8) | 0.026 | 1.000 | |
| 冠心病 | 18(16.1) | 11(15.1) | 0.034 | 0.854 | |
| 肝肾功能不全 | 8(7.1) | 5(6.8) | 0.006 | 0.939 | |
| 术前用药[例(%)] | |||||
| β受体阻滞剂 | 67(59.8) | 48(65.8) | 0.661 | 0.416 | |
| 胺碘酮 | 21(18.8) | 17(23.3) | 0.558 | 0.455 | |
| 口服抗凝药 | 38(33.9) | 42(57.5) | 10.034 | 0.002 | |
| ACEI/ARB | 53(47.3) | 32(43.8) | 0.216 | 0.642 | |
| 他汀类 | 55(49.1) | 24(32.9) | 4.758 | 0.029 | |
| 钙通道阻滞剂 | 27(24.1) | 14(19.2) | 0.622 | 0.430 | |
术前TTE( ±s) ±s) | |||||
| 左房内径(mm) | 37.2± 4.8 | 42.2± 5.2 | -6.743 | <0.001 | |
| 左室射血分数(%) | 66.1± 3.3 | 64.7± 5.1 | 2.084 | 0.039 | |
术前TEE( ±s) ±s) | |||||
| TEE左心耳容积(ml)a | 3.4± 1.6 | 4.4± 2.0 | -3.882 | <0.001 | |
术前冠脉CTA( ±s) ±s) | |||||
| 左心耳容积(ml) | 9.5± 3.7 | 11.3± 4.0 | -3.052 | 0.002 | |
| 左心耳开口长径(mm) | 27.0± 4.8 | 30.1± 5.3 | -4.140 | <0.001 | |
| 左心耳开口短径(mm) | 18.5± 3.7 | 22.1± 4.0 | -6.267 | <0.001 | |
| 左心耳开口面积(mm2) | 402.2±140.4 | 533.8±168.8 | -5.750 | <0.001 | |
| 左房容积(ml) | 97.0± 27.9 | 135.3± 38.2 | -7.881 | <0.001 | |
术前实验室检查( ±s) ±s) | |||||
| 空腹血糖(mmol/L) | 5.4± 0.8 | 5.6± 1.5 | -0.166 | 0.868 | |
| 胆固醇(mmol/L) | 4.4± 1.0 | 4.4± 0.9 | -0.618 | 0.537 | |
| 三酰甘油(mmol/L) | 1.7± 1.4 | 1.7± 1.2 | -0.425 | 0.671 | |
| 高密度脂蛋白胆固醇(mmol/L) | 1.4± 0.3 | 1.3± 0.3 | 0.767 | 0.444 | |
| 低密度脂蛋白胆固醇(mmol/L) | 2.4± 0.7 | 2.5± 0.6 | -1.344 | 0.181 | |
| 血肌酐(μmol/L) | 68.1± 18.8 | 72.9± 15.8 | -1.805 | 0.073 | |
| N末端B型利钠肽原(pg/ml) | 276.9±603.3 | 796.4±592.6 | -8.627 | <0.001 | |
注:a此处为经食道超声心动图所测左心耳容积,本文中如无特殊说明,左心耳容积均指由冠脉CTA所测数据。ACEI/ARB:血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂;TTE:经胸超声心动图;TEE:经食道超声心动图;CTA:CT血管造影
入选患者中男性平均左心耳容积(10.1±3.8)ml,女性(10.5±4.0)ml,左心耳容积与性别无明显关联(t=-0.869,P=0.385)。持续性房颤患者的左心耳容积显著大于阵发性房颤患者[(11.3±4.0)ml比(9.5±3.7)ml,t=-3.052,P=0.002],射频消融术后房颤复发者的左心耳容积显著大于未复发者[(11.9±4.3)ml比(9.7±3.6)ml,t=-3.262,P=0.002],提示左心耳容积与房颤类型、射频消融术后是否复发具有相关性。此外,左心耳容积与吸烟史(P=0.774)、伴随疾病[有无高血压(P=0.522)、糖尿病(P=0.221)、冠心病(P=0.140)、脑卒中或短暂性脑缺血发作史(P=0.894)]、术前用药[是否服用β受体阻滞剂(P=0.698)、胺碘酮(P=0.415)、口服抗凝药(P=0.389)、血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂(P=0.333)、钙通道阻滞剂(P=0.148)、他汀类药物(P=0.118)]均未见明显相关性。
通过Spearman等级相关系数进一步评估,左心耳容积与左房内径(r=0.257,P<0.001)、左房容积(r=0.417,P<0.001)、N末端B型利钠肽原水平(r=0.270,P<0.001)呈显著正相关,与左心耳开口面积(r=0.745,P<0.001)、左心耳开口长径(r=0.738,P<0.001)、左心耳开口短径(r=0.643,P<0.001)亦具有良好的相关性。由冠脉CTA测得患者的平均左心耳容积大于由TEE测得的平均左心耳容积[(10.2±3.9)ml比(3.8±1.8)ml],但分析发现二者具有较强的相关性(r=0.657,P<0.001)。
随访期间,185例房颤患者射频消融术后复发48例(25.9%)。房颤复发组患者的左房内径[(42.4±5.6)mm比(38.0±5.0)mm,t=-5.100,P<0.001]、左房容积[(132.2±38.9)ml比(105.1±34.1)ml,t=-4.563,P<0.001]、左心耳容积[(11.9±4.3)ml比(9.7±3.6)ml,t=-3.262,P=0.002]、左心耳开口长径[(29.8±5.3)mm比(27.7±5.1)mm,t=-2.504,P=0.013]、左心耳开口短径[(21.4±4.5)mm比(19.4±3.9)mm,t=-2.901,P=0.004]、左心耳开口面积[(514.0±180.9)mm2比(433.1±154.2)mm2,t=-2.987,P=0.003]和N末端B型利钠肽原[(709.0±637.9)pg/ml比(406.5±637.6)pg/ml,t=-3.929,P<0.001]均明显大(高)于房颤未复发组,且房颤复发组中持续性房颤患者(66.7%比29.9%,χ2=20.085,P<0.001)和手术中额外行线性消融或碎裂电位消融的患者(66.7%比43.1%,χ2=7.922,P=0.005)所占比例更高。
单因素logistic回归分析显示,持续性房颤(OR=4.683,95%CI:2.319~9.465,P<0.001)、左房内径(OR=1.168,95%CI:1.091~1.250,P<0.001)、左房容积(OR=1.021,95%CI:1.010~1.031,P<0.001)、左心耳容积(OR=1.158,95%CI:1.062~1.262,P=0.001)、左心耳开口长径(OR=1.083,95%CI:1.016~1.155,P=0.015)、左心耳开口短径(OR=1.124,95%CI:1.035~1.220,P=0.005)、左心耳开口面积(OR=1.003,95%CI:1.001~1.005,P=0.004)、血浆N末端B型利钠肽原水平(OR=1.001,95%CI:1.000~1.001,P=0.012)、术中额外消融(OR=2.644,95%CI:1.328~5.265,P=0.006)与患者术后房颤复发相关。进一步行多因素回归分析显示,仅左心耳容积(OR=1.180,95%CI:1.024~1.360,P=0.022)、持续性房颤(OR=5.085,95%CI:1.530~16.901,P=0.008)、左房内径(OR=1.136,95%CI:1.030~1.254,P=0.011)为房颤患者射频消融术后复发的独立危险因素。ROC曲线分析提示,左心耳容积>9.85 ml为房颤患者射频消融术后复发的最佳预测值,灵敏度72.9%,特异度59.9%,曲线下面积为0.652。左心耳容积>9.85 ml的患者射频消融术后房颤复发率明显高于左心耳容积<9.85 ml的患者(63.6%比15.9%,χ2=15.281,P<0.001)。
随访期间,73例持续性房颤患者中32例(43.8%)房颤复发。复发组患者的左房内径[(44.4±4.9)mm比(40.5±4.7)mm,t=-3.465,P=0.002]、左房容积[(145.7±35.4)ml比(127.2±38.7)ml,t=-2.108,P=0.014]、左心耳容积[(12.4±4.2)ml比(10.5±3.6)ml,t=-2.154,P=0.035]显著大于未复发组。两组患者在年龄、性别、伴随疾病、术前用药、术中额外消融、左室射血分数、N末端B型利钠肽原、空腹血糖、血肌酐、血脂方面无显著差异。
单因素logistic回归分析显示,左房内径(OR=1.187,95%CI:1.063~1.325,P=0.002)、左房容积(OR=1.014,95%CI:1.000~1.028,P=0.047)、左心耳容积(OR=1.141,95%CI:1.006~1.293,P=0.039)与患者术后房颤复发相关。进一步多因素回归分析显示,仅左房内径(OR=1.202,95%CI:1.050~1.376,P=0.008)为持续性房颤患者射频消融术后房颤复发的独立危险因素。
随访期间,112例阵发性房颤中16例(14.3%)房颤复发。复发组与未复发组患者在年龄、性别、伴随疾病、术前用药、术中额外消融比例、左室射血分数、空腹血糖、血肌酐、血脂方面无显著性差异。复发组患者的左房内径[(38.5±4.8)mm比(37.0±4.7)mm,t=-1.190,P=0.241]、左房容积[(105.1±31.4)ml比(95.6±27.1)ml,t=-1.269,P=0.283]、左心耳容积[(10.8±4.3)ml比(9.3±3.5)ml,t=-1.544,P=0.258]、左心耳开口长径[(28.0±4.3)mm比(26.8±4.8)mm,t=-0.916,P=0.306]、左心耳开口短径[(18.9±4.1)mm比(18.5±3.6)mm,t=-0.485,P=0.609]、左心耳开口面积[(424.5±143.9)mm2比(398.4±140.3)mm2,t=-0.685,P=0.454]、血浆N末端B型利钠肽原[(359.1±524.4)pg/ml比(264.0±616.3)pg/ml,t=-0.566,P=0.724]均略大(高)于未复发组,但差异均无统计学意义。
在Pinto等[16]的研究中,射频消融术后房颤复发组患者相较于未复发组,平均左心耳容积和持续性房颤患者比例更大,而两组的左房容积无显著差异(P=0.28)。在Shiozawa等[17]的研究中,射频消融术后房颤复发组患者的左心耳容积明显大于未复发组,而两组左房内径(P=0.40)、左房容积(P=0.24)和房颤类型(P=0.23)则无明显差异。郑桂安等[18]和腾帅等[19]均提出,左心耳容积是射频消融术后房颤复发的独立危险因素,但未对房颤类型做进一步校正分析。本研究显示,左心耳容积与房颤类型、左房内径、左房容积和N末端B型利钠肽原水平具有良好的关联性,因此在分析左心耳容积对房颤复发的预测作用时,对房颤类型、左房内径、左房容积和N末端B型利钠肽原水平进行校正十分必要。而在矫正了上述因素后,左心耳容积仍为房颤患者射频消融术后房颤复发的独立危险因素,一方面提示左心耳与左房的结构重构具有一定的一致性和异质性,二者发生结构重构的内在分子生物学机制可能不完全相同;另一方面,本研究得到的结果与既往研究一致,但样本量更大,且校正因素更全面,进一步表明左心耳容积在预测房颤射频消融术后复发中的价值。
此外,本研究分别对阵发性房颤和持续性房颤患者进行单独分析。在阵发性房颤患者中,房颤复发组与未复发组的左房及左心耳相关结构指标均无显著差异。房颤进程中左房及左心耳出现的结构重构随房颤负荷增加而增加,不同房颤类型的患者的左房及左心耳结构重构程度不同[24,25]。阵发性房颤患者的疾病时程短、房颤负荷低,左房及左心耳重构并不明显,因此相应结构指标对于其手术预后无法体现出明显预测作用,而此时血中某些较为灵敏的炎症指标可能对于早期、初发房颤患者的病情评估具有一定的预测价值[26]。而在持续性房颤患者中,单因素回归分析提示左房内径、左房容积、左心耳容积与患者术后房颤复发相关,经多因素回归分析后,左心耳容积(OR=1.147,95%CI:0.998~1.318,P=0.054)并非独立危险因素。即在校正了左房内径与左房容积后,在P<0.05的检验水平上无法表明左心耳容积为术后房颤复发的独立预测因素,但二者之间的密切关系仍不可忽视,相关结论需要大量重复的多中心研究进一步证实。
B型利钠肽、N末端B型利钠肽原在评估房颤患者病情、预测射频消融手术预后等方面的作用目前已有较多报道[27]。本研究中,患者术前N末端B型利钠肽原高水平与射频消融术后房颤复发密切相关,而左心耳容积与左房内径、左房容积、N末端B型利钠肽原水平具有良好的相关性。一方面进一步表明左心耳与左房在房颤进程中同样发生了结构重构,二者可能具有相似的生物学机制;另一方面则提示,左心耳容积在评估房颤患者病情、预测房颤患者射频消融手术预后等方面可能具有同样重要的作用。
在Li等[28]一项包括860例非房颤患者的研究中,男性左心耳长径显著大于女性[(24.79±3.81)mm比(22.68±4.07)mm],且左心耳长径、左心耳容积与患者身高、体重、体表面积均呈明显正相关(均为P<0.05)。Korhonen等[29]则指出,在阵发性房颤患者及非房颤患者中,老年、女性均与经体表面积校正后的标准化左心耳长度密切相关(P<0.001)。在本研究中,房颤患者左心耳容积与性别、年龄无明显相关性,考虑除抽样因素影响外可能有以下原因:本研究入选患者平均年龄(61.8±9.1)岁,其中46~55岁患者占14.6%,56~65岁患者占44.9%,66~75岁患者占34.6%,老龄患者居多,且年龄分布较为集中,因而在年龄梯度上左心耳容积无法体现出明显差异;此外,受房颤病程尤其是持续性房颤患者长期处于房颤律的影响,左房及左心耳出现渐进性的结构重构,与年龄、性别等因素共同作用,使左心耳容积在不同年龄、不同性别人群中差异不明显,因而无法得到与上述研究人群(非房颤患者、阵发性房颤患者)相同的结果。
综上,左心耳容积对射频消融术后房颤复发具有一定的预测作用,可作为评估房颤术后复发及术前筛选适宜患者的新指标。但本研究对房颤复发的监测主要通过门诊检查、电话随访等方式进行,部分患者房颤复发时可能无明显临床症状,亦未至医院就诊,因此导致该部分房颤复发患者数据缺失。另外,左心耳容积、左房容积在心动周期中呈现动态变化,而本研究仅对心室收缩期(此时左房容积处于最大值)相位窗的CT影像进行测量,且部分患者检查时的房颤律可能影响左房及左心耳容积测量的准确性,因而具有一定的局限性。因此,今后需要更多有关左心耳容积的动态改变与房颤射频消融手术预后的前瞻性、大样本、多中心研究对上述结果加以佐证。
无



























