
急性心肌梗死(AMI)作为致死率较高的心血管疾病(CVD)之一,其发病率仍居高不下。近年来,大量研究发现肠道菌群作为"第二基因组"参与CVD的发病。本文将就肠道菌群及其代谢产物与AMI的关系、可能机制作一综述,以期为AMI的治疗提供新思路。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
《中国心血管健康与疾病报告2020》显示,我国心血管疾病(cardiovascular disease,CVD)现患人数3.3亿,其中冠状动脉粥样硬化性心脏病1 139万[1],根据2010—2014年全国参保住院患者抽样数据库推算,现急性心肌梗死(acute myocardial infarction,AMI)年住院率为44.2/10万,中国城镇AMI患者的中位住院费用为3.1万元,住院时间为9 d。因此,AMI的防治仍是需攻克的一大难题。现越来越多的证据表明,肠道菌群(gut microbiota,GM)及其代谢产物在人类健康和CVD中发挥着重要作用,除菌群失调外,GM的代谢产物已被确认为疾病发展的一个促成因素,调节GM被认为是治疗CVD的潜在新靶点。
人体内包含数以亿计的细菌、古菌、病毒和单细胞真核生物,这些微生物与宿主共同构成微生物区系,分布于人体胃肠道者则称为GM,它们与宿主的健康、疾病密切相关。宿主为GM提供适宜的生存环境及所需的营养物质,GM参与人体的消化吸收、生物屏障、免疫调节、新陈代谢等诸多方面,二者相互维持着动态平衡。
健康成年人肠道中至少含有1 000种菌群,细菌总数超过100万亿[2],易受遗传、免疫、环境、饮食及药物应用等多种因素影响。通常GM主要包括拟杆菌、厚壁菌、放线菌、变形菌和疣微菌5个菌门,其中以厌氧菌为主[2]。生活在胃肠道不同区域的微生物数量不同,且相差很大,尤其结肠段,以厌氧环境为主,营养丰富,是GM定殖的首选场所,因此也是GM生活数量最多的地方。
随着对GM研究的深入,GM被越来越多的学者认为是一个具有内分泌功能的虚拟器官,其产生的生物活性代谢产物可以影响宿主的生理功能。有研究表明,GM主要通过糖水解和蛋白水解两种途径参与食物消化、分解。糖水解途径中,GM主要分解碳水化合物,并产生大量短链脂肪酸(short-chain fatty acids,SCFA),包括丁酸、丙酸、醋酸等。蛋白水解途径是以发酵蛋白质类为主,也会诱导SCFA的形成,但同时会产生其他代谢产物,如三甲胺、胆汁酸、吲哚硫酸盐等[3]。其中,有潜在毒性的代谢产物主要通过肾脏排出,以维持内环境稳态。
AMI是指在冠状动脉管腔狭窄的基础上,发生急剧、持续的缺血,引起心肌缺血、坏死,是严重威胁人类健康的心血管急症。AMI患者由于长期卧床和进食减少、肠黏膜再生能力减弱及使用质子泵抑制剂导致肠道过度碱化和细菌繁殖,易引起肠屏障功能障碍,发生GM移位。随着微生态学相关研究的发展,人们逐渐认识到GM参与AMI的发生、发展,综合国内外研究,虽然GM与AMI的研究相对较少,但得出了相似的结论,为AMI治疗提出了新的研究靶点。
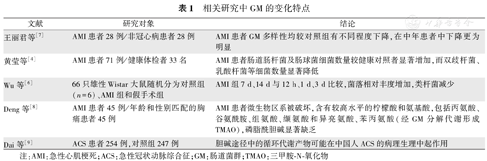
国内一项研究显示,AMI患者肠道肠杆菌及肠球菌数量较健康人群显著增加,而双歧杆菌、乳酸杆菌等被认为是人体肠道内"有益"的细菌数量显著降低,表明AMI患者存在典型的GM失调[4]。Zhou等[5]对49名健康者、50例稳定性冠心病患者和100例ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者进行了全细菌的元基因组分析,证实了STEMI患者有较高的微生物丰富度和多样性,其中超过12%的细菌源于GM,以乳杆菌、类杆菌和链球菌为主,提示AMI后的心血管结局是由肠道微生物区系移位进入体循环所驱动的。国外一项研究将66只雄性Wistar大鼠随机分为对照组、AMI组和假手术组,麻醉后处死对照组。结扎冠状动脉左前降支建立AMI模型,分别于术后12 h、1 d、3 d、7 d和14 d处死大鼠,运用16Srdna高通量测序分析GM发现,AMI后7 d,AMI组GM数量明显高于假手术组,互养菌门、螺旋菌门、毛螺菌科、单胞菌科和泰式菌属的丰富度均高于假手术组,与肠屏障功能受损相平行[6],再次表明GM参与AMI的发生,并可能影响AMI患者的预后(表1)。
相关研究中GM的变化特点
相关研究中GM的变化特点
| 文献 | 研究对象 | 结论 |
|---|---|---|
| 王丽君等[7] | AMI患者28例/非冠心病患者28例 | AMI患者GM多样性均较对照组有不同程度下降,在中年患者中下降更为明显 |
| 黄莹等[4] | AMI患者71例/健康体检者33名 | AMI患者肠道肠杆菌及肠球菌细菌数量较健康对照者显著增加,而双歧杆菌、乳酸杆菌等细菌数量显著降低 |
| Wu等[6] | 66只雄性Wistar大鼠随机分为对照组(n=6)、AMI组和假手术组 | AMI组7 d、14 d与12 h、1 d、3 d比较,菌落相对丰度增加,类杆菌减少 |
| Deng等[8] | AMI患者45例/年龄和性别匹配的胸痛患者45例 | AMI患者微生物区系被破坏,含有较高水平的柠檬酸和氨基酸,包括丙氨酸、谷氨酰胺、组氨酸、缬氨酸和异亮氨酸、苯丙氨酸(经GM分解代谢形成TMAO),磷脂酰胆碱显著缺乏 |
| Dai等[9] | ACS患者254例,对照组247例 | 胆碱途径中的循环代谢产物可能在中国人ACS的病理生理中起作用 |
注:AMI:急性心肌梗死;ACS:急性冠状动脉综合征;GM:肠道菌群;TMAO:三甲胺-N-氧化物
GM及其代谢产物致AMI的机制尚不明确,现有研究表明,GM可通过多种途径参与AMI的发生发展。首先,AMI后肠道的血流动力学变化,绒毛易发生功能性缺血,以及AMI后心力衰竭背景下的肠道淤血,均易引起肠道功能障碍、通透性增加,使肠道微生物区系移位、GM组成发生改变。随后,大量GM代谢产物进入血液循环,进一步促进全身炎症反应,进而加重肠黏膜损伤,形成恶性循环。GM及其代谢产物引发AMI的机制可能通过以下几条途径(图1)。
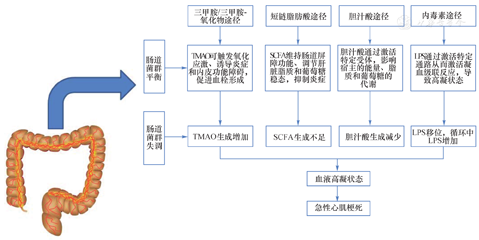

TMAO:三甲胺-N-氧化物;SCFA:短链脂肪酸;LPS:脂多糖
在人体内,富含胆碱、卵磷脂和L-肉碱的食物,如红肉、鸡蛋、乳制品和咸水鱼,经GM代谢生成前体三甲胺[10]。三甲胺被血液吸收,在肝脏黄素单加氧酶3作用下,迅速氧化成三甲胺-N-氧化物(trimethylamine-N-oxide,TMAO)[11]。TMAO作为一种生物活性分子,可加速动脉粥样斑块的进展[12],与急性冠状动脉综合征患者中不稳定斑块的存在、破裂及长期心血管事件的风险有关[13]。TMAO通过抑制SIRT3-SOD2-线粒体活性氧信号通路,触发氧化应激,激活血栓素NIPNLRP3型炎症小体[14],增加细胞表面CD36受体的表达,加剧巨噬细胞、胆固醇的积聚[12],释放炎症细胞因子白细胞介素1、β和18,抑制一氧化氮合酶和一氧化氮的生成,从而诱导炎症和内皮功能障碍[15],促进动脉粥样硬化,参与AMI的发生。有研究表明,TMAO可独立预测AMI后短期(6个月)和长期(2年)全因死亡率或再发心肌梗死不良结局的发生[16],肌钙蛋白T阴性的急性冠状动脉综合征患者的心血管事件发生率随着TMAO水平的升高而增加[17]。
此外,TMAO通过上调巨噬细胞的清道夫受体,激活核因子-κB和下调血栓调节蛋白在内皮细胞中的表达来触发组织因子(tissue factor,TF)依赖的促凝活性(procoagulant activity,PCA),促进血栓形成[18]。动物实验表明,TMAO通过产生的三磷酸肌醇,触发血小板内储存的钙离子释放,致血小板高反应性,进而引起血栓效应[17,19],并且这种效应呈剂量依赖性[20]。然而,目前基于TMAO与人类AMI的研究仍较少,其参与AMI的具体机制仍需进一步明确,TMAO水平相关的特定GM可能是准确诊断ACS发病的潜在预测生物标志物[21]。降低TMAO水平有可能预防或治疗动脉粥样硬化相关疾病,减少心脑血管疾病的发病率。
人体内,SCFA由高膳食纤维和少量蛋白质经GM分解代谢产生,通过G蛋白耦联受体(G protein-coupled receptor 43,GPR43),可促进肠道IgA反应,维持肠道免疫稳态[22],调节肝脏脂质和葡萄糖稳态。有研究表明,通过肝脏的丙酸浓度的增加,可降低肝内的三酰甘油,这也可能在维持葡萄糖稳态中起作用。醋酸作为外周循环中含量最丰富的SCFA,通过抑制脂肪细胞脂解,促进脂肪氧化,从而减少了流向肝脏的游离脂肪酸浓度,可改善葡萄糖稳态和炎症状态[23],并证实血浆醋酸水平的升高与血浆胰岛素水平成反比。而丁酸,不仅是结肠细胞的主要能源物质,还在维持肠道屏障中发挥重要作用。体外实验证实,丁酸通过稳定特定的转录因子、紧密连接蛋白的组装和粘蛋白的分泌来保护肠腔厌氧,从而在维持肠道屏障功能方面起着关键作用[24]。通过增强肠道屏障,丁酸盐可以阻止脂多糖易位,从而抑制巨噬细胞的激活、减少促炎细胞因子的产生[24]。综上所述,SCFA在调节血糖稳态、维持肠道屏障功能、抑制炎症中发挥重要作用。然而,发生AMI时,肠道屏障功能减低、GM移位,乳杆菌等肠道益生菌减少,导致SCFA生成减少,从而影响宿主能量代谢及AMI患者预后。
胆汁酸是一种重要的信号调节分子,可以激活核法尼醇X受体、孕烷X受体、维生素D受体和G蛋白耦联胆汁酸受体1,影响宿主的能量、脂质和葡萄糖代谢,调节自身的合成和胆固醇的降解[25]。同样地,发生GM失调时,胆汁酸生成减少,脂质、葡萄糖代谢紊乱,促进动脉粥样硬化斑块形成,促进AMI进展。
内毒素是革兰阴性细菌细胞壁中的活性成分,其主要成分是脂多糖。在肠道通透性增加、GM移位时,循环中脂多糖大量增加,在免疫细胞(单核细胞、巨噬细胞和Kupffer细胞)中触发Toll样受体4介导的促炎级联反应,导致下游信号通路激活,如核因子κB和丝裂原活化蛋白激酶(MAPK),从而导致由细胞因子肿瘤坏死因子α和白细胞介素6等细胞因子驱动的炎症,作用于内皮细胞和血小板,激活凝血级联反应,导致高凝状态,诱发AMI。通过青年AMI组与健康百岁老人对照组的比较,进一步表明肠道高通透性可能导致内毒素血症,进而可能导致炎症,引起胰岛素抵抗、动脉粥样硬化和高凝状态[26],促进AMI发生。
通过补充益生菌,间接增加SCFA、胆汁酸等代谢产物的血浆浓度,可预防AMI发生、改善AMI预后。动物实验表明,经抗生素治疗7 d的小鼠AMI后,观察到GM枯竭与SCFA(尤其醋酸、丁酸盐和丙酸)比例显著降低,给予补充乳酸杆菌后,可增加SCFA血浆浓度,产生心脏保护作用[27]。予大鼠补充活性益生菌14 d,异丙肾上腺素诱导大鼠心肌梗死样损伤后,于心肌损伤后24 h行右颈动脉和左心室插管,记录血压和心脏参数,结果表明活性益生菌通过抑制肿瘤坏死因子α和氧化应激损伤对大鼠心肌梗死样损伤产生心脏保护作用,减轻AMI后左室肥厚,延缓心力衰竭的进展[28]。因此,益生菌一方面通过增加SCAF产生心脏保护,另一方面可通过抑制炎症反应、减轻AMI后左室肥厚而影响AMI预后。
抗生素治疗极大程度地破坏了微生物平衡,包括降低菌群的丰富度和多样性。有研究表明,万古霉素能改变大鼠缺血再灌注损伤后肠道菌群丰度,缩小心肌梗死面积,进一步研究表明,利福昔明还可降低细菌毒性和移位,具有抗炎作用,正向调节GM组成[29],促进益生菌生长,多粘菌素B和妥布霉素可降低心力衰竭患者肠道和粪便中的内毒素,降低体内白细胞介素1β、白细胞介素6和肿瘤坏死因子α的含量。但抗生素的应用,可能引起新的菌群失调以及菌群耐药,是目前临床亟须解决的问题。
FMT是一种将供体粪便中的菌群或代谢物引入病变受体,以纠正肠道微生态失衡,重建正常肠道功能的治疗方法。荟萃分析推测,粪便移植在恢复肠道菌群方面可能比益生菌更有效,因为粪便菌群输注可以克服益生菌的短期疗效,并使菌群发生永久性变化[30]。一项关于9名肥胖男性和9名健康男性经胃十二指肠肠管输注肠道微生物的研究显示,输入同种异体肠道微生物后,肥胖组肠道微生物区系多样性显著增加,其中产生丁酸的细菌肠蔷薇酸菌增加了2.5倍[31]。然而有研究指出,在粪便细菌被移植时,病毒也会被移植[32]。因此,需要进一步的临床研究来评估FMT对于AMI患者的治疗效果。
最后,基于TMAO在AMI发病中的作用机制,微生物酶和宿主肝酶都是减少TMAO产生的潜在靶点,可通过阻断三甲胺向TMAO的转化,阻止氧化应激、血栓形成。有研究表明,胆碱结构类似物(3,3-二甲基-1-丁醇)可阻断胆碱代谢途径,减少三甲胺的产生,有望成为AMI治疗的新靶点,使心血管疾病患者获益更多。现在已知有助于生成三甲胺的其他微生物酶系统包括用于将肉碱转化为三甲胺的CNTA/B和YAW/X[33],其作为新靶点治疗AMI的研究较少,尚需大量临床试验证实。
综上所述,在进一步明确GM及其代谢产物促AMI发病机制的基础上,全基因与GM分析相结合,通过多种干预改变GM,可靶向调节参与炎症和AMI发病机制的信号通路,减少AMI等不良心血管事件的发生。
无



























