
探讨急性Stanford A型主动脉夹层患者术后发生肝功能不全(HD)的危险因素和预后。
回顾性分析青岛市市立医院2014年5月至2018年5月156例接受外科手术的急性Stanford A型主动脉夹层患者围术期资料。采用终末期肝病模型(MELD)评分评估患者术后肝功能,并分为HD组35例(MELD评分≥15分)和非HD组121例(MELD评分<14分)。所有患者围术期主要指标进行单因素分析和多因素logistic回归分析,并比较两组患者的预后。
156例患者中住院期间死亡13例(8.3%),HD组患者死亡7例(20.0%),非HD组患者死亡6例(5.0%)。两组患者术前血清肌酐和谷丙转氨酶水平、体外循环时间、白细胞计数、D-二聚体、术前EuroSCORE评分、主动脉弓置换手术、术中及术后24 h红细胞输注量比较,差异均有统计学意义(均为P<0.05)。多因素分析显示,术前谷丙转氨酶水平升高(OR=1.244,95%CI:1.100~1.406,P=0.001)、体外循环时间延长(OR=1.104,95%CI:1.041~1.170,P=0.001)、术中及术后24 h红细胞输注量增加(OR=4.717,95%CI:2.278~9.767,P=0.000)是术后HD的独立危险因素。平均随访(22.9±3.2)个月,失访率9.1%,HD组患者近中期死亡率高于非HD组(14.3%比2.6%,Log-rank P=0.009)。
急性Stanford A型主动脉夹层患者术后HD的发生率仍较高。术前谷丙转氨酶水平升高、体外循环时间延长、术中及术后24 h红细胞输注量增加是术后HD的独立危险因素。术后HD患者近中期死亡率明显增加。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
目前的健康大数据显示,心脑血管疾病位居中国人疾病死亡构成的首位,而主动脉夹层是心血管疾病患者死亡的主要原因之一。我国主动脉夹层患者大多合并高血压,且平均发病年龄在50岁左右,低于欧美国家10岁以上。主动脉夹层多骤然起病,进展迅速,尤其是Stanford A型主动脉夹层患者,若未经手术治疗,发病48 h内每小时死亡率增加1%[1],因此积极的外科手术是其治疗的主要手段。近年随着脑保护技术及杂交技术的进展,我国的夹层外科治疗围术期死亡率已降至10%以下,甚至降至5%左右[2,3,4]。但夹层患者围术期脏器功能损伤的发生率仍高于其他心脏手术患者。有研究显示,心脏外科术后肝功能衰竭的发生率可达4%,在经历体外循环手术后甚至有10%的患者会出现不同程度的肝功能损伤,与心脏外科术后死亡率及并发症明显相关[5]。本研究通过对行外科手术的急性Stanford A型主动脉夹层患者进行回顾性分析,探讨患者术后发生肝功能不全(hepatic dysfunction,HD)的危险因素以及对预后的影响,以此改善主动脉夹层的手术治疗效果和预后。
回顾性分析2014年5月至2018年5月在青岛市市立医院因急性Stanford A型主动脉夹层行外科手术治疗的156例患者资料,其中男性114例,女性42例,年龄30~82岁,平均(56.2±8.3)岁。Stanford A型主动脉夹层均经胸腹主动脉CT血管造影确诊。排除标准:既往肝硬化病史,肝脏手术史或慢性肝脏病病史,合并重症肝炎。本研究经我院伦理委员会审批通过(审批号:2021临审字第027号),并在中国临床试验注册中心注册(注册号:ChiCTR2100045032)。
手术采用常规胸部正中切口,动脉插管采用单纯股动脉或股动脉及右侧腋动脉单泵双管,右心房插腔房管建立体外循环,深低温停循环患者采用选择性顺行脑灌注,大部分患者采用双侧脑灌注。术中监测脑氧饱和度。其中深低温停循环患者103例,中低温体外循环患者53例;单纯升主动脉置换患者30例,升主动脉+主动脉半弓置换患者20例,单纯Bentall手术患者20例,David手术患者2例,升主动脉置换/Bentall手术+全弓置换+象鼻手术患者79例,去分支杂交手术患者5例;同期冠状动脉旁路移植术12例。
记录患者的性别、年龄、体质指数、术前谷丙转氨酶(alanine aminotransferase,ALT)水平等术前指标及术中、术后相关指标,记录术后并发症(脑卒中、急性肾损伤、低氧血症、再次气管插管、再次开胸止血)。
本研究结合多项研究结果[6,7],采用终末期肝病模型(model for end-stage liver disease,MELD)评分来评估患者术后肝功能,MELD=3.8×ln[胆红素(mg/dl)]+11.2×ln(INR)+9.6×ln[肌酐(mg/dl)]+6.4×(病因:胆汁性或酒精性0,其他1),将评分临界点设为15分。患者术后早期(7 d内)每天根据测得指标计算MELD评分,取最高分,35例患者MELD评分≥15分为HD组,121例患者MELD评分<15分为非HD组。
所有患者于出院后2年内接受电话或门诊随访,分别在术后1、6、12、18和24个月随访,记录患者死亡情况。
采用SPSS 19.0统计软件进行分析。正态分布的计量资料用 ±s表示,组间比较采用t检验;计数资料用百分构成比表示,组间比较采用χ2检验或Fisher精确检验。先对围术期各指标进行单因素分析。再以有统计学意义的危险因素为自变量,进行多因素logistic回归分析,分析术后发生HD的独立危险因素。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,确定各预测因子ROC曲线下面积(area under the ROC curve,AUC)、敏感度和特异度。分析是否发生HD对预后的影响采用Kaplan-Meier法和Log-rank检验,并绘制生存曲线。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;计数资料用百分构成比表示,组间比较采用χ2检验或Fisher精确检验。先对围术期各指标进行单因素分析。再以有统计学意义的危险因素为自变量,进行多因素logistic回归分析,分析术后发生HD的独立危险因素。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,确定各预测因子ROC曲线下面积(area under the ROC curve,AUC)、敏感度和特异度。分析是否发生HD对预后的影响采用Kaplan-Meier法和Log-rank检验,并绘制生存曲线。P<0.05为差异有统计学意义。
本研究共纳入156例患者,其中35例(22.4%)术后出现HD,院内死亡7例(20.0%);121例(77.6%)术后未出现HD,院内死亡6例(5.0%)。全组院内总病死率为8.3%(13/156),死因为大出血2例,多器官功能衰竭8例,脑卒中1例,严重感染性休克2例。
两组患者在年龄、性别构成、体质指数、高血压、糖尿病、慢性阻塞性肺疾病病史、吸烟史、术前MELD评分、纽约心脏病协会(NYHA)心功能分级Ⅲ~Ⅳ级、左心室射血分数、腹腔干动脉受累、是否为急诊手术等方面比较,差异无统计学意义(均为P>0.05)。但术前血肌酐、ALT、白细胞计数、D-二聚体水平及EuroSCORE评分比较,差异有统计学意义(均为P<0.05),见表1。
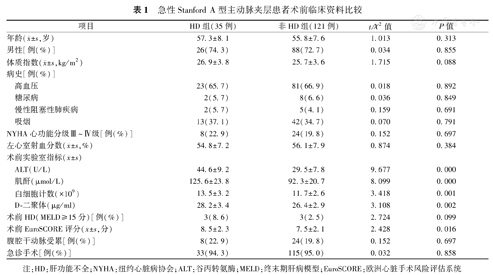
急性Stanford A型主动脉夹层患者术前临床资料比较
急性Stanford A型主动脉夹层患者术前临床资料比较
| 项目 | HD组(35例) | 非HD组(121例) | t/χ2值 | P值 | |
|---|---|---|---|---|---|
年龄( ±s,岁) ±s,岁) | 57.3±8.1 | 55.8±7.6 | 1.013 | 0.313 | |
| 男性[例(%)] | 26(74.3) | 88(72.7) | 0.034 | 0.855 | |
体质指数( ±s,kg/m2) ±s,kg/m2) | 26.9±3.8 | 25.7±3.6 | 1.715 | 0.088 | |
| 病史[例(%)] | |||||
| 高血压 | 23(65.7) | 81(66.9) | 0.018 | 0.892 | |
| 糖尿病 | 2(5.7) | 8(6.6) | 0.036 | 0.849 | |
| 慢性阻塞性肺疾病 | 2(5.7) | 5(4.1) | 0.159 | 0.691 | |
| 吸烟 | 13(37.1) | 42(34.7) | 0.070 | 0.791 | |
| NYHA心功能分级Ⅲ~Ⅳ级[例(%)] | 8(22.9) | 24(19.8) | 0.152 | 0.697 | |
左心室射血分数( ±s,%) ±s,%) | 54.8±7.2 | 56.1±7.9 | 0.874 | 0.384 | |
术前实验室指标( ±s) ±s) | |||||
| ALT(U/L) | 44.6±9.2 | 29.5±7.8 | 9.677 | 0.000 | |
| 肌酐(μmol/L) | 125.6±23.8 | 92.3±20.7 | 8.099 | 0.000 | |
| 白细胞计数(×109) | 13.5±3.2 | 11.7±2.6 | 3.418 | 0.001 | |
| D-二聚体(μg/ml) | 28.2±3.4 | 26.4±2.9 | 3.108 | 0.002 | |
| 术前HD(MELD≥15分)[例(%)] | 3(8.6) | 3(2.5) | 2.724 | 0.099 | |
术前EuroSCORE评分( ±s,分) ±s,分) | 8.5±2.3 | 7.5±2.1 | 2.428 | 0.016 | |
| 腹腔干动脉受累[例(%)] | 8(22.9) | 24(19.8) | 0.152 | 0.697 | |
| 急诊手术[例(%)] | 33(94.3) | 115(95.0) | 0.032 | 0.858 | |
注:HD:肝功能不全;NYHA:纽约心脏病协会;ALT:谷丙转氨酶;MELD:终末期肝病模型;EuroSCORE:欧洲心脏手术风险评估系统
两组患者在体外循环时间、是否行主动脉弓置换、红细胞输注量等方面比较,差异有统计学意义(均为P<0.05)。并且,HD组患者的术后急性肾损伤(34.3%比13.2%)、术后低氧血症(37.1%比20.7%)等并发症发生率明显高于非HD组,机械通气时间、ICU滞留时间及院内死亡率也明显高于非HD组(均为P<0.05),见表2。
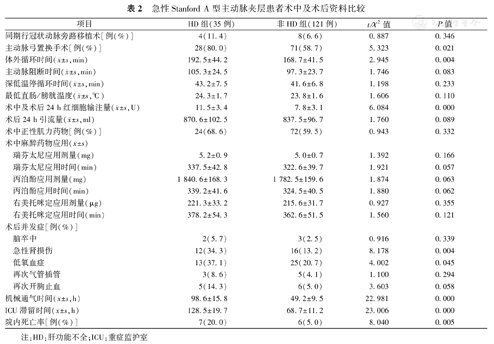
急性Stanford A型主动脉夹层患者术中及术后资料比较
急性Stanford A型主动脉夹层患者术中及术后资料比较
| 项目 | HD组(35例) | 非HD组(121例) | t/χ2值 | P值 | |
|---|---|---|---|---|---|
| 同期行冠状动脉旁路移植术[例(%)] | 4(11.4) | 8(6.6) | 0.887 | 0.346 | |
| 主动脉弓置换手术[例(%)] | 28(80.0) | 71(58.7) | 5.323 | 0.021 | |
体外循环时间( ±s,min) ±s,min) | 192.5±44.2 | 168.7±41.5 | 2.945 | 0.004 | |
主动脉阻断时间( ±s,min) ±s,min) | 105.3±24.5 | 97.3±23.7 | 1.746 | 0.083 | |
深低温停循环时间( ±s,min) ±s,min) | 43.2±7.5 | 41.6±6.8 | 1.198 | 0.233 | |
最低直肠/膀胱温度( ±s,℃) ±s,℃) | 24.3±1.7 | 23.8±1.6 | 1.606 | 0.110 | |
术中及术后24 h红细胞输注量( ±s,U) ±s,U) | 11.5±3.4 | 7.8±3.1 | 6.084 | 0.000 | |
术后24 h引流量( ±s,ml) ±s,ml) | 870.6±102.5 | 837.5±96.7 | 1.760 | 0.089 | |
| 术中正性肌力药物[例(%)] | 24(68.6) | 72(59.5) | 0.943 | 0.332 | |
术中麻醉药物应用( ±s) ±s) | |||||
| 瑞芬太尼应用剂量(mg) | 5.2±0.9 | 5.0±0.7 | 1.392 | 0.166 | |
| 瑞芬太尼应用时间(min) | 337.5±42.8 | 322.6±39.7 | 1.921 | 0.057 | |
| 丙泊酚应用剂量(mg) | 1 840.6±168.3 | 1 782.5±159.6 | 1.874 | 0.063 | |
| 丙泊酚应用时间(min) | 339.2±41.6 | 324.5±40.5 | 1.880 | 0.062 | |
| 右美托咪定应用剂量(μg) | 221.3±33.2 | 215.6±31.7 | 0.927 | 0.355 | |
| 右美托咪定应用时间(min) | 378.2±54.3 | 362.6±51.5 | 1.560 | 0.121 | |
| 术后并发症[例(%)] | |||||
| 脑卒中 | 2(5.7) | 3(2.5) | 0.916 | 0.339 | |
| 急性肾损伤 | 12(34.3) | 16(13.2) | 8.178 | 0.004 | |
| 低氧血症 | 13(37.1) | 25(20.7) | 4.002 | 0.045 | |
| 再次气管插管 | 3(8.6) | 5(4.1) | 1.100 | 0.294 | |
| 再次开胸止血 | 5(14.3) | 6(5.0) | 3.603 | 0.058 | |
机械通气时间( ±s,h) ±s,h) | 98.6±15.8 | 49.2±9.5 | 22.981 | 0.000 | |
ICU滞留时间( ±s,h) ±s,h) | 128.5±19.7 | 68.7±11.2 | 23.006 | 0.000 | |
| 院内死亡率[例(%)] | 7(20.0) | 6(5.0) | 8.040 | 0.005 | |
注:HD:肝功能不全;ICU:重症监护室
将单因素分析结果中的危险因素作为自变量进行多因素非条件logistic回归分析。结果显示,术前ALT水平升高(OR=1.244,95%CI:1.100~1.406,P=0.001)、体外循环时间延长(OR=1.104,95%CI:1.041~1.170,P=0.001)和术中及术后24 h红细胞输注量增加(OR=4.717,95%CI:2.278~9.767,P=0.000)是急性Stanford A型主动脉夹层术后HD的独立危险因素,见表3。
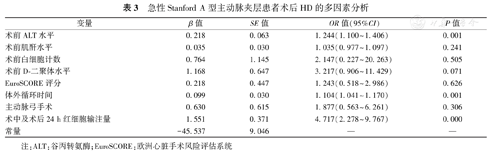
急性Stanford A型主动脉夹层患者术后HD的多因素分析
急性Stanford A型主动脉夹层患者术后HD的多因素分析
| 变量 | β值 | SE值 | OR值(95%CI) | P值 |
|---|---|---|---|---|
| 术前ALT水平 | 0.218 | 0.063 | 1.244(1.100~1.406) | 0.001 |
| 术前肌酐水平 | 0.035 | 0.030 | 1.035(0.977~1.097) | 0.241 |
| 术前白细胞计数 | 0.764 | 1.145 | 2.147(0.227~20.263) | 0.505 |
| 术前D-二聚体水平 | 1.168 | 0.647 | 3.217(0.906~11.429) | 0.071 |
| EuroSCORE评分 | 0.218 | 0.447 | 1.243(0.518~2.986) | 0.626 |
| 体外循环时间 | 0.099 | 0.030 | 1.104(1.041~1.170) | 0.001 |
| 主动脉弓手术 | 0.630 | 0.615 | 1.877(0.563~6.261) | 0.306 |
| 术中及术后24 h红细胞输注量 | 1.551 | 0.371 | 4.717(2.278~9.767) | 0.000 |
| 常量 | -45.537 | 9.046 | — | — |
注:ALT:谷丙转氨酶;EuroSCORE:欧洲心脏手术风险评估系统
ROC曲线分析结果显示,联合预测因子Pre(AUC=0.927,95%CI:0.876~0.978,P=0.000)对术后HD的预测作用分别高于术前ALT水平(AUC=0.756,95%CI:0.652~0.861,P=0.000)、体外循环时间(AUC=0.781,95%CI:0.687~0.876,P=0.000)和术中及术后24 h红细胞输注量(AUC=0.830,95%CI:0.753~0.907,P=0.000),见图1、表4。
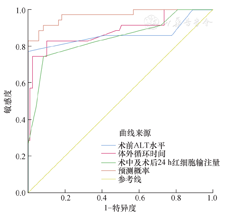

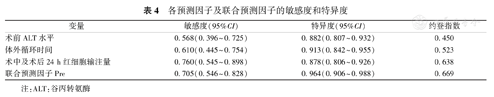
各预测因子及联合预测因子的敏感度和特异度
各预测因子及联合预测因子的敏感度和特异度
| 变量 | 敏感度(95%CI) | 特异度(95%CI) | 约登指数 |
|---|---|---|---|
| 术前ALT水平 | 0.568(0.396~0.725) | 0.882(0.807~0.932) | 0.450 |
| 体外循环时间 | 0.610(0.445~0.754) | 0.913(0.842~0.955) | 0.523 |
| 术中及术后24 h红细胞输注量 | 0.760(0.545~0.898) | 0.878(0.806~0.926) | 0.638 |
| 联合预测因子Pre | 0.705(0.546~0.828) | 0.964(0.906~0.988) | 0.669 |
注:ALT:谷丙转氨酶
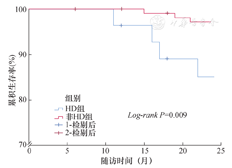
HD组患者住院早期死亡率明显高于非HD组患者(20.0%比5.0%,χ2=8.040,P=0.005)。顺利出院患者随访2年,失访率9.1%,平均随访(22.9±3.2)个月。HD组和非HD组随访期间分别死亡4例和3例,HD组患者近中期死亡率高于非HD组(14.3%比2.6%,Log-rank P=0.009),见图2。

主动脉夹层是心血管外科最为凶险的疾病,其并发症的发生率和死亡率仍是心脏外科手术中最高的,其中术后HD的发生明显增加了围术期死亡率[11],检索国内外资料关于Stanford A型主动脉夹层术后HD的文献较少,因此,分析夹层术后HD的危险因素,预防、减少术后HD的发生,意义重大。
目前临床上有多种HD分级方法[12,13],我们结合Zhou等[6]及国内其他相关文献将MELD评分≥15分定义为术后HD。本研究得出,Stanford A型主动脉夹层术后HD的发生率为22.4%,本组发生HD患者的围术期死亡率为20.0%。综合本研究及目前国内外其他相关研究,夹层术后HD患者的住院期间早期死亡率明显高于总的围术期死亡水平,且近中期随访死亡率明显高于未发生HD患者。
本研究还证实,术前ALT水平升高、体外循环时间延长和术中及术后24 h红细胞输注量增加是急性Stanford A型主动脉夹层患者术后发生HD的独立危险因素。
多数急性Stanford A型主动脉夹层患者会出现腹主动脉及其重要分支受累的情况,这可导致肝脏、胃肠道等重要腹腔脏器血供不足[14];夹层剥离导致的主动脉瓣关闭不全,以及心包压塞的发生,也会导致肝功能缺血性受损[15]。夹层患者全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的发生也会引起肝细胞的损害,导致患者术前即出现肝功能损伤。因此,对急性主动脉夹层患者应尽量缩短术前肝脏缺血时间。术前转氨酶升高的患者及时应用保肝药物,条件允许,尽可能在术前准备中予以保肝治疗。
体外循环时间延长是心脏手术后多器官功能损伤的危险因素,甚至导致死亡率的增加[16,17]。体外循环过程中发生SIRS,多种炎症因子激活[18],可引起肝脏损伤,血液有形成分破坏,微小血栓、气栓等都会导致肝脏毛细血管网栓塞,加重肝细胞损害[19]。体外循环是一种控制性休克状态,长时间的低流量及非搏动性灌注会引起肝细胞的损伤[20]。Stanford A型主动脉夹层手术体外循环甚至深低温停循环不可避免,我们应尽量缩短体外循环时间和深低温停循环时间,围术期可应用抑制炎症反应的药物如乌司他丁,抑制体内弹性蛋白酶的升高,减轻SIRS带来的肝细胞损伤。
心脏外科的用血量在总的用血量中占比可达50%以上,位居外科之首[21]。许多研究都证实了心脏术后的输血与多个脏器功能不全相关[10,17]。短时间内大量输注库存血,会导致肝细胞的直接损伤和肝细胞自身免疫保护机制的改变,可引起机体凝血机制和内环境的紊乱,影响肝细胞的供血及代谢[22],导致出血增加。因此围术期加强血液保护,减少出血。术前准备适量的血小板及冷沉淀,条件允许可以术前自体血储备,避免血液过度稀释,尽量使用自体血液回收装置。
综上所述,急性Stanford A型主动脉夹层病情复杂,围术期脏器功能不全发生率相对较高,HD一旦发生,死亡率就会明显增加。因此,围术期尽量缩短术前肝脏缺血时间,尽早手术重建主动脉,恢复脏器血供;尽量缩短体外循环时间;采取积极的血液保护措施;术前出现转氨酶升高患者围术期避免应用肝损伤药物,适当应用保肝药物及抗炎症反应药物。以此来避免或减轻夹层术后肝损伤的发生,改善患者早中期预后。本研究也有一定的局限性,一是样本来自单中心且样本数量偏少,下一步可联合多中心大样本研究。二是随访时间较短,且缺乏部分随访资料如随访期间并发症及死亡原因分析等,因此远期随访结果有待进一步研究,且需加强随访资料的完善。
无



























