
胆碱能抗炎通路是神经系统介导免疫反应的重要通路,其中,α7烟碱型乙酰胆碱能受体(α7nAChR)发挥关键作用。存在于免疫细胞、内皮细胞、平滑肌细胞上的非神经元性α7nAChR在动脉粥样硬化疾病进展和病理形成过程中发挥重要作用,本文就α7nAChR与动脉粥样硬疾病的关系作一总结。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
动脉粥样硬化(atherosclerosis,AS)是脂质氧化物、免疫细胞、炎症因子、内皮细胞、平滑肌细胞和胶原纤维等多种成分在血管内膜共同作用的结果。遗传及环境(吸烟、肥胖、糖-脂代谢紊乱、高血压)因素的异常均可造成体内代谢环境改变,在这些有害因素刺激下,造成血管内膜损伤,刺激血管细胞产生炎症分子,进一步激活血液和脾脏中的白细胞,在粘附分子的作用下,牵引白细胞向内膜破损区聚集。浸润到内膜的白细胞释放大量的细胞毒性物质(促炎细胞因子、活性氧、基质金属蛋白酶等)加剧内膜损伤[1]。迁向内膜的单核细胞转换为巨噬细胞,吞噬氧化的脂质形成泡沫细胞,标志着AS斑块形成的开始。同时,巨噬细胞释放大量生长因子和促炎介质,刺激血管平滑肌细胞迁移至内膜并增殖[2]。这些促炎因子参与并促进AS疾病进展。且在晚期AS斑块中,不可控的炎症级联反应是导致AS斑块坏死核心增大、纤维帽变薄、斑块破裂、出血及血栓形成的主要因素,进而引发组织器官缺血、梗死、卒中甚至猝死等严重不良事件[3]。胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)是神经系统介导的快速、直接的内源性抗炎机制。大量研究已证实,刺激胆碱能系统可抑制脓毒血症、失血性休克、炎症性肠病、缺血再灌注损伤等炎症性疾病炎症进展,发挥器官保护作用[4,5,6,7]。α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)是胆碱能抗炎通路中乙酰胆碱(acetylcholine,ACh)的作用受体,该受体的激活可调节全身免疫炎症反应。有研究报道,α7nAChR可参与对免疫细胞、内皮细胞及血管平滑肌细胞的功能调控,在AS的病理形成中具有重要影响。
CAP是神经系统调节免疫反应、控制炎症的重要路径。CAP作为一种敏感、快速、有效的抗炎机制,该通路的激活能以复杂的方式减轻炎症反应,且对免疫系统的抗炎机制无影响[8]。ACh是迷走神经(vagus nerve,VN)末梢释放到组织间隙的重要神经递质,可响应内、外环境中的刺激来调节神经网络。在CAP中VN活动增强使ACh合成及分泌增加,释放到组织间隙的ACh主要作用于免疫细胞上的烟碱型乙酰胆碱受体发挥抗炎效应,其中α7nAChR发挥关键作用。α7nAChR是烟碱受体家族中的一个五聚体离子通道,包含α、β、γ、δ、ε五种亚基,对钙离子具有高选择通透性,可调控细胞内钙离子流调控细胞内信号传导。研究发现,迷走神经刺激(vagus nerve stimulation,VNS)无法抑制α7nAChR基因敲除小鼠脾脏炎症细胞的产生;同时,α7nAChR缺乏的小鼠比野生型鼠产生更多的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)[9],表明完整的CAP需要α7nAChR。α7nAChR起初主要在中枢神经系统内被广泛研究,与阿尔兹海默病、帕金森及抑郁症等神经精神疾病有关。近年来,随着对CAP的深入研究,人们发现在神经系统以外的巨噬细胞、树突状细胞、淋巴细胞、内皮细胞和平滑肌细胞等非神经细胞内也表达α7nAChR,参与调控免疫反应、新生血管的生成以及细胞的增殖和凋亡[10]。
非神经元胆碱能系统指胆碱能成分在中枢神经系统以外的其他组织中表达。自CAP的概念被提出以来,因其高效的抗炎优势在各领域得到广泛研究。VNS可显著抑制脾脏炎症因子的产生,但VNS无法抑制脾切除术后小鼠体内的炎症因子水平[11],表明CAP的抗炎机制需要完整的脾交感神经反射。但脾脏缺乏胆碱能神经支配,研究发现脾脏T细胞是VNS时ACh的主要来源[12]。VNS通过腹腔神经节增强脾交感神经活动,诱导其释放去甲肾上腺素,去甲肾上腺素结合到T细胞上的β2肾上腺素能受体增加ACh释放[13,14]。这些非神经元性ACh通过结合于免疫细胞上的α7nAChR抑制TNF-α和其他促炎因子的释放。目前已在T淋巴细胞、B淋巴细胞、巨噬细胞、树突状细胞中发现ACh和合成ACh的前体物质胆碱乙酰转移酶及乙酰胆碱受体(烟碱和毒蕈碱)的表达。在炎症反应中,炎症介质的刺激使免疫细胞中胆碱乙酰转移酶表达上调增加ACh的合成,上调的ACh与免疫细胞中的α7nAChR相互作用,以自分泌或旁分泌的方式减少细胞因子的产生[15]。表明非神经元胆碱能成分介导的CAP通路在免疫应答中发挥重要作用。
AS作为一种高发病率和高致残率疾病一直以来备受关注,长期以来人们对AS发病机制的探究先后提出很多假说,其中AS的炎症和免疫机制得到了广泛认可,它认为AS是多种炎症细胞在血管内膜共同作用的结果。炎症和免疫系统的激活在AS的发生和进展及破裂中起着关键作用。CAP介导的抗炎免疫反应被认为与AS疾病的病理过程有关[16]。目前已在人颈动脉斑块区的炎症细胞中检测到α7nAChR的表达,且与野生型小鼠相比,骨髓敲减α7nAChR的Ldlr-/-小鼠更容易加剧主动脉区脂质及炎性细胞的积累[17]。表明α7nAChR可能通过调节免疫反应参与AS疾病过程。现已开发多种α7nAChR药理激动剂并已被验证与AS有关,Hashimoto等[18]发现选择性α7nAChR激动剂AR-R17779可抑制ApoE-/-小鼠主动脉区AS斑块及主动脉瘤的形成,并有效减少斑块区TNF-α、IL-1β 、IL-6及氧化物的产生。选择性α7nAChR激动剂GTS-21可降低AS斑块的形成,并抑制脾脏炎症细胞的产生,降低血液单核细胞水平,减少AS斑块区巨噬细胞浸润[19]。最近,人们探究了α7nAChR的新型激动剂AZ6983在AS病变中的影响,发现AZ6983可呈剂量依赖性地降低小鼠和人血液中TNF-α等炎症因子水平:在ApoE-/-小鼠AS模型中,AZ6983可抑制AS斑块的形成及全身炎症反应[20]。这些结果均支持胆碱能受体的激活通过介导AS斑块区的炎症介质的释放及氧化应激的产生,减轻AS疾病进展,发挥AS保护作用。
AS是多种炎性细胞在血管内膜相互作用的慢性炎症性病变。巨噬细胞、淋巴细胞、内皮细胞和血管平滑肌细胞等在AS进展中发挥重要作用。研究发现,非神经元α7nAChR在参与AS病变进展的多种细胞中发挥作用。在T淋巴细胞中,α7nAChR的激活可抑制Th1和Th17细胞的功能,从而减少TNF-α、IL-2、干扰素γ (interferon-γ,IFN-γ)等细胞因子的分泌。Ly-6/尿激酶型纤溶酶原激活物受体相关蛋白1 (SLURP-1)是α7nAChR的正构激活剂,在免疫反应中SLURP-1激活T细胞使ACh合成增加,通过与α7nAChR的相互作用来调节细胞因子的产生,表明α7nAChR的激活可调节T淋巴细胞的增殖和分化[21]。α7nAChR的激活可促进B淋巴细胞的增殖、抑制抗体IgG1生成和B淋巴细胞中TNF-α、IL-6和IFN-γ的合成及释放[22]。在巨噬细胞中,α7nACh的激活可调控巨噬细胞的极化,抑制巨噬细胞向M1型极化,增加M2型巨噬细胞数量,使其从促炎表型转换成抗炎表型[23]。有研究报道,α7nAChR基因敲减小鼠体内的C反应蛋白和IL-6水平增高,同时α7nAChR的缺失可促进巨噬细胞氧化应激,增加巨噬细胞摄取低密度脂蛋白,促进AS的形成[24]。在AS病变中,内膜损伤引起的屏障功能障碍是造成脂质积累及炎性细胞聚集的重要原因[25]。Li等[26]发现,α7nAChR可预防氧化应激诱导的内皮细胞凋亡和乳酸脱氢酶的产生及活性氧的释放,保护内膜免受氧化损伤。同时,内膜损伤后引起的低氧环境及炎症刺激促使AS斑块内新生血管生成增加,由于这些血管具有缺乏成熟性、通透性高和易脆性等特点,导致炎性细胞及脂质向斑块内渗出增加,加剧斑块内促炎环境。有证据表明,新生血管的形成与AS斑块的进展呈正相关。同时,炎症刺激下,血管平滑肌细胞在内膜的异常增殖及迁移,参与AS斑块的发生、发展。有报道发现,CAP功能障碍可加剧血管损伤后新生内膜的形成,促进血管平滑肌细胞向新生内膜增生,诱导内膜内炎症反应,促进血管重构,α7nAChR选择性激动剂PNU-282987可抑制炎症和氧化应激,从而抑制新生内膜增生[27]。另一项研究也证实,α7nAChR药理激活剂PNU-282987可抑制血管平滑肌细胞的迁移,并抑制血管平滑肌细胞线粒体功能障碍[28]。同时,血小板的过渡激活使机体处于高凝状态,增加AS血栓形成的风险;胆碱能成分可调控内源性血小板的过渡激活,改善血液的促凝状态[29]。综上,在AS病变中,免疫细胞中α7nACh激活引发的CAP活化通过影响免疫细胞的增殖和分化,参与机体的免疫应答,α7nACh也通过抑制血管内皮细胞凋亡及氧化损伤、抑制新生血管的生成及平滑肌迁移等发挥抗AS作用。
在CAP中,VN是将外周炎症信号传递给中枢的重要媒介。心脏具有副交感神经反射,它受交感神经及副交感神经支配。VN活性增强通过减少炎症损伤、降低氧化应激及线粒体功能障碍,进而减轻心肌损害、抑制心脏病理性重构和保护心功能。VN作为调节免疫和炎症反应的神经反射通路,可介导心脏与大脑间的炎症反射。在炎症反应中,VN感觉神经元可被外周促炎因子激活,VN将信号传递给大脑,反过来大脑自主神经系统的不平衡也会影响自主神经信号向心脏的流入,形成心脏和大脑之间的双向交流[30]。增加VN传出可阻止心脏炎症反应、降低心肌细胞纤维化。Koza等[31]发现心脏神经节神经元的密度与AS的发生率和斑块大小有关,在家兔AS实验模型中发现,在低神经元密度动物中更容易形成AS斑块。在另一项研究中,心脏压力反射降低可加重AS的发生,其潜在机制可能是压力反射功能障碍降低了VN张力,增加了体内氧化应激和炎症反应,导致血管损伤,选择性α7nAChR激动剂逆转了这一现象,并降低血清TNF-α和IL-6水平、降低巨噬细胞对氧化型低密度脂蛋白的摄取、抑制活性氧的产生,相反,压力反射增强无法改善α7nAChR敲除小鼠AS进展及体内炎症水平。表明压力反射功能障碍通过VN-α7nAChR胆碱能机制来加重小鼠AS的。因此,心脏迷走神经-α7nAChR介导的胆碱能系统的活化在AS保护中发挥重要作用(图1)。
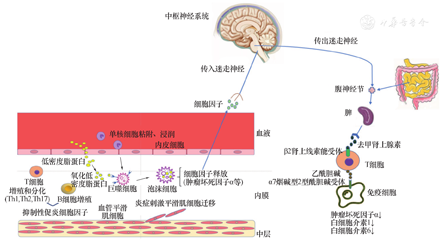

血管内皮功能受损,血浆中低密度脂蛋白(LDL)渗透内膜下并滞留,LDL被氧化成ox-LDL,同时单核细胞在趋化因子及粘附分子的作用下浸入血管壁并分化成巨噬细胞,巨噬细胞吞噬ox-LDL形成泡沫细胞释放炎症因子。释放到外周的炎症介质刺激迷走神经感觉神经元,激活后的迷走神经将信号传递给中枢,中枢经整合后发出迷走传出信号,通过腹腔神经节激活脾神经,脾交感神经兴奋释放去甲肾上腺素(NE),NE与T细胞上的β2肾上腺素能受体(β2AR)结合促使T细胞合成并释放乙酰胆碱(ACh), ACh作用于免疫细胞上的α7nAChR,促进免疫细胞的增殖和分化,抑制炎症因子释放。同时炎症刺激下,血管平滑肌细胞(VSMCs)向内膜迁移。表达于内皮细胞及VSMCs上的α7nAChR的激活也通过调节内皮血管新生及平滑肌细胞迁移抑制炎症因子及活性氧自由基的释放
CAP是近年提出的一种抗炎生理机制,具有快速、直接调控机体炎症免疫反应等特点,靶向CAP是一种有效、有前途的抗炎途径。尽管对其确切的调控机理尚不完全清楚,但大量研究已证实其可在多种炎症性疾病中发挥作用。其中,非神经元性胆碱能系统在免疫细胞、内皮细胞及血管平滑肌细胞中的表达,通过调控炎症应激、氧化损伤及新生血管生成、血管细胞的增殖、凋亡与AS疾病密切相关。尽管仍存有争议的是,Qin等[32]证实,尼古丁可通过α7nAChR的激活诱导内皮细胞功能障碍,促进AS斑块的形成。而慢性尼古丁暴露并不会影响内皮细胞的功能并可增加主动脉平滑肌的松弛。这可能与尼古丁给药方式、刺激浓度、作用时间及作用方式不同有关。此外,尼古丁可激活肥大细胞上的α7nAChR引起肥大细胞的活化,促进AS斑块的形成,这与巨噬细胞α7nAChR激活抵抗免疫反应,保护AS机制相反。可见,不同免疫细胞中α7nAChR的激活对AS发展的影响仍有争议。尽管CAP介导的AS保护机制仍需要更多的研究来充分阐明,但胆碱能信号对免疫调节的有益作用有望成为AS炎症的潜在调节因子。
无



























