
低压低氧是高海拔地区最主要特征,心脏是机体耗氧最大的组织器官,对缺氧十分敏感。大量研究佐证了微小RNA与心血管系统损伤的相关性,但高原低氧环境致心血管系统损伤与微小RNA相关研究较少。本文总结该领域相关研究进展,探讨今后研究趋势以及存在的利弊,以期为高原低氧环境致心血管系统损伤的治疗和干预提供有价值的参考资料。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
海拔2 500米以上地区约占我国国土面积1/3,低压缺氧是该地域独有特征[1]。机体在此环境中多个器官会发生病理生理改变,影响最为严重的是心血管系统[2],而目前对于高原低氧所致心血管系统损伤相关疾病缺乏有效诊疗和干预措施。微小RNA(microRNA,miRNA)普遍存在于动、植物中,是控制重要生物学进程基因表达的调节子,包括外显子miRNA和内含子miRNA,长度约22个核苷酸(nt),通过结合靶mRNA的3’非编码区来调节转录后水平上蛋白质编码基因表达[3]。已证实miRNA几乎参与各种病理生理进程,在心血管疾病(cardiovascular diseases,CVD)中诸多研究已将miRNA作为潜在生物标志物的研究对象,但高原低氧环境致心血管系统损伤与miRNA相关性研究却鲜有报道。鉴于此,本文聚焦高原特殊生态以及我国目前所处的复杂周边环境,以miRNA为切入点总结该领域当前最新研究进展(表1),阐明CVD-miRNA之间的相关性以期为此特殊环境下CVD诊疗和干预提供新策略。
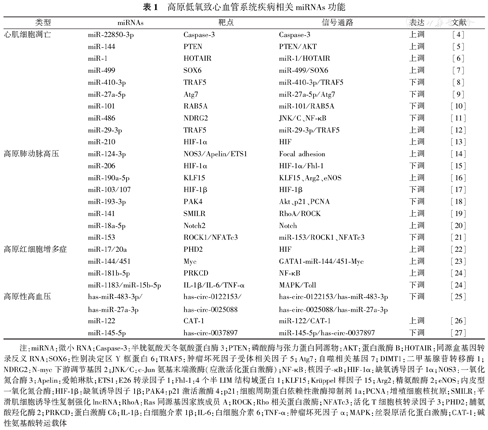
高原低氧致心血管系统疾病相关miRNAs功能
高原低氧致心血管系统疾病相关miRNAs功能
| 类型 | miRNAs | 靶点 | 信号通路 | 表达 | 文献 |
|---|---|---|---|---|---|
| 心肌细胞凋亡 | miR-22850-3p | Caspase-3 | Caspase-3 | 上调 | [4] |
| miR-144 | PTEN | PTEN/AKT | 上调 | [5] | |
| miR-1 | HOTAIR | miR-1/HOTAIR | 上调 | [6] | |
| miR-499 | SOX6 | miR-499/SOX6 | 上调 | [7] | |
| miR-410-3p | TRAF5 | miR-410-3p/TRAF5 | 下调 | [8] | |
| miR-27a-5p | Atg7 | miR-27a-5p/Atg7 | 下调 | [9] | |
| miR-101 | RAB5A | miR-101/RAB5A | 下调 | [10] | |
| miR-486 | NDRG2 | JNK/C、NF-κB | 下调 | [11] | |
| miR-29-3p | TRAF5 | miR-29-3p/TRAF5 | 上调 | [12] | |
| miR-210 | HIF-1α | HIF | 上调 | [13] | |
| 高原肺动脉高压 | miR-124-3p | NOS3/Apelin/ETS1 | Focal adhesion | 上调 | [14] |
| miR-206 | HIF-1α | HIF-1α/Fhl-1 | 下调 | [15] | |
| miR-190a-5p | KLF15 | KLF15、Arg2、eNOS | 上调 | [16] | |
| miR-103/107 | HIF-1β | HIF-1β | 下调 | [17] | |
| miR-193-3p | PAK4 | Akt、p21、PCNA | 下调 | [18] | |
| miR-141 | SMILR | RhoA/ROCK | 上调 | [19] | |
| miR-18a-5p | Notch2 | Notch | 上调 | [20] | |
| miR-153 | ROCK1/NFATc3 | miR-153/ROCK1、NFATc3 | 下调 | [21] | |
| 高原红细胞增多症 | miR-17/20a | PHD2 | HIF | 上调 | [22] |
| miR-144/451 | Myc | GATA1-miR-144/451-Myc | 上调 | [23] | |
| miR-181b-5p | PRKCD | NF-κB | 上调 | [24] | |
| miR-1183/miR-15b-5p | IL-1β/IL-6/TNF-α | MAPK/Toll | 下调 | [24] | |
| 高原性高血压 | has-miR-483-3p/has-miR-27a-3p | has-circ-0122153/has-circ-0025088 | has-circ-0122153/has-miR-483-3p | 下调 | [25] |
| has-circ-0025088/has-miR-27a-3p | |||||
| miR-122 | CAT-1 | miR-122/CAT-1 | 上调 | [26] | |
| miR-145-5p | has-circ-0037897 | miR-145-5p/has-circ-0037897 | 下调 | [27] |
注:miRNA:微小RNA;Caspase-3:半胱氨酸天冬氨酸蛋白酶3;PTEN:磷酸酶与张力蛋白同源物;AKT:蛋白激酶B;HOTAIR:同源盒基因转录反义RNA;SOX6:性别决定区Y框蛋白6;TRAF5:肿瘤坏死因子受体相关因子5;Atg7:自噬相关基因7;DIMT1:二甲基腺苷转移酶1;NDRG2:N-myc下游调节基因2;JNK/C:c-Jun氨基末端激酶(应激活化蛋白激酶);NF-κB:核因子-κB;HIF-1α:缺氧诱导因子1α;NOS3:一氧化氮合酶3;Apelin:爱帕琳肽;ETS1:E26转录因子1;Fhl-1:4个半LIM结构域蛋白1;KLF15:Krüppel样因子15;Arg2:精氨酸酶2;eNOS:内皮型一氧化氮合酶;HIF-1β:缺氧诱导因子1β;PAK4:p21激活激酶4;p21:细胞周期蛋白依赖性激酶抑制剂1a;PCNA:增殖细胞核抗原;SMILR:平滑肌细胞诱导性复制强化lncRNA;RhoA:Ras同源基因家族成员A;ROCK:Rho相关蛋白激酶;NFATc3:活化T细胞核转录因子3;PHD2:脯氨酸羟化酶2;PRKCD:蛋白激酶Cδ;IL-1β:白细胞介素1β;IL-6:白细胞介素6;TNF-α:肿瘤坏死因子α;MAPK:丝裂原活化蛋白激酶;CAT-1:碱性氨基酸转运载体
心肌损伤与心肌细胞凋亡密切相关,当机体处于高海拔地区时心肌细胞感受外界环境变化启动自身程序性死亡,这种凋亡受到机体严密监控,miRNA在其中扮演重要角色。牦牛是生活在我国青藏高原及其邻近地区的一种独特家畜品种,为了适应极端的高海拔环境牦牛已进化出一些解剖和生理特性,包括更大的心脏和肺。Zhang等[4]在研究牦牛高海拔适应中发现,miR-22850-3p在牦牛心脏和肺组织中高表达,miR-22850-3p通过靶向Caspase-3减轻高原缺氧诱导的细胞凋亡。在高原低氧大鼠心肌损伤模型中,低压低氧可导致心肌组织miRNA表达谱发生显著变化,其中miR-144/451及miR-132/212基因簇表达差异最为显著,进一步验证发现miR-144-3p与低压低氧致心肌损伤密切相关。Wen等[5]也验证了在低氧条件下骨髓间充质干细胞衍生的外泌体所含miR-144通过靶向PTEN/AKT途径来抑制心肌细胞凋亡。miR-210属于缺氧诱导型miRNA,在心肌细胞凋亡和促血管生成方面具有重要作用,体外实验表明将miR-210前体转染进入HL-1小鼠心肌细胞,能够明显降低缺氧诱发的Caspase-3/7活性增加,而抑制miR-210表达则能强化Caspase-3/7活性,促进心肌细胞凋亡[28]。HOTAIR是HOX基因表达调节剂,具有保护心肌细胞功能,研究表明在缺氧诱导新生大鼠心肌细胞中HOTAIR表达下调,过表达HOTAIR极大限制了缺氧诱导心肌细胞凋亡,且HOTAIR的心脏保护功能基于miR-1负调控[6]。miR-499是心脏表达量最丰富的miRNAs之一,具有抗心肌细胞凋亡作用,miR-499通过靶向转录因子SOX6抑制缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的心肌细胞损伤[7]。缺氧预处理可触发凋亡并抑制AC16细胞活力,且miR-410-3p被下调,过表达miR-410-3p通过靶向TRAF5保护缺氧诱导的心肌细胞损伤[8]。在不同缺氧暴露时间点H9c2细胞中miR-27a-5p表达下调,miR-27a-5p通过Atg7调节H9c2细胞自噬和凋亡,从而减轻缺氧引起的细胞损伤[9]。Wu等[10]也证实,H/R诱导H9c2细胞凋亡并伴有miR-101表达下调,miR-101通过靶向RAB5A诱导自噬,抑制miR-101减弱了H/R诱导的H9c2细胞凋亡。缺氧抑制了H9c2细胞中miR-486表达,miR-486通过靶向NDRG2灭活JNK/c-Jun和NF-κB信号通路,减轻H9c2细胞缺氧诱导损伤[11]。大量研究表明,miRNA与高原低氧环境致心肌损伤密切相关,然而目前该领域研究仅涉及细胞和动物模型以及生物信息学预测,相互作用机制和复杂调控网络尚未阐明,明确高原低氧环境下心肌损伤与miRNA调控网络将有助于推进成果转化及临床应用。
高原肺动脉高压(high-altitude pulmonary hypertension,HAPH)是以慢性缺氧导致肺血管收缩以及结构重构为特征的严重进行性疾病,HAPH发病机制复杂,且尚不明确[29]。miRNA参与HAPH复杂网络调节,已有将miRNA作为HAPH生物标记物的相关研究[30]。肺外膜成纤维细胞的活化在缺氧性HAPH的肺血管重构中起关键作用,Luo等[31]研究表明miR-29a-3p在缺氧状态下调节肺外膜成纤维细胞的活化和表型,肺外膜成纤维细胞的活化伴随miR-29a-3p表达下调,miR-29a-3p可显著降低缺氧性HAPH大鼠的肺动脉压和右心室肥大指数并改善肺血管重构。高原低压缺氧会破坏机体血管稳态导致HAPH发生,Alam等[14]研究证实此环境中miR-124-3p与血管稳态和缺氧基因NOS3、Apelin及EST1具有相关性,miR-124-3p通过抑制缺氧基因表达在HAPH病理生理进程中发挥重要调控作用。HIF是缺氧相关疾病研究领域的重大发现,缺氧导致miRNA表达变化的机制可通过HIF-1依赖性和HIF-1非依赖性途径介导,已证实HIF-1上调后在肺动脉高压(pulmonary hypertension,PH)中发挥作用,尤其是缺氧诱导的肺动脉高压(hypoxia-induced pulmonary hypertension,HPH)中[32]。在HAPH大鼠模型肺组织中抑制miR-322后Apelin表达进一步升高,miR-322可能通过降低肺组织内源性Apelin蛋白的表达,降低机体血管扩张反应。肺血管重构是PH重要病理特征,其中肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)的表型转换起关键作用。Yue等[15]研究指出,miR-206对肌生成及相关疾病至关重要,在缺氧大鼠模型和缺氧PASMCs中评估miR-206表达发现,缺氧诱导的miR-206下调通过靶向PASMCs中HIF-1α/Fhl-1通路参与PH发生,循环中的miR-206可能是缺氧诱导的PH早期触发因素。缺氧诱导的PH动物模型体内实验研究发现,miR-190a-5p表达水平明显高于对照组,miR-190a-5p通过靶向KLF15调节HPH,且miR-190a-5p循环水平与HPH严重程度密切相关[16]。Blissenbach等[33]为了验证血浆miRNA与HPH之间相关性,招募40名在7 050米高海拔探险的健康志愿者,通过反复RT-PCR检测发现循环miRNA与海拔依赖性增加,且miR-17、miR-190的高表达与收缩期肺动脉压(systolic pulmonary artery pressure,SPAP)显著相关。HAPH形成是一个慢性动态变化过程,不同时期病理生理变化和特定miRNA密不可分,更重要的是许多miRNA表达水平与HAPH严重程度及预后相关,充分表明循环中的miRNA有望作为HAPH早期检测的一种新型标志物。
高原红细胞增多症(high altitude polycythemia,HAPC)是红细胞过度代偿性增多以减轻机体缺氧为主要特征的慢性进行性疾病,高原持续低氧是其发病的根本原因,但确切发病机制尚未阐明,目前缺乏有效预防和干预措施。针对不同海拔人群红细胞miRNA谱的差异研究发现,高海拔低氧环境显著影响人类红细胞miRNA表达谱,miR-144-5p、miR-30b-5p表达变化最为明显,差异表达miRNA潜在靶基因参与红系缺氧和一氧化氮相关信号通路[34]。氧依赖调控红细胞聚集的关键途径是PHD:HIF途径[35]。平滑肌细胞特异性敲除miR-17~92可显著减轻缺氧诱导的PH,但miR-17~92介导的PASMC增殖机制尚不明确。Chen等[22]研究miR-17~92通过PHD调节HIF活性和PASMC增殖机制,结果表明PHD2是miR-17/20a的直接靶点,miR-17~92通过抑制PHD2和诱导HIF-1α促进PASMC增殖和红细胞增生。miR-144在红系祖细胞内高度特异性表达,参与CVD发生发展[36]。既往有关miR-144在高原低氧环境中对CVD影响研究鲜有报道,冯振龙等[37]通过SD大鼠缺氧模型发现随着高原低氧暴露时间的延长,大鼠血浆中miR-144-3p、miR-144-5p表达量逐渐增加,且与红细胞计数、血红蛋白呈正相关,表明miR-144在低氧刺激下高表达可导致HAPC。GATA-1、miR-451a对红系分化至关重要[23],在研究GATA-1与miR-451a相关性时发现,HAPC患者外周血CD34+造血干/祖细胞在低氧环境向红系分化过程中,GATA-1与miR-451a表达呈负相关。在缺氧诱导的K562细胞中GATA-1蛋白表达量升高,GATA-1表达的增加可上调miR-451a的表达,从而抑制14-3-3ζ蛋白表达,阻碍K562细胞红系分化模型中的细胞增殖,对红系分化有重要促进作用。血浆miR-130a-3p在高原低氧环境中表达的研究表明,miR-130a-3p与红细胞计数、血红蛋白、红细胞比容呈正相关,miR-130a-3p可能通过参与红细胞生成和巨噬细胞分化来调节机体对缺氧环境的适应过程[38]。有关HAPC与miRNA相关的直接研究证据较少,但miRNA与缺氧诱导红系分化研究已很充分,尤其是在白血病、地中海贫血、肿瘤等方面。目前对于HAPC缺乏有效诊疗手段,而miRNA由于其自身特性或许会为HAPC研究提供新思路。
高原环境中机体对低氧产生急性应激反应,体液中可促进血压升高的生物活性物质儿茶酚胺类增多以及心排血量增加引起的血压升高称为高原性高血压,但目前全世界尚无高原性高血压的统一定义共识或指南。高原性高血压发病机制主要有血液黏滞性增大、交感神经激活、NO和H2S代谢异常以及HIF。红细胞数量和体积变化是导致血液黏滞性改变的根本原因,已证实miR-130a-3p与红细胞计数、红细胞比容呈正相关[38]。低氧暴露可引起机体血液重新分布,导致交感神经活动明显增强,肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system,RAAS)被激活。miRNA是RAAS的重要调节因子,Chu等[39]探讨了原发性高血压(essential hypertension,EH)患者miR-136水平与RAAS生化标志物之间的相关性,发现EH患者外周血中miR-136表达明显升高,miR-136表达与RAAS生化标志物呈显著负相关,高表达的miR-136预示着高血压患者用药后的预后良好。He等[25]也证实,在EH患者中RAAS相关的has-miR-483-3p和has-miR-27a-3p下调,而与RAAS相关蛋白has-circ-0122153和has-circ-0025088上调,涉及has-circ-0122153/has-miR-483-3p和has-circ-0025088/has-miR-27a-3p轴是潜在的EH通路。气体信号分子NO和H2S参与了高原性高血压病理生理过程,且随病情发展出现升高趋势,已成为高原性高血压风险预警分子及关键调节分子。Zhang等[26]研究发现,EH患者血浆中miR-122显著升高,CAT-1水平显著降低,miR-122通过抑制CAT-1蛋白的表达降低L-精氨酸转运,从而影响内皮细胞NO合成与释放,miR-122的高表达似乎是高血压患者内皮功能障碍的危险因素。高原性高血压与EH有类似的病理生理过程,miRNA在EH中发挥的重要调控作用已有大量研究佐证,但高原性高血压与miRNA相关研究尚处起步阶段,期望通过上述对miRNA与EH总结为高原性高血压与miRNA研究提供借鉴。
高原低氧环境致心血管系统损伤至今仍缺乏有效防治措施,该领域研究已日趋成为当今研究热点。大量研究证据表明miRNA参与调控蛋白编码基因的表达[40],miRNA与高原CVD发生发展的相关性已成定论,但当前研究仅限于生物信息预测、细胞及动物模型验证,尚未全面系统反映miRNA在机体内发挥的整体调控作用,极大地限制了其在临床上推广应用。本文总结miRNA在高原低氧环境致CVD最新研究进展,通过文献得出以下体会供参考:(1)miRNA自身的结构特殊性使其调控网络具有复杂和多变的特点,尤其是在低氧特殊环境暴露下更加明显,如在高原环境下人体HIFs信号通路被激活,细胞对缺氧的应激反应主要受转录因子HIF调节,HIF稳定性对于缺氧组织发挥了保护性效应,而与HIFs相关miRNA众多且miRNA-miRNA之间具有协同与拮抗作用,对于这种复杂调控网络研究尚处于起步阶段。(2)高原低氧环境致心血管损伤为慢性进行性疾病,体液中miRNA水平会随着缺氧程度及疾病进程发生改变呈现动态变化过程且受到诸多因素影响,这种变化为我们研究高原环境下CVD分期和诊疗提供了新视野,但目前无相关文献报道。(3)低氧外泌体(hypoxic exosomes,HPC-exos)中circHIPK3在氧化条件下通过miR-29a介导的IGF-1表达在心脏微血管内皮细胞(cardiac microvascular endothelial cells,CMVECs)中起作用,从而减少氧化应激诱导的CMVECs功能障碍。Yang等[41]发现,低氧刺激心肌细胞中miR-30a高度富集,HIF-1α调节miR-30a表达在低氧后可通过外泌体在心肌细胞间有效转移miR-30a,抑制miR-30a会增加核心自噬调节因子beclin-1、Atg12和LC3Ⅱ/LC3Ⅰ表达,这有助于维持缺氧后心肌细胞的自噬反应。外泌体来源的miRNA与高原心血管损伤相关性研究将会是以后研究的热点,或许会成为高原CVD靶向诊疗新方向。(4)HIF无疑是缺氧研究领域明星分子,miRNA与高原CVD相关性无可非议,但在临床应用还存在诸多缺陷,如缺乏特异性、不可操控性等。(5)疾病发生发展受到诸多miRNA参与调控,且miRNA分布和表达有高低之分,调控作用也有主次之别。在我们对高原低氧环境致心血管系统损伤与miRNA研究进展的总结中发现miR-144发挥关键调控作用,以miR-144为节点展开miRNA-miRNA之间在高原缺氧环境致CVD中作用研究无疑是该领域研究的捷径。
高原医学的发展对于我国经济发展和国防安全意义重大,心血管系统对高原缺氧极为敏感,是我们关注和研究的焦点。miRNA在高原环境致心血管系统损伤中的重要调控作用近年来逐步被发掘,但其复杂的调控机制尚未揭晓。因此,迫切需要找到新颖的切入点以加快研究进展。本综述从心肌损伤、HAPH、HAPC以及高原性高血压4个方面系统总结高原低氧环境致心血管系统损伤与miRNA研究进展,以期为该领域研究提供可借鉴的参考资料。
无



























