
心脏移植是治疗终末期心力衰竭的最佳方案,但因移植供体稀缺,影响了心脏移植的应用。连续血流左心室辅助装置(CF-LVAD)除了作为心脏移植过渡治疗外,对于无法进行心脏移植的患者也可作为他们的最终选择。虽然近年来CF-LVAD的性能得到很大改善,植入量也在逐年上升,但植入后引起的并发症常常困扰着术后患者并影响患者生活质量,而这些并发症的发生与血压控制不良有密切关系。本文将从CF-LVAD植入后患者血流动力学特点、血压增高导致CF-LVAD植入后并发症的发生机制以及CF-LVAD植入后患者的血压管理几个方面进行论述。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
心力衰竭(简称"心衰")是心血管专科的常见疾病,具有较高住院率、复发率及死亡率。截至2020年,全球心衰患者数量高达2 250万,并以每年200万人的速度逐年递增[1],而我国心衰患者人数已达890万,且患病人群呈现年轻化趋势[2]。通过有效的药物干预可延缓心衰患者的疾病进展,降低死亡率,而对于终末期心衰患者来说药物治疗效果较差,其最佳治疗方案为心脏移植,但因供体稀缺,此类患者常常需要通过植入心室辅助装置等外科治疗逆转心室重构,辅助或替代受损心脏功能,改善患者生活质量和长期预后。现阶段,随着研发技术的不断完善,左心辅助装置从最初的搏动泵发展至连续血流恒流泵,恒流泵又可分为轴流泵和离心泵,目前临床应用最多类型即连续血流左心室辅助装置(continued flow-left ventricular assist device,CF-LVAD)[3]。近年来,随着左心辅助装置应用增多,患者生存率也明显提高。据国际心脏机械辅助循环注册中心(Interagency Registry for Mechanically Assisted Circulatory Support,INTERMACS)报道,2006年6月至2017年12月共有25 145例成人心衰患者植入了左心辅助装置,1年生存率高达83%,5年生存率46%[4]。左心辅助装置已成为国内外指南推荐的心衰标准化治疗方式之一[5,6]。虽然CF-LVAD是最常用的心室辅助装置,但植入后患者血管搏动性降低,脉压下降,易导致出血、脑卒中、泵血栓、右心衰竭、心律失常和主动脉瓣反流等相关并发症的发生[7],而上述并发症的发生常常与术后血压控制不良有关。Willey等[8]研究表明,血压控制不佳是引起泵血栓形成和卒中发生等并发症的主要原因。目前CF-LVAD植入后患者血压控制目标尚未明确,准确测量血压,加强血压的控制管理对于减少CF-LVAD患者术后并发症的发生起着重要作用。
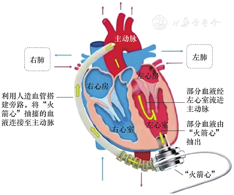
CF-LVAD是一种能够代替衰竭心脏射血的机械泵,它通过从左心室连续泵出血液来满足全身组织灌注所需的心排血量[9]。CF-LVAD主要由流入套管、泵外壳、流出套管和经皮外接导管组成[10],由中国运载火箭技术研究院与天津泰达国际心血管病医院联合研发的最新一代VAD"火箭心"的组成及工作原理如图1、图2所示。泵输出血流量主要取决于流入套管和流出套管之间的压差以及泵流量,二者均可受到压力变化的影响,因此CF-LVAD心排血量主要取决于心脏后负荷(即血压)。CF-LVAD植入后患者的泵血流量曲线和血压曲线与健康人不同,泵流速升高既增加了主动脉的压力,又因泵出更多的血液降低了左心室压力,从而使收缩压的峰值降低。这种情况下,由于左心室主动收缩射血减少,主动脉瓣处于关闭状态,主动脉和外周循环的血流搏动减弱,引起舒张压下降减少,患者的脉压可以降低到传统方法无法触及脉搏的程度。



CF-LVAD独特的血流动力学特点使得血压增高成为患者发生多种并发症的重要危险因素。有研究报道,持续血压升高会导致CF-LVAD植入后患者出现右心衰竭、血栓栓塞、卒中、心律失常、出血以及主动脉瓣关闭不全等并发症[11]。与普通心衰患者相比,CF-LVAD植入后患者心脏对于后负荷的敏感性更高,当后负荷升高时,CF-LVAD植入后患者的心排血量降低明显,心室容量负荷及血管阻力增加显著,更容易引起左房压和肺动脉压力增加,进而出现右心衰竭[12],同时造成的血液淤滞及血栓形成也易导致全身血栓栓塞和卒中[13]的发生。此外,心室容量负荷增加或植入术后引起的心肌损伤也可导致心内膜下缺血和室性心律失常的发生[14,15]。CF-LVAD植入后的患者血管搏动长期减弱,由于缺乏周期性搏动易导致血管内皮功能减退,血压小幅度的升高就可加剧内皮细胞微循环损伤,进而导致局部血管发生损伤甚至破裂[16]。在长期的抗凝治疗的情况下,血压升高不但增加了颅内缺血性和出血性卒中的风险,也增加了胃肠道、黏膜等部位的出血风险[17]。此外,有研究表明,CF-LVAD植入后患者血压升高可使关闭的主动脉瓣膜因缺乏活动性更易发生融合和退化,进而出现狭窄或关闭不全[18,19]。
由于CF-LVAD本身的物理特性及植入后独特的血流动力学特点,使得CF-LVAD植入后患者的血压测量更具有挑战性。目前,CF-LVAD植入后患者血压测量金标准是有创动脉血压监测[19],由于其具有创伤性且患者无法自行操作,临床上目前常采用多普勒超声和无创自动血压计相结合的方法测量CF-LVAD植入后患者的血压[8]。Lanier等[20]报道,通过比较30例CF-LVAD住院患者的有创动脉血压和多普勒血压测量结果,发现超声多普勒血压测量不仅能准确反映患者动脉血压,也能准确测量出低脉压下的平均动脉压(mean artery pressure,MAP),其准确率高达95%。血压的准确测量往往受到脉压的影响,针对脉压下降程度不同,采取的测量血压方式也不同。若脉搏可触及,可用自动血压计直接测量收缩压和舒张压,计算MAP,MAP=(收缩压+舒张压×2)/3。目前临床上主要使用的自动血压计是Terumo Elemano血压监测仪[21],依靠其对脉压的高敏感性,可有效地测量植入CF-LVAD后患者的收缩压和舒张压[22]。此外有研究表明,通过与台式水银血压计比较,欧姆龙上臂式电子血压计测量心血管疾病患者血压有更高的准确性和敏感性,可用于心血管疾病患者的血压测量[23],目前主要用于天津泰达国际心血管病医院植入磁液悬浮心室辅助装置术后患者的血压监测。
当CF-LVAD植入后患者脉压<15 mmHg时,大多数自动血压计常常测不出血压,此时需使用多普勒超声与无创自动血压计相结合的方式来测量患者的血压[24]。首先,在安静环境下,通过自动血压计测量患者血压3次,如果3次中至少有2次可以用自动血压计测得,则血压读数的平均值被认为是患者的血压值;如果使用自动血压计测得1次血压读数或没有读数,则需结合多普勒超声仪器测量血压,测量步骤如下:(1)超声探头识别肱动脉或桡动脉;(2)手动充气袖带;(3)置探头于动脉上方缓慢袖带放气;(4)听到脉冲声的血压代表MAP。由于多普勒测压方法对专业技术知识的要求较高,且耗时较长,因此对于院外患者在家中自行测量仍有困难。2019年,Granegger等[22]发现并使用了一种新型多普勒血压测量仪用于测量CF-LVAD植入后患者血压,通过将新型超声波传感器放置在患者的手腕上,记录袖带放气时桡动脉内的血流速度,再结合sigmoid曲线拟合出一个预处理的速度信号,用于确定收缩压和平均压的数值。经验证,这种多普勒方法得到的收缩压和平均压的数值与有创测量的血压一致,该系统操作简单可用于院外患者的血压测量。
CF-LVAD植入后患者血压控制的重要性已被广泛认可,但术后患者的血压控制目标目前尚无统一标准。2010年,国外CF-LVAD治疗晚期心衰的临床管理指南指出,CF-LVAD植入后患者MAP控制目标为70~80 mmHg[25]。2013年,国际心肺移植学会机械循环支持指南建议将MAP维持在80 mmHg以下[26]。预防心脏血栓临床管理试验方案显示,在应用植入物和围术期管理期间,将MAP维持在90 mmHg以下,泵血栓的发生率较低[27]。有研究表明,加强植入HVAD(离心式CF-LVAD)患者的血压管理(目标MAP<85 mmHg)能够降低卒中的发生率[28]。一项针对HeartWare HVAD植入后评估脑血管意外发生风险因素的研究显示,MAP>90 mmHg、INR>3.0以及阿司匹林剂量<81 mg/d会增加出血性脑血管意外的发生风险,而降低MAP可减少出血性脑卒中的发生,同时不会增加缺血性脑卒中的发生[29]。有一项华盛顿大学的研究报告显示,CF-LVAD植入后收缩压持续>100 mmHg会增加缺血性和出血性卒中的风险[30]。国外最新研究提出,CF-LVAD植入者的MAP应维持80~85 mmHg,当MAP<60 mmHg时会导致低灌注,因此推荐最佳目标为70~90 mmHg[31]。目前,欧洲心脏病协会建议CF-LVAD植入后合并高血压患者MAP降压目标为70~90 mmHg[24]。
目前,指南推荐使用常规心衰治疗药物对CF-LVAD植入后患者的血压进行干预,主要包括血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂、钙通道阻滞剂、血管紧张素受体脑啡肽酶抑制剂(ARNI)、盐皮质激素受体拮抗剂、ɑ受体阻滞剂和硝酸盐制剂等,可以使用一种或联合使用两种药物降压。ACEI、ARB是治疗左室辅助装置植入后高血压的首选药物[32]。Lampert等[12]研究发现,在控制CF-LVAD植入后患者血压的药物中,ACEI和ARB的使用率最高,可能是由于ACEI和ARB能抑制血管增生,有利于降低CF-LVAD植入者出血风险。β受体阻滞剂可与ACEI、ARB联合使用,合并右心衰竭患者使用β受体阻滞剂时需注意其负性肌力作用,β受体阻滞剂也可用于合并快速性心律失常患者,但需注意右心衰竭恶化的风险。钙通道阻滞剂,特别是二氢吡啶类,可作为第三种选择。有研究表明,沙库巴曲缬沙坦在CF-LVAD植入患者中具有良好的降压效果[33]。硝酸盐制剂不应与可降低肺动脉压的磷酸二酯酶Ⅴ型抑制剂联合使用,以避免严重低血压发生,危机患者生命[25]。
CF-LVAD的应用改变了终末期心衰患者的治疗现状,显著降低了患者的病死率,同时植入CF-LVAD的患者也面临着较高的术后并发症发生风险,积极管理患者术后血压水平,有效防止并发症的发生,是改善患者预后的重要前提。积极开展CF-LVAD术后血压相关的临床及基础研究,可更好地指导临床治疗,使更多终末期心衰患者从中受益。
无



























