
除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
病例1:男性,49岁,因"胸闷伴气急1年"于2017年7月3日收入我院心血管外科。患者1年前剧烈运动后出现胸闷伴气急,休息后症状可缓解。此后上述症状间断出现。当地医院就诊行心脏超声提示肺动脉干不完全栓塞,肺动脉中重度高压。肺动脉CT血管造影检查示肺动脉及右心室内片状低密度影,考虑血栓形成。下肢血管超声检查未见明显异常。进一步行心脏磁共振成像检查示右室流出道狭窄,考虑右室流出道平滑肌瘤可能性大;室间隔增厚。于另一医院行全身PET/CT检查,示心脏占位,侵犯右室、肺动脉瓣、肺动脉及升主动脉壁。为进一步诊治来我院。入院查体:听诊心率75次/min,律齐,胸骨左缘第2~3肋间可闻及收缩期Ⅲ/6级喷射样杂音。辅助检查:血常规、肝肾功能、凝血功能、尿常规无明显异常。初步诊断心脏肿瘤。于2017年7月8日在全麻体外循环下行心脏移植术,术中见心包无粘连,心包腔内少量淡黄色积液;心脏及大血管位置正常,右心明显肿胀;升主动脉外壁及主动脉弓小弯侧可见大量肿瘤外侵结节,质硬;主动脉弓大弯侧及无名动脉、左颈总动脉及左锁骨下动脉未见肿瘤侵犯;肺动脉主干可触及质硬肿瘤结节;左心耳可见肿瘤侵犯累及。心脏病理:大体所见右心明显肿胀,升主动脉外壁、主动脉弓小弯侧及肺动脉主干可见大量质硬肿瘤结节,左心耳可见肿瘤侵犯累及;镜下升主动脉部位可见大量分化成熟的浆细胞及少量淋巴细胞浸润,局部围绕神经纤维或小血管周围,间质伴有大量纤维组织增生,并不同程度的玻璃样变性(图1);免疫组化示慢性硬化性炎性病变,IgG4+细胞>200个/HPF,且IgG4/IgG>40%(图2),符合IgG4相关硬化性疾病。结合术后病理修正诊断为IgG4相关性心脏疾病。术后给予他克莫司、麦考酚钠肠溶片、泼尼松等抗炎抗排异治疗,恢复良好出院。
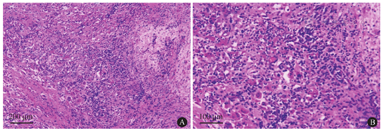

大量成熟浆细胞及少量淋巴细胞浸润,间质伴纤维组织增生及玻璃样变[HE染色,×100(A),×200(B)]
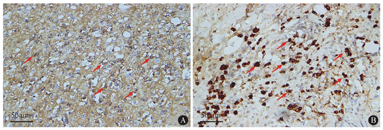

A:IgG+浆细胞(IHC,×400);B:IgG4+浆细胞(IHC,×400)
病例2:男性,61岁,因"胸闷、气短、双下肢水肿1月余"于2020年6月5日收入院。患者于入院前1个月无明显诱因出现胸闷、气短,持续约2 min,休息后缓解。伴有双下肢水肿、乏力。当地胸部CT检查提示两肺间质性改变,双侧胸腔积液,心包积液。既往合并高血压、糖尿病。入院查体:血压116/82 mmHg,心前区无隆起,心尖搏动未见异常,未触及震颤,未触及心包摩擦感,心界不大,心率80次/min,律齐,各瓣膜区未闻及病理性杂音。辅助检查:血常规、肝肾功能无明显异常,心肌损伤标志物未见异常;B型利钠肽升高(502.92 pg/ml);血沉升高(55 mm/第1小时),C反应蛋白升高(20.70 mg/L);IgG升高(21.40 g/L),IgA、IgM正常,IgE升高(181.00 IU/ml);补体C3正常,补体C4下降(0.11 g/L),类风湿因子升高(73.30 IU/ml),抗链球菌溶血素O(ASO)正常;抗核抗体谱、抗中性粒细胞胞浆抗体均阴性,抗心磷脂抗体(+),抗β2糖蛋白1抗体(+);CA125升高(140.60 U/ml);IgG4未查。腹部超声未见异常;心脏彩超示左房偏大,左室肌顺应性下降,左室收缩功能正常,少量心包积液,心包腔内透声欠佳,可见少许点状回声。初步诊断:心包积液、胸腔积液、慢性心力衰竭。给予胸腔置管引流,胸腔积液生化、常规检验未见异常;并予利尿等抗心衰治疗。治疗2周后患者胸闷无明显改善,仍有双下肢水肿,血压、心率较入院无明显变化。复查胸部增强CT提示心包增厚,心包积气、积液;双肺散在纤维灶,左肺上叶少许支气管扩张伴慢性炎症;双侧胸腔积液。考虑患者为缩窄性心包炎,转入心血管外科,行冠状动脉造影,提示冠状动脉单支病变,左回旋支远端狭窄50%,钝缘支开口狭窄70%;右冠优势。于2020年6月23日在全麻下行心包剥脱术,术中探查:壁层心包广泛明显增厚,心包膈面及左侧有少量钙化;心包腔广泛致密粘连,部分脏层心包也见轻度纤维化增厚,无钙化;房室大小基本正常;左侧胸腔内无粘连,胸膜外观正常,腔内有少量积液;右侧胸膜腔无积液或粘连,胸膜外观正常。纵隔胸膜、淋巴结及心包送检病理:镜下见心包壁明显增厚,间质大量纤维组织增生伴玻璃样变,并可见不等量的浆细胞及少量淋巴细胞浸润伴灶性出血,符合心包纤维硬化性炎性改变(图3)。心包组织免疫组化标记结果:CD38(浆细胞+),CD138(浆细胞少量+),IgG(浆细胞+)(图4A),IgG4+细胞>100/HPF,且IgG4/IgG>50%(图4B),考虑IgG4相关性疾病。患者最终诊断为IgG4相关性心包炎。术后予抗血小板、强心、利尿、胸腔引流等对症治疗,恢复良好出院。
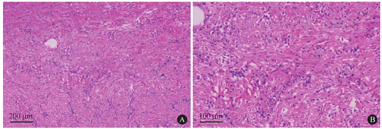

间质大量纤维组织增生,浆细胞及淋巴细胞浸润[HE染色,×100(A),×200(B)]
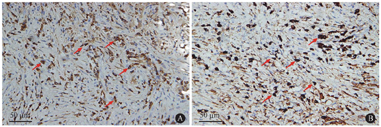

A:IgG+浆细胞(IHC,×400);B:IgG4+浆细胞(IHC,×400)
IgG4相关性疾病(IgG4-related disease,IgG4-RD)是一种系统性硬化性炎症性疾病[1],临床特点为受累组织的肿大、硬化,导致脏器功能受损,活动期常伴有血清IgG4水平的升高。IgG4-RD可累及胰腺、泪腺、唾液腺、肺、肾、肝、胆管、后腹膜、皮肤黏膜等几乎所有器官和组织[2,3]。IgG4-RD也可累及心血管系统,最常见于主动脉(约88%),特别是肾动脉以下的腹主动脉[4,5]。此外,中型血管如腹腔动脉、肠系膜动脉、髂动脉、冠状动脉、肺动脉和椎动脉也是IgG4相关性动脉周围炎的潜在靶器官[6]。该病仅累及心脏的情况较为少见,一般表现为缩窄性心包炎和冠状动脉病变,以心脏肿物为表现的病例则更为罕见,这类患者在初诊时常被怀疑为肿瘤性或血栓性病变[1,7]。IgG4-RD目前诊断依据主要是2011年日本的IgG4-RD诊断标准[8]和2019年美国风湿病学会/欧洲抗风湿病联盟(ACR/EULAR)制定的IgG4-RD分类标准[9]。无论哪一个诊断标准,病理学表现都是非常重要的诊断依据。IgG4-RD典型的病理表现为淋巴浆细胞浸润、闭塞性静脉炎和席纹状纤维化[10]。而心血管病理组织往往不易获得,给该病的诊断和治疗带来了一定困难。对于IgG4-RD累及心脏的患者,通常以胸闷、呼吸困难等心血管系统的症状为主要表现,首诊科室主要为心血管内科和外科,因此加强这些科室医生对其了解,对于诊断IgG4-RD有十分重要的意义。
我们报道的病例1就是以心脏肿物、肺动脉狭窄为主要临床表现,被误诊为心脏肿瘤和肺动脉栓塞。IgG4-RD的肺动脉受累比较罕见[4],Zhou等[11]总结了15例IgG4-RD累及肺血管的临床特点,其中有3例肺动脉炎、2例肺动脉瘤、3例肺动脉狭窄、1例闭塞性静脉炎、1例肺栓塞和抗磷脂抗体综合征,有8例患者合并肺动脉高压,其中5例最初被诊断为特发性或遗传性肺动脉高压。这些患者临床表现从无症状到呼吸困难或晕厥不等,除3例无血清IgG4数据外,平均血清IgG4水平为(15.25±17.72)g/L。对于IgG4-RD累及肺动脉的情况,PET/CT被认为是区分IgG4-RD与恶性肿瘤及肺血栓的有效方法。一些病例报告也显示,PET/CT可能是诊断某些IgG4-RD的有价值的方法[12,13]。在我们的病例1中,患者肺动脉狭窄的主要原因是增生组织压迫,这种情况多见于原发性或转移性纵隔肿瘤或纵隔淋巴结肿大,而患者PET-CT结果表明肿块呈侵袭性、高代谢状态,故术前被怀疑为肿瘤性疾病,直至术后病理才确诊IgG4-RD。因此,虽然影像学检查可以帮助排除血栓性疾病,但病理学检查仍然是这类患者确诊的主要方法。IgG4-RD心脏病变几乎可累及心脏所有部位,常见的受累部位为冠状动脉和心包,但累及心肌、瓣膜、心脏传导系统等的病例也有报道[14]。Matsumura等[15]总结了14例以心脏肿物为表现的IgG4-RD,其中冠状动脉、主动脉瓣和二尖瓣的病变最为常见。首发症状常无特异性,包括晕厥、呼吸困难和胸痛,部分冠状动脉病变患者易发生心原性猝死。这些患者中9例通过手术治疗,2例植入起搏器,1例接受了利妥昔单抗治疗,3例接受了糖皮质激素的一线标准治疗并获得了一定缓解。
病例2以缩窄性心包炎为主要表现,虽是IgG4-RD心脏受累的常见表现,但由于疾病本身罕见,发病率太低,常规血液检查未检测IgG4指标,未能考虑到IgG4-RD,最终也是通过术后病理确诊。缩窄性心包炎是由心包的炎症和纤维化引起的,最终通过影响舒张期心脏的充盈而导致心力衰竭。在发达国家,缩窄性心包炎最常见的病因是心脏手术和特发性心包炎,而在结核病高发的发展中国家,结核性心包炎最为常见[16]。目前,缩窄性心包炎的诊断主要依靠影像学检查,首选超声心动图,心脏磁共振成像和CT是替代或补充的成像方式。心包炎症的患者首先应接受抗炎治疗,同时针对病因治疗,而对于慢性缩窄性心包炎患者,心包切除术仍是唯一有效方法[17]。缩窄性心包炎是IgG4-RD累及心脏的常见表现,IgG4阳性的浆细胞渗入心包将导致心包纤维化,在晚期病例中可表现为右心衰竭。但鉴于人们对IgG4-RD的认识仍较少,且单独心脏受累的情况并不常见,关于IgG4相关性心包炎的报道仍然较少。Doumen等[18]统计了32例IgG4相关性心包炎患者,心包受累主要表现为心包增厚(66%)和(或)心包积液(69%),只有2例仅表现为心包炎而无其他脏器受累。IgG4相关性心包炎患者最常合并胸膜炎,其他受影响的器官包括肝胆系统、主动脉和腹膜后、淋巴结和唾液腺。大多数病例(59%)通过心包活检得到IgG4-RD的诊断,1例通过心包积液的细针穿刺细胞学检查获得诊断。其中29例患者的平均血清IgG4水平为6.76 mg/L,大部分(25/29)患者的血清IgG4水平>1.35 mg/L。大多数(17例)患者最初仅接受糖皮质激素治疗、5例仅接受了心包切除术,5例接受了手术与糖皮质激素的联合治疗,及时治疗的患者预后均良好。
对于IgG4-RD的患者,当病变累及心脏等重要脏器时需要积极治疗[19]。糖皮质激素作为IgG4-RD的一线治疗方案,对于大多数患者都有较好的效果[20]。当患者的复发风险较高,可在糖皮质激素的治疗方案上联合使用改善病情的抗风湿药(disease-modifying antirheumatic drugs,DMARDs)如环磷酰胺、硫唑嘌呤和吗替麦考酚酯等[21]。循证医学研究表明,糖皮质激素联合DMARDs治疗的患者可获得较单独糖皮质激素治疗更高的缓解率[22]。对于常规治疗方案无效或效果不佳的患者,也可尝试使用生物制剂如利妥昔单抗、度匹鲁单抗等治疗,但生物制剂的疗效及用法尚缺乏大规模的研究去证实。Matsumura等[15]和Doumen等[18]总结的病例中,使用以糖皮质激素为核心的药物治疗均能使患者获得一定的缓解甚至改善。但在我们的两个病例中,患者在术前均未获得IgG4-RD的诊断,且患者肺动脉狭窄、心肌受累和缩窄性心包炎的症状明显,需立即手术缓解症状,故先予手术治疗。
总之,对于IgG4-RD累及心脏的患者,如早期获得明确的诊断可仅用药物控制;但这类患者早期症状往往不典型且难以获得明确的诊断。若病变对患者心脏血流动力学影响明显,如心内肿物和缩窄性心包炎则需尽早手术干预,手术不但能迅速缓解症状,而且能获得病理诊断,术后再根据情况进行合适的药物治疗。
无


























