
淋巴管广泛分布于人体各部,其重要作用是维持组织液体平衡和参与免疫反应。心脏内同样存在丰富的淋巴管,它在心脏疾病中的角色正在不断被认知。本文从心脏淋巴管的结构、病理生理学、检测方法及在心脏疾病中的作用进行综述。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
淋巴管(lymphatic vessels)是循环系统的重要组成部分,其作用是将细胞外液和免疫细胞输送回血液循环、维持组织液体稳态和参加免疫反应[1]。心脏和人体许多其他器官表面都覆盖着丰富的淋巴管网络。最近研究显示心脏淋巴管具有显著可塑性,通过抗原表达和免疫调节促进其新生,能够在心脏疾病中发挥主动、积极的作用。为此,本文综述心脏淋巴管新生与心脏疾病间的关系。
早在17世纪研究者就发现了心脏淋巴管的存在,随着研究深入和检测技术提高,逐步对心脏淋巴管解剖结构有了更为清晰的认知。心脏淋巴管主要由毛细淋巴管即初始淋巴管和淋巴集合管组成。
毛细淋巴管是淋巴管道起始部分,以膨大盲端为起点,彼此吻合成网。管腔由单层内皮细胞构成,基底膜呈不连续"纽扣"状,渗透性大,有助于液体、蛋白和细胞流入。淋巴管内皮细胞之间似"瓦片"状覆盖连接,促使组织液向淋巴管的单向流动。毛细淋巴管分布广泛,心室、心房、心脏瓣膜[2]、冠状动脉壁[3]以及心脏传导系统[4]均可检测到淋巴管。以心室分布最多,通常从心室心尖部开始生长,逐层从心室心内膜下到心肌再到心外膜下,形成完整的、网状的毛细淋巴管。但毛细淋巴管分布存在差异化,人类心内膜下和心外膜下含量丰富,心肌内含量最少;兔和小鼠心内膜下无毛细淋巴管;斑马鱼[5]等脊椎动物,心房、心室的心内膜下无毛细淋巴管,心室仅在心外膜下有毛细淋巴管,心房的心外膜淋巴分布比心室少。
淋巴集合管在心外膜下由毛细淋巴管丛汇聚而成,管壁薄、管径粗,细胞间呈"拉链"状连接,不能渗透液体和细胞。心脏淋巴集合管内存在半月形瓣膜,既是毛细淋巴管过渡到淋巴集合管的主要标志,又能够起到防止淋巴逆流的作用。小鼠和人类心脏淋巴集合管相比其他部位淋巴管的独特之处在于其缺乏平滑肌细胞,因此淋巴液推进依赖心脏周期性收缩与舒张运动提供动力,如果心肌收缩功能降低,那么心脏淋巴管的功能也会受到影响。
心脏淋巴管起源有两种学说:一是静脉系统起源学说,1902年Sabin FR[6]提出淋巴管内皮细胞(lymphatic endothelial cells,LEC)起源于胚胎静脉;二是非静脉系统起源学说,LEC是通过不同的祖细胞在间充质中产生,而不是在静脉中,Klotz等[7]在2015年阐明胚胎小鼠心脏淋巴管起源于卵黄囊祖细胞。目前,尚不清楚LEC起源差异性与心脏疾病之间是否有关联,未来还需进一步研究。在本文中,我们主要分析静脉来源的淋巴管发育过程。
小鼠心脏淋巴管胚胎发育经历出芽、分离和迁移3个阶段,随后成熟分化形成完整心脏淋巴管系统。(1)出芽,心脏淋巴芽最早出现在胚胎第12.5天(E12.5),来自心外组织同源转录因子1(prospero homeobox protein 1,Prox-1)和血管内皮生长因子受体3(vascular endothelial growth factor receptor 3,VEGFR-3)阳性LEC从心脏背侧心外膜表面静脉窦发芽。Prox-1是LEC出芽过程中的关键转录因子,其表达受Sox18和COUP转录因子2(COUP transcription factor 2,COUP-TFⅡ)正向调控。在小鼠胚胎淋巴管发育开始时,选择性删除表达VEGFR-3的fms样酪氨酸激酶4(fms-like tyrosine kinase 4,Flt-4)基因的工作,证实了VEGFR-3参与出芽过程[8]。(2)分离,在E12.5~E14,心脏淋巴芽分化形成LEC,关键步骤是分离新形成的淋巴管内皮祖细胞和胚胎静脉。此时,可检测到淋巴管内皮细胞透明质酸受体1(lymphatic vessel endothelial hyaluronan receptor 1,LYVE-1)和平足蛋白(podoplanin,PDPN)的阳性表达。PDPN通过血小板表面C型凝集素样受体2与来自静脉的血小板相互作用,诱导淋巴细胞与血管分离。(3)迁移,E14之后,LEC完全从静脉分离,以离心方式在心脏两侧从底部向心尖扩张,并最终在E14.5构建一个网状结构覆盖心脏大部分表面。从出生(P0)开始,淋巴管进一步在心外膜表面延展,并在出生后第15天(P15)时从心外膜下向心肌扩张。VEGFR-3参与出芽和迁移两个过程,其作用方式主要依靠血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)和VEGF-D/VEGFR-3通路。此外,LYVE-1作为淋巴管内皮透明质酸的受体,参与淋巴管迁移和管状结构形成过程。
正常心脏很少检测到表浅淋巴管,当心脏受损后,淋巴管生成的生物标记物蛋白检出率增加,表明淋巴管生成基因程序被激活,其数量显著增加。心脏淋巴管新生和功能改变,参与心脏水肿与炎症、心肌纤维化和动脉粥样硬化等病理生理过程。
(1)心脏水肿与炎症:LEC与细胞外基质(extracellular matrix,ECM)通过锚定蛋白连接,水肿时ECM成分发生扭曲,增加对锚定蛋白的拉力,使毛细淋巴管呈持续开放状态,增加淋巴管渗透效率。心肌梗死后继发的急性炎症期,主要在梗死区和毗邻非梗死区心肌中,检出心脏淋巴管新生、淋巴管生成生物标记物VEGFR-3、LYVE-1、PDPN和Prox-1显著增加[7],但新生淋巴管运输能力弱于健康心脏淋巴管[9]。另有研究显示,心内膜炎时心脏瓣膜PDPN表达增多[10]。
(2)心肌纤维化:心脏淋巴管病变通过多种方式引起心肌纤维化。单纯结扎实验动物心脏淋巴管引起心肌水肿,水肿可激活成纤维细胞的促纤维化机制,导致Ⅰ型和Ⅲ型胶原显著增加,发生心肌纤维化。心肌水肿也会导致ECM内压力变化,Tomasek等[11]发现,这种压力变化可被牢固附着在ECM的细胞包括LEC和成纤维细胞感知到,通过机械调节激活成纤维细胞向肌成纤维细胞转变,进而产生更多的胶原蛋白。也有研究显示,心脏淋巴管缺乏时淋巴液在组织间隙滞留引起心肌水肿,成纤维细胞可能会对间质流动的变化做出反应,与水肿相关的间质流速和静水压力的变化影响成纤维细胞的活性,然后通过炎症因子促进心脏纤维化[12]。一旦心肌纤维化病理过程启动,也会影响淋巴管功能,慢性水肿和炎症引发的纤维化可能会直接阻塞毛细淋巴管[13](在毛细淋巴管上检测到Ⅰ型胶原蛋白沉积),从而进一步加重淋巴管功能障碍形成恶性难以逆转的心肌纤维化。
(3)动脉粥样硬化:Kholová等[14]的实验结果证实,在进展性动脉粥样硬化的冠状动脉中,钙沉积物和胆固醇晶体附近的内膜,有三分之一的钙化和纤维斑块中PDPN表达阳性。而Nakano等[15]发现,在动脉粥样硬化的人类冠状动脉外膜和内膜中未检测到或只检测到极少量淋巴管生成,表达淋巴管生成的LYVE-1、PDPN阳性率很低。显然,淋巴管新生是否参与动脉粥样硬化值得进一步研究。
淋巴管检测方法的进步,推动了对淋巴管在疾病发生发展中重要角色的认知。相较于血管,淋巴管不容易被检测到,因此很难分析其微观解剖结构和分布,乃至病理生理状态下的动态功能变化,现主要方法有活体检测、组织染料染色、电镜检测和分子检测。
心脏磁共振检查(CMR)能无创评估心肌水肿,但不能够直接观察到淋巴管功能或渗透性的改变。单光子发射计算机断层成像(SPECT)/淋巴闪烁显像是心脏淋巴管可视化的新兴技术,利用示踪剂能够获得淋巴系统的精细图像,分辨率和灵敏度相比前者显著改善,但由于其具有侵入性且示踪剂的安全性存疑,尚未在心血管疾病患者中开展实施,仍需改进。
基于染料染色显像如胭脂红、普鲁士蓝、印度墨汁和伊文思蓝等,在皮下注射这些染料之后,由于淋巴管通透性大,染料会在组织间隙顺着淋巴回流,再由淋巴管中的抗原递呈细胞吞噬而使其着色。染料染色能够直观展现淋巴管在心脏中的位置,推测淋巴行进路径。但是染料法存在一定缺陷,其缺乏注射量的标准,当过多注射染料时,可能会造成假阳性,量少则影响检出率。
是一种侵入性心脏淋巴管显像技术,需要直接靶向注射造影剂。心肌梗死后进行淋巴造影[9],将荧光量子点(分子探针)注射到心肌内,静脉注射FITC-葡聚糖,然后对心外膜前外侧用共聚焦显微镜分析其宏观和微观结构。最近研究发现,可以直接将印度墨汁染料注射进心脏淋巴管[16],相比染料皮下注射,淋巴结构显示更为清晰,这种方法适用于人类尸检和大型实验动物。
(1)光片显微镜:光片3D成像可更好地评估淋巴管重构水平,观察毛细淋巴管扩张和淋巴管引流功能。(2)荧光(NIR)显微镜:荧光显微镜是以紫外线为光源,而红外光显微镜是利用红外光。近红外NIR显微镜/吲哚菁绿(ICG)成像技术是近年来开展的前哨淋巴结显像的新方法,可对淋巴管引流进行示踪,检出率较高。(3)电子显微镜:免疫电镜技术是免疫组织化学方法与电子显微镜结合的产物,是利用抗原与抗体特异性结合的原理,在超微结构水平上定位、定性及定量抗原的技术方法。由于电子显微镜的分辨力很高,故可准确地显示抗原所在部位。
生物标记物是随着免疫学和分子生物学技术的发展而提出的一类与细胞生长增殖有关的标记物。既往由于淋巴管缺乏特定标记导致研究淋巴系统长期受阻,直到20世纪末才发现基于LEC特异性表达的生物标记物,主要包括Prox-1、LYVE-1、VEGFR-3和PDPN等,参与调控淋巴管新生。
Prox-1:局限于LEC。Wigle等[17]在小鼠E11.5和E12.5分别用抗血小板内皮细胞粘附分子(platelet-endothelial cell adhesion molecule,PECAM)和抗血管内皮细胞钙粘连蛋白(vascular endothelial cadherin,VE-cadherin)抗体双标记Prox-1,发现在静脉壁即发育过程淋巴管内可见双标记细胞,而在其余的血管内皮不可见。Prox-1是LEC出芽过程中的关键转录因子,敲除小鼠Prox-1基因,其淋巴系统发育存在缺陷,但血液循环系统未受影响。
LYVE-1:具有标记LEC较强特异性。它虽是CD44同源物,与CD44氨基酸序列相似性达41%,但与CD44表达情况有明显区别,CD44可在除LEC之外的大部分细胞中表达,而LYVE-1仅存在于LEC,在血管内皮细胞中完全没有。但LYVE-1在巨噬细胞表面也有表达,最近Lim等[18]发现LYVE-1表达的巨噬细胞与血管平滑肌细胞有关,其缺失会导致动脉硬化。
VEGFR-3:具有标记LEC相对特异性。在胚胎发育过程中存在于所有内皮中,血管内皮细胞和LEC上均有VEGFR-3的阳性表达,因此它不仅参与LEC出芽和迁移,还能够干预血管生成过程。而在成熟个体中,VEGFR-3仅在LEC和高内皮细胞微静脉中特异性表达。但随着研究逐渐深入,研究者发现VEGFR-3还能在肿瘤和受损的血管内皮上高表达[19]。
PDPN:Breiteneder-Geleff等[20]通过免疫电镜技术,根据内皮细胞形态学差异,来识别出没有连续的基底层和管腔中没有红细胞的真皮毛细淋巴管。结果发现,在淋巴管内皮内能够看到免疫特异性标记PDPN,而血管内皮内则不能观察到。PDPN参与胚胎时期LEC分离,敲除PDPN表达基因的小鼠会出现淋巴功能障碍导致的先天性淋巴水肿。
基于上述抗原在淋巴管内的时间和空间表达差异性,如在小鼠中,PDPN仅在心外膜下淋巴集合管表达,而在心肌及心内膜下阳性检出率极低[7];相反地,LYVE-1在心肌中表达较高。因此,实验时通常需要选择两种及以上生物标记物联合观察。
心脏病理状态下心脏淋巴管发生反应性增多,然而内源性淋巴形成不足以逆转病情,因此研究者试图通过干预心脏淋巴管新生来改善心脏疾病预后。近年来不断增加的证据表明,心脏淋巴管是治疗心脏疾病的潜在靶点。
胆固醇在动脉血管壁上过量沉积,引起炎症反应启动动脉粥样硬化过程。胆固醇逆向转运指位于外周组织(包括动脉粥样硬化的血管)中的巨噬细胞的胆固醇流出,并通过肝脏排泄到胆汁,最终排泄到粪便。Martel等[21]对胆固醇逆向转运进行定量跟踪,实验表明,被标记的胆固醇保留在抗VEGFR-3治疗小鼠的主动脉中,由此证实,冠状动脉周围淋巴管参与冠状动脉粥样硬化性心脏病的胆固醇逆转运过程。Milasan等[22]发现,通过在小鼠体内注射VEGF-C(VEGF-C 152S)的突变体促进淋巴新生,能限制斑块形成和巨噬细胞积累,同时阻碍了炎症细胞通过淋巴管的迁移。
心外膜脂肪组织形成、堆积与心房颤动的发生有关,其中左心房外脂肪厚度增加是心房颤动发生的独立危险因素,但目前心外膜脂肪组织导致心房颤动发生的机制仍未可知。心外膜脂肪组织内分布有淋巴管[23]。在心脏手术中,如果保留主动脉脂肪垫,避免淋巴引流受损,能减少术后心房颤动的发生[24]。此外,心脏传导系统中也存在淋巴管[5],Fontan手术中保留两条主要淋巴支可减少室上性和室性心动过缓、快速性心律失常以及传导阻滞等术后心律失常并发症的可能[24]。
淋巴管已被证实存在于人类心脏瓣膜中[3],当心脏瓣膜受累时心脏淋巴管会反应性新生[10]。Syväranta等[25]发现,人类心脏狭窄的主动脉瓣中VEGF-D和VEGFR-3 mRNA水平上调,表明此处有淋巴管新生。因此,可以推测淋巴管生成可能为脂蛋白和炎症细胞清除提供途径,延缓心脏瓣膜的病理性重构。然而,尚不清楚瓣膜内的淋巴管新生能否作为治疗靶点。
高血压性心脏病的特征性表现包括左心室肥厚、心脏舒张功能障碍及心肌纤维化。淋巴管生成可能能够减轻高血压引起的心脏损伤。Song等[26]在血管紧张素Ⅱ引起的高血压性心脏病的动物模型中注射VEGF-C 152S,发现通过改善心脏淋巴功能,能够显著降低血压,减轻纤维化和炎症。Zhang等[27]发现了一种新物质——去乙酰化酶3(Sirtuin-3,SIRT3),能够促进淋巴管生成,上调VEGF-C/VEGFR-3轴和增加LEC的迁移和增殖来保护心脏免受血管紧张素Ⅱ诱导的高血压性心脏病造成的心脏损伤。
目前研究证实,广泛存在于心脏中的淋巴网络有助于维持组织液平衡和参与免疫炎症反应,通过促进淋巴新生,具有治疗心脏疾病的可行性和潜力(图1),但淋巴管如何新生、新生淋巴管如何参与心脏疾病病理生理过程,值得深入探究。
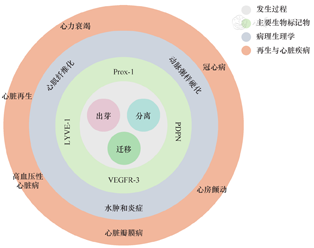

Prox-1:同源转录因子1;LYVE-1:淋巴管内皮细胞透明质酸受体1;VEGFR-3:血管内皮生长因子受体3;PDPN:平足蛋白
无



























