
除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)为主的心血管疾病[如缺血性心脏病(ischemic heart disease,IHD)和缺血性脑卒中等]是全球死亡的首位原因。循环中的低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)升高和富含三酰甘油脂蛋白携带的残余胆固醇升高,是世界范围内血脂异常的主要类型,同时也是ASCVD最重要的危险因素之一[1]。现有流行病学、遗传学和临床试验研究证据充分证实,LDL-C是ASCVD的致病性危险因素[2]。新近研究还显示,富含三酰甘油脂蛋白携带的残余胆固醇也被认为参与动脉粥样硬化的病理生理过程,是ASCVD的危险因素[3]。非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C),包括LDL-C和残余胆固醇,被认为包括了所有致动脉粥样硬化脂蛋白携带的胆固醇。过去40年来,世界范围内血脂领域研究取得了突破性进展,明确了他汀类药物降脂治疗的基石作用,以及降脂药物的联合应用和降脂新药如前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂联合应用,可在他汀类药物治疗基础上进一步减少ASCVD事件,且与LDL-C的绝对减少成正比。尽管许多国家在控制血脂异常方面取得了进展,但ASCVD仍然是全球的首要死因。为了采取更有效的策略和行动来应对血脂异常对全球公众健康的有害影响,了解全球血脂异常当前的流行病学特征至关重要。
最近有3篇关于全球血脂异常流行情况的综述发表[4,5,6]。全球覆盖范围最广的有关循环中胆固醇分布和变化趋势的非传染性疾病风险因素协作组(Non-communicable diseases-Risk Factor Collaboration,NCD-RisC)研究数据[7],报告了1980—2018年不同国家和地区的年龄标化平均总胆固醇(total cholesterol,TC)和non-HDL-C水平。研究显示,在此期间TC和non-HDL-C的全球年龄标化平均值几乎没有变化。在NCD-RisC研究纳入的200个国家和地区中,男性年龄标化平均non-HDL-C的中位数从1980年的3.36 mmol/L到2018年的3.37 mmol/L,女性从1980年的3.44 mmol/L略微下降到2018年的3.34 mmol/L。
但在不同国家和地区之间TC和non-HDL-C水平存在显著差异(表1)。以non-HDL-C为例,在1980年年龄标化平均non-HDL-C水平位居全球前列的大部分国家,到2018年non-HDL-C水平显著下降。其中,1980年全球年龄标化平均non-HDL-C水平最高的前10个国家主要分布在西欧的发达国家和新加坡,这些国家的男性年龄标化平均non-HDL-C水平均>4.7 mmol/L,女性则>4.5 mmol/L。而到2018年这些欧洲国家的年龄标化平均non-HDL-C水平降至全球平均水平,最高降幅达1.73 mmol/L。另一方面,地处东亚、东南亚和大洋洲的发展中国家,在过去40年间non-HDL-C大幅增长。这些国家1980年的年龄标化平均non-HDL-C水平处于较低水平(均<3.8 mmol/L),40年间增幅超过0.5 mmol/L,增幅最高达0.88 mmol/L。除这些国家外,部分其他区域的国家也经历了non-HDL-C大幅增长。特别是中国,近40年间non-HDL-C水平增长速度是全球最快的国家之一,中国男性的年龄标化平均non-HDL-C水平从1980年的2.77 mmol/L增加到2018年的3.38 mmol/L,在40年内增加了0.61 mmol/L,全球排名由第153位上升到第99位,接近甚至超过了大多数欧洲国家的non-HDL-C水平。此外,1980年全球年龄标化平均non-HDL-C水平最低的前10个国家,以非洲国家为主。这些国家的non-HDL-C水平在过去40年中没有明显变化,仍低于全球平均水平。2018年全球标化平均non-HDL-C水平最低的国家是莱索托,男性non-HDL-C为2.35 mmol/L,女性为2.58 mmol/L。
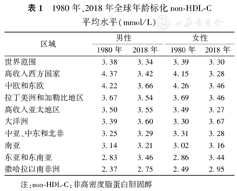
1980年、2018年全球年龄标化non-HDL-C平均水平(mmol/L)
1980年、2018年全球年龄标化non-HDL-C平均水平(mmol/L)
| 区域 | 男性 | 女性 | ||
|---|---|---|---|---|
| 1980年 | 2018年 | 1980年 | 2018年 | |
| 世界范围 | 3.38 | 3.34 | 3.39 | 3.30 |
| 高收入西方国家 | 4.37 | 3.42 | 4.15 | 3.28 |
| 中欧和东欧 | 4.22 | 3.66 | 4.26 | 3.46 |
| 拉丁美洲和加勒比地区 | 3.67 | 3.54 | 3.69 | 3.46 |
| 高收入亚太地区 | 3.50 | 3.55 | 3.49 | 3.27 |
| 大洋洲 | 3.39 | 3.60 | 3.30 | 3.67 |
| 中亚、中东和北非 | 3.25 | 3.29 | 3.31 | 3.28 |
| 南亚 | 3.14 | 3.21 | 3.02 | 3.16 |
| 东亚和东南亚 | 2.83 | 3.46 | 2.86 | 3.44 |
| 撒哈拉以南非洲 | 2.37 | 2.75 | 2.49 | 2.95 |
注:non-HDL-C:非高密度脂蛋白胆固醇
尽管TC和non-HDL-C的全球年龄标化平均水平几乎没有变化,但由于不同国家和地区间的上述差异,过去40年来TC和non-HDL-C水平在各国间的变异程度逐渐减小。从1980年至2018年全球年龄标化平均non-HDL-C的上四分位数下降,男性从3.90 mmol/L下降到3.59 mmol/L,女性从3.91 mmol/L下降到3.54 mmol/L;而下四分位数增加,男性从2.82 mmol/L增加到3.04 mmol/L,女性从2.83 mmol/L增加到3.08 mmol/L。此外,从1980年至2018年,200个国家的男性年龄标化平均non-HDL-C的标准差从0.76 mmol/L降至0.38 mmol/L,女性从0.69 mmol/L降至0.31 mmol/L。
根据2019年全球疾病负担(Global Burden of Disease,GBD)研究[8]估计,全球共有378万人的IHD死亡归因于高LDL-C,占全部IHD死亡的44.3%;有61万人的缺血性脑卒中死亡归因于高LDL-C,占全部缺血性脑卒中死亡的22.4%。自1990年以来归因于高LDL-C的疾病负担增加迅速,归因于高LDL-C的IHD死亡人数增加46.2%,缺血性脑卒中死亡人数增加47.8%。同时,这一变化趋势也存在明显的国家和地区差异(图1)。NCD-RisC研究报告[4]显示,从1990年到2017年,归因于高non-HDL-C的死亡人数在亚洲地区显著增加。特别是东亚归因于高non-HDL-C的死亡人数增加了2倍以上,从25万增长到86万;在东南亚增加了近2倍,从11万增加到31万。东亚、东南亚和南亚归因于高non-HDL-C的死亡占1990年全球归因于高non-HDL-C死亡人数的25%,而到2017年则上升至近50%。欧洲和北美洲的发达国家归因于高non-HDL-C的死亡则下降了近50%,从95万下降到48万。拉丁美洲、中亚、非洲国家归因于高non-HDL-C的死亡有小幅上升。
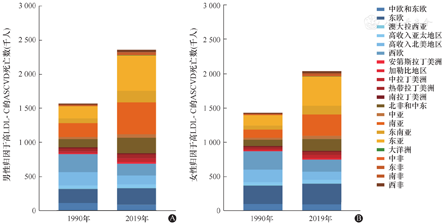

LDL-C:低密度脂蛋白胆固醇;ASCVD:动脉粥样硬化性心血管疾病(包括缺血性心脏病和缺血性脑卒中)
2019年全球归因于高LDL-C的IHD和缺血性脑卒中的全球年龄标化死亡率(age-standardized death rate,ASDR)分别为48.44/10万人和8.08/10万人。在过去30年中,归因于高LDL-C的IHD和缺血性脑卒中的ASDR在男性中分别减少了35.1%和34.2%,在女性中分别减少了38.1%和42.8%。过去30年,大部分西方国家的变化与全球趋势一致,即归因于高LDL-C的ASDR下降。然而,亚洲国家归因于高LDL-C的IHD的ASDR在30年间没有下降,甚至在东亚、中亚显著增加,归因于高LDL-C的IHD的ASDR分别增加了16.4%和10.9%,归因于高LDL-C的缺血性脑卒中ASDR则变化较小。而对于血脂水平处于全球最低的非洲国家,自1990年以来,归因于高LDL-C的ASDR没有明显变化,在2019年仍保持较低水平。尽管全球心血管疾病负担巨大且日益增加,但由于世界范围内人群内部和人群间存在显著异质性,我们有必要重新审视并高度关注血脂异常管理和控制的特定人群。
从全球角度来看,不同国家或地区的专业协会发布的所有心血管疾病相关预防指南均建议高危人群服用降脂药物。随着社会经济发展,他汀类药物可及性的提高为降低LDL-C相关ASCVD负担做出了巨大贡献。提高公众对血脂异常相关心血管疾病风险的认识,增加血脂检测和ASCVD风险评估的机会,制定和更新血脂异常相关临床指南也是改善血脂异常管理的关键。在过去的20年中,这些因素的改善带来了许多国家血脂水平的巨大变化。然而,目前各国家和地区的血脂异常防控现状差异很大。
过去30年,高收入西方国家non-HDL-C水平大幅下降,伴随ASCVD负担减轻。一项研究基于2011—2012年国家健康和营养检查调查(NHANES)数据发现,美国血脂异常的治疗和控制率分别达到54.1%和66.0%[9],其中降脂药物,特别是他汀类药物使用率增加。2002—2013年在美国157 000名≥40岁成人中进行的一项回顾性队列研究表明,他汀类药物在普通人群中的使用率上升了79.8%,从2002—2003年的8.4%上升至2012—2013年的81.8%;然而,ASCVD患者他汀治疗率并不理想,2002—2003年为49.8%,而2012—2013年仅上升至58.1%[10]。除了他汀类药物在降低ASCVD风险中的基石作用外,非他汀类药物的降脂作用也不容忽视。大量研究支持应用胆固醇吸收抑制剂或PCSK9抑制剂联合他汀类药物进行降脂治疗[11]。美国成人非他汀类药物的使用率也增加了1.24倍,从2002—2003年的2.5%增加到2012—2013年的5.6%。2012—2013年,高强度他汀类药物使用者中15.9%也使用了非他汀类药物[12]。
相比之下,东亚和东南亚国家(例如中国和马来西亚)的血脂异常相关ASCVD负担大幅增加。中国慢性病和危险因素监测研究在2013—2014年对163 641名>18岁中国成人的调查显示,11.2%属于ASCVD高危或极高危人群。但74.5%的高危人群和93.2%的极高危人群LDL-C未达标。在ASCVD高危或极高危且LDL-C未达标的患者中,分别只有5.5%和14.5%的人接受了降脂药物治疗[13]。中国心血管疾病医疗质量改善项目研究发现,在2014—2018年6 523例急性冠状动脉综合征且有心肌梗死病史或血运重建术史的患者中,50.8%在院前接受了降脂治疗(98.4%为他汀类单药治疗,1.2%为联合药物治疗),入院时只有30.1%的患者LDL-C<1.8 mmol/L[14]。这些研究表明,他汀类药物在这些地区的使用不足。这可能与许多因素有关,主要包括不同级别医疗卫生机构救治能力及医疗资源可及性,医疗服务提供者的护理质量以及患者对治疗的依从性。其中,药物可及性至关重要。一项评估了2016—2017年中国31个省农村地区的3 041家基层医疗机构中降脂药物配备情况的全国性研究发现,基层医疗机构中不到一半(49.7%)备有他汀类药物,其中乡村诊所的配备率最低(43.7%)[15]。基层医疗卫生机构中他汀类药物的供应不足与人群健康需求不匹配,这可能大幅限制了降脂药物对降低ASCVD负担的基石作用。此外,从公共卫生角度,降脂药物治疗将增加患者、家庭和社会的经济负担。研究显示,在西方国家采用他汀类药物治疗具有合理的成本效益,特别是在心血管疾病高危人群中[16]。近年来,我国由于药品价格大幅度下降和医疗保障制度的高覆盖率,采用降脂药物治疗的成本效益也显著提高[17]。
综上所述,过去40年间全球TC和non-HDL-C水平的年龄标化平均值几乎没有变化,但各地区或国家间的差异逐渐缩小,地理差异显著。全球高non-HDL-C分布呈现从西欧的发达国家转移到东亚和东南亚的发展中国家的变化趋势。尽管全球ASCVD负担巨大,但西欧的发达国家归因于高LDL-C水平的心血管疾病死亡减少,而亚洲国家的心血管疾病死亡负担却大幅增加。同时,血脂异常的治疗率和控制率也存在显著地理差异,成功的医疗保健政策以及有针对性的靶向LDL-C药物可以有效减轻归因于高LDL-C的ASCVD负担。当前全球血脂异常的重要流行病学特征和管理进展,为我们明确降低血脂异常相关疾病负担提出了新问题和新挑战。对于西欧的发达国家,亟需研发降低LDL-C水平的新方法。随着生物技术发展,出现小干扰RNA、反义寡核苷酸、疫苗和基因编辑等新型降脂形式,并表现出良好的应用前景。此外,开发用药周期更方便以及新靶点的药物,为提高患者治疗依从性和进一步降低患者血脂异常相关ASCVD负担带来更多希望。而对于non-HDL-C水平仍大幅增长的中国及其他东亚和东南亚国家,除上述策略外,亟需进一步加强公众教育提高血脂检测率,积极倡导健康生活方式,重视早发现早治疗的人为干预,提升医疗资源可及性和患者依从性,从而有效降低归因于血脂异常的心血管疾病负担。
无


























