
特发性室性期前收缩(IPVC)是临床上常见的心律失常,对于它的发病机制、诊断、治疗和管理仍存在诸多未知。本文全面回顾IPVC的基础研究、临床特征及治疗方式,尤其对近年来IPVC的电生理标测和导管消融技术的最新进展进行总结,分析每种IPVC消融技术的潜在优缺点,以期为临床工作提供帮助。

除非特别声明,本刊刊出的所有文章不代表本刊编辑委员会的观点。
无结构性心脏病或遗传性离子通道病的室性期前收缩被称为特发性室性期前收缩(idiopathic premature ventricular contractions,IPVC),是日常临床工作中最常见且最复杂的心律失常之一[1]。IPVC通常起源于特定的心内膜或心外膜部位,最常见的起源部位为流出道(outflow tract,OT),包括右室流出道(right ventricular outflow tract,RVOT)、左室流出道(left ventricular outflow tract,LVOT)、主动脉窦-二尖瓣连接部(aortomitral continuity,AMC)、主动脉瓣和左室穹顶部(summit区)[2]。IPVC通常预后良好,且可通过药物及导管射频消融术等得到有效治疗。本文从基础理论到临床治疗对IPVC的发病机制、起源部位解剖学分析、流行病学特点、临床表现和治疗方法等进行总结,并着重介绍IPVC的电生理标测和导管消融(catheter ablation,CA)技术进展。
IPVC是与延迟后除极(delayed afterdepolarizations,DAD)相关的局灶性心律失常,在动作电位第4相触发[3]。此类心律失常通常由肾上腺素介导,可由压力或劳累诱发或加重,肾上腺素能受体在儿茶酚胺的刺激下,腺苷酸环化酶(adenylyl cyclase,AC)活性增加,细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平升高,激活蛋白激酶A(protein kinase A,PKA),磷酸化L型钙通道、兰尼碱受体2(ryanodine receptor 2,RyR2)和受磷蛋白,导致肌浆网钙超载产生钙火花[3],增加DAD发生率。此机制解释了特发性室性心律失常的一些特殊特征,如腺苷可通过激活腺苷A1受体抑制G蛋白级联反应降低心室肌中的cAMP来终止IPVC。因此,降低cAMP水平的药物可用来治疗IPVC,包括钙通道阻滞剂、β受体阻滞剂和腺苷。此外,通过刺激迷走神经激活M2型胆碱能受体也可用于终止IPVC[4]。
70%的IPVC起源于心室OT,其中60%为RVOT,10%为LVOT及其临近结构[5],全面了解其解剖关系有助于临床医生通过心电图准确定位IPVC的起源部位。RVOT位于LVOT右前方;相反,LVOT位于RVOT左后方。在RVOT中,其间隔部或后部是IPVC最常见的起源部位,约占3/4,其余起源于RVOT的游离壁、前部和肺动脉根部。RVOT和肺动脉之间有心肌相连,可延伸至肺动脉瓣以上最多至数厘米。肺动脉瓣及以上部分是相当一部分RVOT室性心律失常的起源部位,其中70%起源于肺动脉瓣附着点10 mm以内,而真正起源于肺动脉窦上方的仅占40%左右[6]。在LVOT中,IPVC最常见的起源部位是主动脉瓣[7]。主动脉瓣位于肺动脉瓣的左后方,由三个冠状瓣组成:左冠瓣(left coronary cusp,LCC)、右冠瓣(right coronary cusp,RCC)和无冠瓣(non-coronary cusp,NCC)。RCC位于前方,NCC位于后方,LCC位于左后方。其中RCC位于RVOT后间隔部分的正后方,而NCC是最低的冠状瓣,靠近房间隔。LVOT-IPVC还可能起源于其邻近结构,如AMC、LVOT的心内膜和左室summit区。AMC是在二尖瓣前叶与LCC和NCC之间延伸的纤维组织带。左室summit区是左室最高处的心外膜部,由冠状动脉的左前降支(left anterior descending,LAD)、左回旋支(left circumflex artery,LCX)和第一间隔支穿支构成的三角形区域。心大静脉(great cardiac vein,GCV)及前室间静脉(anterior interventricular vein,AIV)将summit区横向分为上下两部分:下部被认为是"可消融区",适合CA;上部也称为"不可消融区",因为存在心外膜动脉和心外膜脂肪且临近冠状动脉故不适合CA[8](图1)。侵入性CA研究数据表明,起源于主动脉瓣的IPVC消融成功率为46.7%,是IPVC消融成功率最高的部位,起源于RVOT的成功率为36.2%,而起源于AMC的成功率仅为4.9%[9]。剩余30%的IPVC起源于非OT结构,包括乳头肌(5%~15%)、二尖瓣环(5%)、三尖瓣环(8%~10%)、左束支(10%)、房室交点和节制索[7,10,11]。
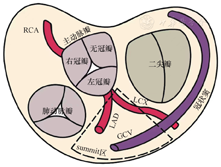

GCV:心大静脉;LAD:左前降支;RCA:右冠状动脉;LCX:左回旋支
Sirichand等[12]的研究指出,特发性室性心律失常的总体发病率为51.9/10万,其发病率随着年龄的增长而增加。此外,尽管男女间IPVC的总体发病率相似,但女性症状性PVC的年龄校正发病率(age-adjusted rate)高于男性(46.2/10万比20.5/10万,P<0.001)。在对接受CA的IPVC患者的性别和年龄差异分析中,女性RVOT起源的IPVC的发生率是男性的1.5倍,而LVOT起源的IPVC在男性中更常见[13]。IPVC患者间的临床表现差异较大,部分患者可没有任何临床表现,也可出现危及生命的症状。IPVC患者常见症状为心悸、呼吸困难和胸痛,偶有晕厥前兆和恶心。频繁的IPVC可能会诱发心肌病(cardiomyopathy,CMP),其特点是出现无法解释的进行性左室功能不全和心力衰竭[7,12]。此外,当患者出现非持续性室性心动过速时也可引起晕厥或心力衰竭,极少数的PVC可诱发心室颤动[14]。
对于无症状或症状轻微的IPVC患者,通常无须进行治疗[15]。对于有症状的IPVC患者,β受体阻滞剂或非二氢吡啶类钙通道阻滞剂是一线治疗药物,这些药物在无结构性心脏病的患者中具有良好的安全性。β受体阻滞剂可用于患有冠心病或左室功能降低的患者,可减少心律失常发生的次数并改善症状,对交感神经介导的IPVC尤其有效。在随机对照试验中,β受体阻滞剂通过减缓PVC后窦性心搏,使OT-PVC发生次数显著减少、症状改善;非二氢吡啶类钙通道阻滞剂也被证实可有效治疗OT-PVC[16]。对于心脏结构正常的患者,如果β受体阻滞剂无效,可以尝试使用钙通道阻滞剂,反之亦可。β受体阻滞剂和钙通道阻滞剂应以最低有效剂量使用,以缓解症状并尽可能减少不良反应。使用任何一种药物,患者都可能出现疲劳、低血压、心动过缓或晕厥前兆。β受体阻滞剂可引起抑郁和勃起功能障碍,非二氢吡啶类钙通道阻滞剂可引起胃肠道不良反应,如胃食管反流和便秘,以及腿部肿胀。
对于有症状的IPVC患者,如果β受体阻滞剂或钙通道阻滞剂无效,对这些药物耐受性差,或为多源性PVC而不适合CA时,可使用其他抗心律失常药物(anti-arrhythmic drugs,AAD),如氟卡尼、普罗帕酮、索他洛尔或胺碘酮。美西律有效性不如其他AAD或CA[17]。ⅠC类AAD(氟卡尼和普罗帕酮)通常具有良好的耐受性和有效性。但这些药物在合并冠心病、严重左室肥厚或心力衰竭时禁用,因为使用氟卡尼来抑制心肌梗死后的PVC会增高死亡率。ⅠC类AAD因能促进折返性室性心律失常而成为结构性心脏病的禁忌证。但ⅠC类AAD也被证实对PVC诱导的CMP患者左室功能的改善有效[18]。许多研究评估了索他洛尔抑制PVC的效果,特别是存在冠状动脉疾病的情况下。索他洛尔可有效降低PVC的发生次数,然而索他洛尔与QT延长和尖端扭转型室性心动过速相关,在使用时必须考虑存在的风险[4]。胺碘酮是少数可以安全地用于收缩功能严重降低的患者的AAD之一,但长期服用胺碘酮的不良反应较大。对于PVC诱发的CMP患者,胺碘酮可有效减轻心脏负担,改善左室功能和症状。对于消融较为复杂且手术并发症风险较高的患者,药物治疗仍是一线治疗方案。
在过去的二十年里,随着电生理标测技术和CA技术的逐步改进,CA已成为一线治疗选择,尤其适用于不耐受或拒绝长期AAD治疗的症状性IPVC患者[15,19]。
CA术前要通过仔细评估12导联心电图来识别IPVC可能的起源部位,根据该部位附近容易受伤的解剖结构来定制特定的方法。激动标测和起搏标测是用于检测心律失常起源部位的标准方法。IPVC数量较少时可通过输注异丙肾上腺素或在心室、心房起搏来诱导室性心律失常。CA应在最早激动(≥20 ms)部位进行,理论上该部位的起搏图也最佳[15]。对于OT-IPVC,在出现左束支传导阻滞(left bundle branch block,LBBB)且过渡≥V3导联时应首先标测RVOT,而在出现早期过渡(≤V2)的LBBB或右束支传导阻滞(right bundle branch block,RBBB)的情况下,应首先标测主动脉瓣和LVOT[15]。当多个相邻部位的局部激动时间(即OT-IPVC的GCV/AIC、LCC、左室心内膜和RVOT)具有相似值时,尤其是存在次优起搏图的情况下,应考虑起源部位位于壁内。对于壁内IPVC,标准的单极射频消融可能无法成功消除心律失常。随着消融技术的进步,双极射频消融、同步单极射频消融或使用半量生理盐水/非离子灌注剂已被证实可提高成功率。此外,在GCV消融前应进行冠状动脉造影[15]。
对于RVOT-IPVC,CA的成功率较高且并发症发生率低[7]。一项随机对照试验表明,与美托洛尔或普罗帕酮等药物治疗相比,在频繁发作且有症状的RVOT-PVC患者中,CA显示出更高的有效性和更低的复发率。由此专家共识倾向于将CA作为这类PVC的一线方案。然而,部分症状轻微的患者可能更倾向于无创的药物治疗或不治疗[19]。在由IPVC引发的复发性心室颤动患者中,起源部位通常位于浦肯野纤维。对于这种情况,CA是避免进一步恶性心律失常事件的标准疗法[20]。CA对右室起源的非OT-IPVC(右室乳头肌、三尖瓣环和隔缘肉柱)的急性抑制率超过90%,但复发率较高,通常需要再次手术[21]。与RVOT起源的IPVC相比,LVOT起源的IPVC的消融更为复杂,并且由于附近存在一些重要的解剖结构(如冠状动脉或主动脉瓣尖),手术风险更大。左室非OT-IPVC有几个常见的起源部位,包括乳头肌、二尖瓣环,在源自乳头肌和隔缘肉柱等腔内结构的IPVC中,复杂的解剖结构、其可变性和心脏的搏动使手术难度更大。在这些情况下,使用心腔内超声(intracardiac echocardiography,ICE)是实现实时可视化和确保导管正确接触的关键。
ICE已成为IPVC消融的重要辅助工具,它可清楚地识别右心室流入和流出道、主动脉、冠状动脉开口和左冠状动脉主干的近端,而无须进行冠状动脉造影。例如,在肺动脉窦处的重建可很好地辅助导航消融导管,以实现更精确的标测和消融[6]。与普通消融相比,使用ICE的消融手术时间更短、透视的剂量更小、患者的再入院率和重复消融率更低。ICE可实时显示消融导管在主动脉中的稳定性,从而降低并发症的发生率。此外,ICE在手术过程中可识别蒸汽爆裂、血栓形成和心包积液,以便在术中立即进行治疗。同时ICE可确保导管与组织保持垂直,以获得最佳的消融效果。冷冻消融也是提高导管稳定性的一种选择[15]。对于希氏束旁PVC,当CA可能会产生传导系统附带损伤或无效时,冷冻消融可作为一种替代选择[22]。
盐水灌注导管已取代了传统温控导管,因为其消融效率更高,避免了导管-组织界面处的过热现象。盐水灌注导管允许在组织中输送更多的消融能量,特别是在血流量低的区域,而不会增加手术风险[23]。如果IPVC起源较深(壁内或心外膜,如在summit区),单纯心内膜CA可能难以抑制和治愈心律失常。首先可尝试使用更高的能量进行消融,但这通常难以达到效果。对于间隔(壁内)IPVC,如果连续单极消融失败(使用同一导管从间隔一侧和与之相对的另一侧分别消融),可尝试使用同步单极消融——用两个单独的导管在两侧同时进行单极消融[24]。每个导管都连接到独立的能量发生器并且彼此相对放置,这种类型的消融较单极顺序消融能治疗更深、更大的病变。
双极消融是另一种消融方式,使用两个消融导管,其中一个负责能量输送,另一个充当背部电极连接到无关电极端口。两个导管尖端之间的心肌通过更高的电流密度,能治疗更深和更集中的病变(透壁病变20~25 mm)[25,26]。两个导管之间的最佳距离应为15~20 mm。与同时单极消融相比,双极消融在两个导管之间传递的能量是均匀的,而在同时单极消融中,每个导管的能量分别设定。双极消融的主要缺点是没有广泛可用的设置,并且对于最佳能量和持续时间没有共识。远处区域的消融,如左室顶部,也可在心内膜上进行,使用半量生理盐水作为灌注剂。半量生理盐水作为射频电流的绝缘体,可向组织输送更多的能量;而葡萄糖水作为灌注剂会产生更大的损伤且会增加蒸汽爆裂的风险[27]。
对于心脏summit区或室间隔(通过室间隔侧支)PVC的消融,可通过导丝技术来实现能量输送[28]。例如0.014英寸Vision导丝通过Inquiry Luma-Cath电生理诊断导管推进到AIV,使用Smartablate系统(Biosense Webster)调节至20 W进行射频消融,消融时其近端需要置于盐水中。在能量输送之前必须进行冠状动脉造影,以了解冠状动脉的解剖结构。心肌内PVC的其他新技术包括通过专门设计的27-G针尖进行CA,除能量输送外,它还可用于起搏和记录心内电图。通过针头的盐水冲洗可大大增加能量输送效率[29]。温控射频能量限制为60℃ 1~2 min。对于射频消融难以治疗的PVC可使用over-the-wire球囊进行冠状动脉内无水乙醇注射,但存在乙醇泄漏和乙醇回流后导致附带损害的风险。在注射前需要通过微型多电极导管或球囊扩张导管显示AIV的间隔支。最后,心外膜消融也是心脏summit区IPVC消融的一种可选方法。
随着计算机科学的发展,AI技术也被尝试用于心律失常的诊断和治疗。AI除了用于自动心电图分析,还被用于定位心律失常的起源部位[30]。AI结合体表标测和心脏成像技术,能有效预测心律失常的起源部位,使无创心电生理检查成为可能。目前已上市的Amycard 01C和ECVUE系统能够定位房性和室性心律失常,并能提供整个心房或心室活动的同步准全局视图,甚至可以将房颤可视化[31,32]。Yang等[33]提出了一种基于卷积神经网络(convolutional neural network,CNN)和计算机模拟的心脏模型,使用12导联心电图定位IPVC起源的新方法。采用两种CNN对PVC的起源部位进行分类,分别输入心电图QRS波群的全程和前半段。对心室的计算机模型与患者的心脏进行匹配,将不同位置单个起搏得到的心室电流偶极子与对应导联区域相乘而生成训练数据集,通过计算CNN返回的加权重心来确定PVC的起源。利用该方法对9例患者的90个PVC进行了评估,并与患者的射频消融结果进行了比较,结果显示模拟评价结果具有较高的准确率。View into ventricular onset是新一代无创标测系统,它将表面12导联心电贴片的准确位置与通过心脏MRI或CT成像重建的心脏解剖结构相结合,使用逆解方法在患者心脏的3D重建中定位房室异位的局灶性激活,对室性期前收缩和室性心动过速病灶的预测准确率分别为85%和88%[34]。但目前这些技术仍然不能取代常规电生理检查。
IPVC是最常见的心律失常之一,近年来随着12导联动态心电图、智能心电监测手表等设备的发展,室性心律失常的"早发现"方面取得了很大进步。IPVC通常是良性的,然而在极少数情况下IPVC也可能会导致心原性猝死。将IPVC分类为良性或恶性需要详尽的检查,对患者的风险分层评估至关重要,需要临床医生特别注意。同时,IPVC在发生、治疗和管理方面仍存在诸多未知。特别是对于发生了CMP或恶性心律失常事件患者的治疗,以及是否需要心脏磁共振等高级检查手段仍然存在很大争议。OT是IPVC最常见的起源部位,CA治疗是其有效治疗策略。全面了解IPVC的发病机制、流行病学特征以及RVOT、LVOT之间的解剖关系对于成功治疗此类心律失常具有重要价值。当常用消融技术无效时,可采用其他策略来提高手术成功率,ICE及冷冻消融等新技术大大改善了手术效果。而对于源自复杂解剖结构IPVC的最优消融方法仍有待进一步探究。
无



























