
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
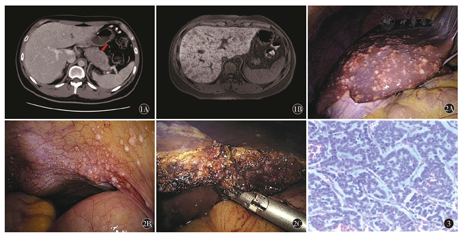
患者男性,20岁,因"发现血糖升高10个月余,左上腹痛2月"于2年前收入我院。患者于3年前体检发现空腹血糖升高(12 mmol/L),后依次出现多饮多尿、向心性肥胖、皮肤紫纹、毛发增多等症状,并出现间断性左上腹痛,但未予诊治。2年前因腹痛症状加重就诊于当地医院,行腹部B超检查发现胰尾部占位,为求进一步诊治收入我院。入院查体见患者向心性肥胖,躯干部毛发增多,皮肤色素沉着,双侧上臂内侧、腰部及双大腿后侧皮肤可见紫纹;腹软,左上腹轻度压痛,未触及包块。患者既往无内科病史,无口服激素史。入院后查空腹血糖15.08 mmol/L,糖化血红蛋白13.40(4.0~6.0)%,尿糖++++。血清游离皮质醇及促肾上腺皮质激素(ACTH)升高且缺乏节律变化:皮质醇8am:3.292(0.44~1.99)μg/L,4pm:2.624 μg/L,0am:3.029 μg/L;ACTH 8am:138.00(7.2~63.3)pg/ml,4pm:131.50 pg/ml,0am:127.50 pg/ml;24 h尿游离皮质醇升高:7 108.00(100~379)μg/24 h。甲状腺功能测定各指标均有减低:T3:0.94(1.2~3.2)nmol/L,T4:50.70(54.1~151.9)nmol/L,FT3:2.74(3.50~6.50)pmol/L,FT4:10.22(11.48~22.70)pmol/L,TSH:0.35(0.55~4.78)μIU/ml;甲状腺超声示甲状腺弥漫性病变,未见占位。腹部B超示胰腺体尾部实性占位病变,大小约6.0 cm×3.8 cm,肝脏可疑多发微小结节;腹部增强CT示胰尾部范围约3.9 cm×3.7 cm高强化占位病变,包绕脾动、静脉,且与左肾上腺外肢关系密切,肝实质增强扫描可见多发片状、圆形低密度灶(图1A);腹部增强MRI示:胰尾部大小约5.0 cm×5.4 cm×3.7 cm高强化占位,肝脏弥漫异常信号,考虑转移瘤可能(图1B);垂体增强MRI未见明确占位。术前诊断:(1)胰腺体尾部肿瘤,功能性神经内分泌肿瘤可能性大,异位ACTH综合征,伴肝脏多发转移;(2)继发性糖尿病;(3)继发性甲状腺功能减退。术前给予患者醋酸奥曲肽注射液0.1 mg皮下注射Q8 h,三餐前及睡前皮下注射胰岛素控制血糖,口服左甲状腺素钠片改善甲状腺功能。内科情况稳定后在全麻下行腹腔镜探查术,术中发现肿瘤位于胰腺体尾部,直径约5 cm,与脾静脉、左肾上腺关系密切,累及横结肠系膜根部及Treitz韧带;肝脏表面弥漫性分布白色转移癌结节,膈肌、脏层腹膜及盆壁多发粟粒样结节,考虑肝脏及腹腔多发转移(图2)。术中切取部分左肝外侧叶转移灶送病理检查。术后病理:(肝脏)神经内分泌肿瘤,细胞排列成器官样、栅栏状及梁状,核分裂像9~12/10 HPF,符合胰腺大细胞癌转移;免疫组化:Hepatocyte(-),CK8/18(-),CK7(-),CK19(++),CD56(++), Sy38(+++),CgA(+++),Ki-67 23%,CD10(局灶+),Vimentin(-)(图3)。符合G3级pNEN。术后患者规律应用长效生长抑素类似物20 mg每4周肌肉注射一次;并同时行化疗及靶向治疗:卡培他滨1 g Bid d1~d14 ;舒尼替尼37.5 mg Qd。两周期后,患者出现Ⅲ度骨髓抑制合并消化道出血,停用卡培他滨及舒尼替尼后好转。患者血糖、体重控制良好,每2个月复查腹部CT或MRI,提示胰腺肿瘤及肝转移病灶稳定,未见新发转移病灶。1年前患者因间断剧烈头痛再次入院,随后出现呕吐、上肢抽搐、言语不利等症状,复查ACTH 8am示:212.9(7.2~63.3)pg/ml,头颅MRI提示:左侧额叶、岛叶异常强化灶,转移可能大。患者及家属放弃治疗出院,10个月前死亡。自发病至死亡病程为29个月。

胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)是一类起源于胰腺多能神经内分泌干细胞的少见肿瘤,发病率<0.4/10万,仅占胰腺原发肿瘤的1%~3%左右[1]。根据是否分泌导致临床症状的相关激素,pNENs可分为功能性和无功能性两类,其中功能性pNENs以胰岛素瘤和胃泌素瘤最为常见,也有胰高血糖素瘤、生长抑素瘤和血管活性肠肽瘤等少见类型。分泌ACTH的pNENs罕见。异位ACTH综合征(ectopic ACTH Syndrome,EAS)是指垂体以外组织分泌大量ACTH激素,刺激肾上腺引起皮质醇增多症,导致出现Cushing综合征表现。合并EAS的胰腺肿瘤包括pNENs、胰腺癌、胰腺腺泡细胞癌和胰腺母细胞瘤等。表现为EAS的pNENs临床罕见,仅占全部pNENs病例的1.2%和全部EAS病例的3.6%[2]。2015年经Maragliano等[3]统计,英文文献报道的pNENs合并EAS病例总数为134例。国内文献中也仅见个案报道。该病恶性程度较高,进展迅速,多数患者早期即发生肝脏及区域淋巴结转移,但颅内转移少见。预后同Ki-67%指数密切相关,不同分级的进展期pNENs预后差异极大,据Lee等[4]报道,G1或G2级中位生存期高达83.7个月,5年生存率可达56%;而G3级患者中位生存时间仅为9.1个月。手术切除是pNENs患者缓解症状及长期生存的有效手段,即使已经出现远处转移,手术切除原发灶及应用射频、TACE等途径处理肝转移灶对于提高生活质量及改善预后仍具有重要意义。本例患者因原发灶累及Treitz韧带,肝转移及腹腔种植转移均呈粟粒状,无法行姑息切除及针对转移灶的减灭手术。术后给予长效生长抑素类似物治疗,同时口服靶向药物(舒尼替尼),并抗代谢药物(卡培他滨),但由于严重不良反应未能坚持化疗及靶向治疗。
Raymond等[5]关于多靶点蛋白酪氨酸激酶抑制剂舒尼替尼治疗晚期pNENs的前瞻性研究证实,治疗组与安慰剂组(5.5个月)相比,能够延长患者的中位无进展生存期(11.4个月)。而生长抑素类药物改善预后作用不佳,治疗pNENs的客观有效率不足10%,但疾病症状控制率可达50%~60%[6]。两药联用能有效控制患者疾病进展并改善临床症状。该患者整体治疗过程中血糖及激素水平稳定,随诊过程中胰腺原发病灶及肝脏转移灶无显著变化。药物治疗17个月后,患者出现脑转移病灶,复查ACTH激素水平明显升高,并很快死亡,体现出pNENs G3级进展期的高度恶性潜能。


























