
探讨仅累及右心室心外膜的致心律失常性右心室心肌病(ARVC)合并室性心动过速(室速)的腔内电生理机制。
本文为回顾性研究。连续性筛选2017年1月至2021年12月在北京安贞医院心律失常中心接受导管消融的ARVC相关室速患者,纳入病变仅累及心外膜的室速患者,收集相关的人口学、腔内电生理特征及随访资料。
最终纳入19例患者,其中女12例、男7例,年龄(38.1±12.9)岁,7例患者既往曾接受过消融治疗。6例患者完成了室速下右心室心内膜及心外膜的同步标测,均可在心外膜记录到完整室速折返环路。所有患者进一步接受了心内膜及心外膜的基质标测,可见内膜基质良好无低电压区,双极电压均>1.5 mV,心外膜可见片状低电压区,面积为(26.5±9.6)cm2。以基质标测为基础行均质化消融后,随访(22.3±6.7)个月,无心动过速复发。
病变仅累及右心室心外膜的ARVC相关室速是一种特殊类型心律失常,心室心内膜基质良好,行干性心包穿刺后方可达到病变部位并指导消融。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
致心律失常性心肌病(arrhythmogenic cardiomyo-pathy,ACM)是一类以恶性心律失常和心脏性猝死为主要临床表现的进展性心肌疾病,致心律失常性右心室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)是其中的主要亚型,以右心室心肌组织被纤维-脂肪组织替代为主要病理学改变[1]。这种病理学改变介导产生折返环路是其主要的致心律失常机制[2]。既往研究表明,ARVC患者纤维-脂肪替代不仅可累及心内膜,也可以累及心外膜,心外膜纤维化面积大于心内膜是ARVC基质标测的主要特点之一,联合心内-心外膜消融成功率较单纯心内膜消融高[3,4]。ARVC疾病进展具有从心外膜向心内膜浸润渗透的特点,在疾病早期阶段可仅累及右心室心外膜面,此时右心室心内膜基质良好,通过单纯心内膜放电消融难以终止心动过速,多数患者存在手术失败及复发风险[5,6]。此外,部分病例可能仅累及心外膜,单纯心内膜标测可能漏诊。本文拟对仅累及右心室心外膜的ARVC相关室性心动过速(室速)的导管消融病例进行分析,总结其临床及电生理特点。
本研究为回顾性研究,连续性筛选自2017年1月至2021年12月在首都医科大学附属北京安贞医院心律失常中心行导管消融的器质性室速患者,其中ARVC相关室速患者105例,选择室速仅涉及心外膜的患者纳入本研究。所有受试者均在研究前签署知情同意书,研究程序通过本院医学伦理委员会批准(伦理号:2023073X)。纳入标准:①符合Padua诊断标准的"确定""边界"或"可能"ARVC患者[7];②存在反复发作的症状性室速,且抗心律失常药物控制不佳或不能耐受;③经影像学检查或心腔内标测结果分析确诊ARVC原发病变及室速折返机制仅累及心外膜。排除标准:①影像学检查或心腔内标测提示双心室或右心室心内膜受累;②经评估后确诊为其他心肌病(如扩张型心肌病、肥厚型心肌病、致心律失常性炎性心肌病)或离子通道病(如Brugada综合征)。
本中心拟行室速导管消融的患者均常规完善术前检查,包括血液检查、动态心电图、胸部X线检查以及经胸超声心动图等。对于ARVC患者,如病情允许且无检查禁忌证,所有患者术前均行心脏磁共振成像检查以进一步明确诊断,识别心肌延迟强化位置,对拟标测及消融区域进行术前规划。根据Padua诊断标准中的心室表型-功能异常、心室结构异常、负极异常、除极异常、室性心律失常以及家族史/遗传学证据,对患者ARVC的患病可能进行综合性评估。
除急诊导管消融患者外,所有患者术前停用抗心律失常药物至少5个半衰期。于局部麻醉镇静状态下行室速导管消融术,床旁体外除颤仪备用。穿刺右侧股静脉,置入4极导管于右心室心尖部作起搏/诱发备用,同时使用左侧位导丝指引下的干性心包穿刺方法建立心外膜标测通道,穿刺后保留长导丝保护,暂不予以普通肝素抗凝。首先在窦性心律下,分别对右心室心内膜和心外膜进行完整的解剖重建和电压标测,取点密度>3个/cm2,将双极电压>1.5 mV作为正常电压区域,双极电压<1.5 mV作为低电压区,结合阻抗、压力排除孤立分布(面积<1 cm2)的假性低电压区。完成干性心包穿刺后至少30 min,明确无活动性出血后,根据激活全血凝固时间予以肝素抗凝。
在完成右心室的电压标测后,通过右心室导管对室速进行诱发,如诱发失败则静脉给予异丙肾上腺素(2~4 μg/min)进行重复诱发。室速发作后首先明确血流动力学是否稳定,如在血管活性药物下血流动力学仍不稳定,或退化为心室扑动(室扑)或心室颤动(室颤),则紧急行体外除颤。如血流动力学允许,则在同一周长下对室速进行全心腔的激动标测。
仅累及心外膜的室速被定义为通过基质标测显示心室低电压区仅累及右心室心外膜,心内膜基质完好。如记录到室速发作,则可在心外膜记录到>90%的室速周长,并且室速的完整关键峡部位于心外膜。
上述标测均在三维电解剖标测系统(Carto 3,美国强生公司)指导下完成。如果临床室速可以稳定诱发,那么初始消融靶点为标测所得的关键峡部。放电终止心动过速后,或室速始终无法诱发或不持续,则根据患者低电压区域的分布行基质改良消融,以消除所有延迟电位作为消融目标。消融前行起搏标测鉴别局部心肌是否为致密瘢痕或存在存活心肌,并与临床室速形态进行比对。使用3.5 mm冷盐水灌注压力导管(Navi-Star Thermo-CoolTM,美国强生公司),35~40 W功率模式进行放电,局部放电时间>30 s。消融完成后观察30 min并静脉滴注异丙肾上腺素诱发确认无临床室速出现。在心外膜进行标测及放电时,及时通过穿刺短鞘抽取心包腔内的灌注盐水,并观察抽取积液的颜色,明确有无活动性心包内出血。消融术后向心包腔内注射地塞米松抗炎以及利多卡因止痛,留置心包穿刺置管1~2 d,如每日从导管内抽出淡红色积液<50 ml则可拔除心包穿刺置管。
患者在消融术后如需植入心律转复除颤器,则推荐患者择期行植入手术,术后根据患者情况予以抗心律失常药物治疗,术后1、3、6个月分别门诊随访并行动态心电图检查,以后每6个月定期随访1次,期间如有心悸、胸闷等症状随时复查心电图,并行除颤器程控,明确有无室速复发。
采用SPSS 23.0软件进行统计学分析。分类变量以频数和百分率的形式表示,符合正态分布的计量资料用 ±s表示。分类变量的比较采用Fisher确切检验,满足正态分布的连续变量采用两独立样本t检验,非正态分布资料采用Mann-Whitney U检验。以双侧P<0.05为差异具有统计学意义。
±s表示。分类变量的比较采用Fisher确切检验,满足正态分布的连续变量采用两独立样本t检验,非正态分布资料采用Mann-Whitney U检验。以双侧P<0.05为差异具有统计学意义。
最终纳入19例患者,其中女12例(63.2%,12/19),年龄(38.1±12.9)岁。7例(36.8%,7/19)患者曾接受过至少1次既往心内膜消融,无患者既往行心外膜消融。4例(21.1%,4/19)患者既往曾出现过晕厥,2例(10.5%,2/19)患者为心脏性猝死幸存。患者右心室直径为(23.2±2.4)mm,左心室直径为(42.7±3.3)mm,左心室射血分数为(54.5±5.0)%,7例患者(36.8%,7/19)出现右心室扩大。所有患者均符合ARVC诊断标准,术前均可记录到室速发作,均呈左束支传导阻滞图形。7例(36.8%,7/19)患者的基线窦性心律心电图可见Epsilon波。11例(57.9%,11/19)患者心脏磁共振成像可见心外膜下延迟强化,其中7例患者心外膜延迟强化位于右心室流出道,4例患者心外膜延迟强化位于右心室流出道和三尖瓣环后侧壁区域,另外8例(42.1%,8/19)患者心脏磁共振成像未见明确延迟强化区域。所有患者的左心室及室间隔区域均未见明确异常表现。
所有患者均在局部麻醉镇静下完成导管消融术,上台后完成心室导管放置后行干性心包穿刺。经程序刺激后,10例(52.6%,10/19)患者术中可诱发出(1.4±0.6)种室速,其中3例因血流动力学不稳定、1例因室速不持续而无法完成完整的激动标测,6例患者可诱发稳定室速,并行完整的右心室心内膜、心外膜同步标测。如图1所示,右心室心内膜激动弥散被动,无明确最早激动点,可标测周长占总周长<60%(46.4±6.2)%。心外膜可记录到完整的室速周长,并可见到包括出口、入口、峡部及外环在内的完整折返环路,峡部距离心内膜最早激动区域(3.4±0.7)cm,在心外膜峡部消融局部均可终止室速。
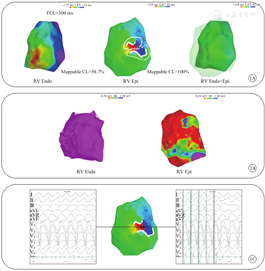

注:TCL为总周长,Mappable CL为可标测周长,RV为右心室,Endo为心内膜,Epi为心外膜
所有患者均行完整的右心室内、外膜同步基质标测,心内膜取点(453±330)个,心外膜取点(738±417)个。在排除假性孤立性低电压区后,所有患者心内膜均无法记录到低电压区域,包括既往曾在右心室心内膜消融的患者,所有内膜双极电压均>1.5 mV。心外膜低电压区均呈片状分布,低电压区总面积为(26.5±9.6)cm2。所有患者可在流出道区域记录到低电压区,面积为(30.0±8.3)cm2,8例(42.1%,8/19)患者可在三尖瓣环后侧壁及底部区域记录到低电压区,面积为(18.1±7.3)cm2,低电压区内部电位呈延迟、碎裂形态,起搏均可夺获(图2)。6例(31.6%,6/19)患者同时进行了左心室心内膜或心外膜的基质标测,也均未记录到低电压区域。
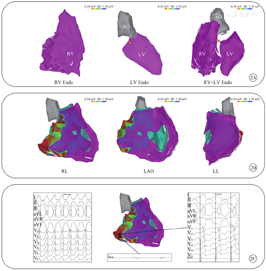

注:RV为右心室,LV为左心室,AO为主动脉,Endo为心内膜,RL为右侧位,LAO为左前斜位,LL为左侧位
根据上述基质标测结果,所有患者接受了均质化消融,消融时间(26.6±10.5)min,放电次数(44.8±10.9)次。重复诱发均无临床室速发作,术后(1.2±0.4)d拔出心包引流管,无围术期并发症发生,术后所有患者恢复β受体阻滞剂在内的抗心律失常药物治疗。
随访(22.3±6.7)个月,无患者再发心悸,规律随访复查心电图及动态心电图未再见室速。
本研究通过对19例室速机制仅累及右心室心外膜的ARVC导管消融病例进行总结后发现,这类患者的右心室心外膜存在片状低电压区,室速折返局限于低电压区内部,对心外膜基质进行基质改良消融后可达到手术终点,短期随访结果满意。而心内膜基质标测电压正常,室速时呈被动激动,单纯心内膜消融难以达到手术终点。
ACM的主要病理学改变是正常心肌组织被纤维-脂肪组织替代,局部传导的不均一性和缓慢传导,构成了病理性室速折返的基本条件。该疾病的进展是从心外膜向心内膜的浸润过程,因此不同阶段累及的心脏层面有所不同,但心外膜始终是ARVC的主要受累层面。但在临床中常见的ARVC相关室速人群主要分为以下两种:①中晚期的ARVC患者,既往未规范地随访,但以心律失常作为主要原因就诊。由于心室脂肪-纤维浸润显著,心电活动显著异常导致了室速的产生。这类患者心内标测可发现广泛和显著的瘢痕区和异常电位,有时需要与扩张型心肌病进行鉴别,但心外膜低电压区面积始终大于心内膜。②早期ARVC患者,此时无论是影像学还是静息心电图均无异常表现,心律失常可能是唯一的临床表现。这类患者心室病理学改变局限,虽然仅累及心外膜,但已构成导致室速的基本条件[8,9]。本研究患者有且仅有心外膜的致病基质,但是否为早期ARVC仍需要继续随访,动态观察。临床中的确观察到部分ARVC患者进展缓慢,多年随访无心室继续扩大及心功能下降。但不排除有此特征的患者是一种特殊形式的ARVC,因部分患者的心外膜瘢痕区面积较大(图1),已不具备早期ARVC局灶、小面积受累的表现特点。但心内膜仍无受累,同时右心室显著扩大、功能下降。
针对ARVC相关室速的标测消融策略存在不同观点,部分学者对于初次手术的患者均先对心内膜进行初步标测,对于既往消融失败或复发的患者则会进行心外膜标测,另有学者则会根据心内膜的标测结果选择是否进行心外膜标测[10,11]。但根据ARVC病变进展的方向,其心外膜受累始终比心内膜受累严重,初始进行干性心包穿刺行心外膜标测及消融有助于对病变基质的完整识别,对指导后续消融具有重要指导意义。有研究证实,这种心内膜-心外膜联合标测消融的策略有助于提高ARVC相关室速的导管消融成功率[3]。对于本研究所纳入的患者,病变基质均存在于心外膜,心内膜电压完好,如仅进行心内膜标测则无法识别致病基质,导致消融失败,这也正是本研究其中7例患者消融后复发的主要原因。并且本研究发现,在室速发作下行激动标测,心外膜关键峡部距离心内膜最早激动存在一定距离,达(3.4±0.7)cm,且并非解剖垂直对应,因此仅对心内膜进行激动标测无法预测外膜峡部所在位置,心内膜放电消融无助于终止心动过速。
尽管在室速发作下进行完整的心内膜-心外膜的同步激动标测对于判断室速起源层面最为准确[12],但常因心动过速不诱发、血流动力学不稳定等因素而无法完成。如有针对性地进行术前规划则可易化术中消融策略,例如术前心脏磁共振影像明确记录到了心外膜的延迟强化,则可直接进行心外膜标测。但磁共振对于心外膜的孤立性瘢痕识别敏感性有限,如本研究中部分患者的心脏磁共振显示心外膜虽无明显的延迟强化,但心外膜标测可见致心律失常基质,提示电生理标测对于判断心律失常起源具有决定性作用。如部分器质性室速在术前确实无法明确病因,则初始标测可从心内膜开始,如心内膜标测到的"最早"激动弥散、无法记录到室速全部周长,可标测周长<全部周长的60%,起搏心电图形态与临床室速存在差别[12,13]。上述指标均强烈提示室速可能为心外膜起源,应及时行干性心包穿刺行心外膜标测。单极电压对于判断心外膜起源亦有重要作用,如"最早"激动部位局部单极电图非QS型。另有研究显示,心内膜单极电压<5.5 mV与心外膜低电压区存在一定相关性,且单极电压标测对于发现双极标测电压正常的孤立性心外膜基质存在有一定意义,结合内膜单双极标测可更有效推断心外膜的基质情况[14,15]。
消融方面,ARVC相关室速与其他瘢痕相关大折返性室速的治疗并无区别。除在解剖峡部放电终止心动过速外,进一步行心外膜的均质化消融,针对所有延迟、碎裂电位进行改良,并可通过起搏识别低电压区内是否存在存活心肌或改变激动顺序,帮助识别延迟电位。使用本研究的标测及消融方法,经过短期随访,所有患者均得到了较为满意的消融效果,远期成功率仍需长期随访证实。
本研究存在一定局限性:①本研究为小样本单中心研究,所得结论是否可推论至整体ARVC相关室速人群仍有待研究;②并非所有患者进行了全面的影像学评估和基因检测,故这类特殊ARVC室速患者是否有特定的遗传背景仍未有定论;③由于种种限制,多数患者未行全心腔的完整激动标测,我们根据致心律失常基质所在层面定义了这类室速人群,但上述患者的致心律失常基质是否涉及心肌中层存在争议。上述问题,也将在我们未来的前瞻性队列研究中加以验证。
仅累及心外膜的ARVC相关室速是一种特殊类型的器质性室速,心内膜缺乏可标测的致心律失常基质,需要干性心包穿刺进行心外膜的标测和消融。
所有作者均声明不存在利益冲突



























