
胰岛素瘤是最常见的功能性胰腺神经内分泌肿瘤,手术切除或局部剜除是其最常用的治疗方式。胰岛素瘤多为良性、单发,且体积较小,从理论上讲,是射频消融(RFA)治疗的良好适应证。2009年,Limmer等报道了首例应用RFA治疗胰岛素瘤的病例,至今已有5篇同类英文文献发表,累计病例为7例。近一年来,本文作者利用腹腔镜下RFA成功治疗胰岛素瘤2例(胰尾和胰体各1例),均获得完全消融,无并发症发生,临床症状消失。本文通过对9例患者的资料进行分析初步表明,RFA治疗胰岛素瘤是安全、有效的,对于符合条件的胰岛素瘤患者,RFA可作为首选的治疗方式。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰岛素瘤是最常见的功能性胰腺神经内分泌肿瘤,其发病率约为每年每百万人口1~4例[1],占胰腺全部肿瘤的1%~2%。胰岛素瘤可发生于任何年龄,无性别差异。资料显示,90%以上的胰岛素瘤为良性,90%以上为单发,90%以上发生于胰腺,且没有发病部位上的差异,90%以上直径小于2 cm[2]。
胰岛素瘤的治疗主要以外科治疗为主,手术切除或局部剜除是其最常用的手术方式[3,4]。近十多年来,以射频消融(radiofrequency ablation, RFA)为代表的局部消融治疗理念在肝肿瘤[5]等实质脏器肿瘤综合治疗中被广为接受,RFA可作为有选择的早期肿瘤首选的治疗方式。胰岛素瘤多为良性、单发,体积较小,从理论上讲,是RFA治疗的良好适应证。2009年,Limmer等[6]首次报道了1例应用RFA成功治疗胰岛素瘤的病例。我们以PubMed为搜索引擎,insulinoma和radiofrequency ablation为关键词,查找胰岛素瘤RFA治疗的相关文献,共获得4篇[6,7,8,9],累计为7例患者(表1)。国内文献未见有报道。近一年来,作者利用腹腔镜下RFA成功治疗胰岛素瘤2例。本文结合该9例患者资料,对RFA治疗胰岛素瘤的可行性、安全性和疗效进行讨论。
胰腺胰岛素瘤射频消融治疗病例汇总
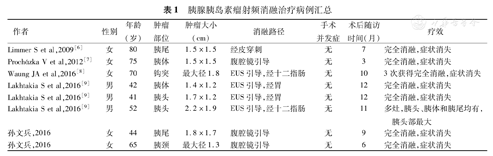
胰腺胰岛素瘤射频消融治疗病例汇总
| 作者 | 性别 | 年龄(岁) | 肿瘤部位 | 肿瘤大小(cm) | 消融路径 | 手术并发症 | 术后随访时间(月) | 疗效 |
|---|---|---|---|---|---|---|---|---|
| Limmer S et al,2009[6] | 女 | 80 | 胰尾 | 1.5×1.5 | 经皮穿刺 | 无 | 7 | 完全消融,症状消失 |
| Procházka V et al,2012[7] | 女 | 75 | 胰体 | 1.5×1.5 | 腹腔镜引导 | 无 | 3 | 完全消融,症状消失 |
| Waung JA et al,2016[8] | 女 | 70 | 钩突 | 最大径1.8 | EUS引导,经十二指肠 | 无 | 10 | 3次获得完全消融,症状消失 |
| Lakhtakia S et al,2016[9] | 男 | 42 | 胰体 | 1.4×1.2 | EUS引导,经胃 | 无 | 12 | 完全消融,症状消失 |
| Lakhtakia S et al,2016[9] | 男 | 41 | 胰头 | 1.7×1.2 | EUS引导,经胃 | 无 | 12 | 完全消融,症状消失 |
| Lakhtakia S et al,2016[9] | 男 | 52 | 胰头 | 2.2×1.9 | EUS引导,经十二指肠 | 无 | 11 | 多灶,胰头、胰体和胰尾均有,胰头部最大 |
| 孙文兵,2016 | 女 | 44 | 胰尾 | 1.8×1.7 | 腹腔镜引导 | 无 | 9 | 完全消融,症状消失 |
| 孙文兵,2016 | 女 | 65 | 胰颈 | 最大径1.3 | 腹腔镜引导 | 无 | 6 | 完全消融,症状消失 |
例1,女性,44岁。因"反复发作性出汗、心慌、乏力4年余"入院。无心、肺、肾等重要脏器疾病史,查体无阳性体征。随机末梢血血糖2.4 mmol/L;空腹血糖1.73 mmol/L;糖化血红蛋白3.30%;空腹血清胰岛素372.63 mU/L。增强CT见胰尾部类圆形等密度结节,动脉前期、动脉期明显强化,强化幅度高于正常胰腺组织,大小1.8 cm×1.7 cm,边缘清晰(图1A)。静脉及延迟期强化幅度略高于正常胰腺,冠状位重建示胰尾部肿瘤向下方生长(图1B)。增强MRI扫描见胰尾部类圆形结节,边缘清,T1WI压脂为低信号,T2WI为略高信号,增强扫描呈均匀强化(图1C)。结合临床,考虑胰岛素瘤。
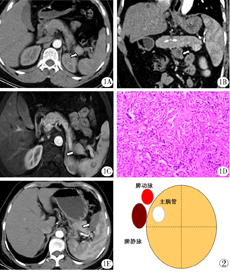

2015年9月12日,患者在全麻下行腹腔镜下胰岛素瘤射频消融术。打开胃结肠韧带,显露胰体尾,于胰尾末端见一直径约2.0 cm瘤体。钳取约0.5 cm的瘤体组织送病理检查。快速冰冻结果提示为良性,遂决定行胰尾肿瘤RFA治疗。术中血糖为2.4 mmol/L。在腹腔镜引导下,将Cool-tip ACTC 2020射频针经皮肤穿刺入腹腔,直视下穿刺瘤体,多点消融瘤体。射频发生器采用Covidien Healthcare产品(爱尔兰,都柏林),射频功率设定在40 W以下。RFA后血糖逐步升为3.9 mmol/L。消融区置引流管一根。术后安返病房。术后无出汗、心慌、乏力等症状发作。空腹血糖5.26 mmol/L,随机末梢血糖5.73 mmol/L,糖化血红蛋白:4.30%,血清胰岛素:63.38 mU/L。
术后72小时拔除引流管,无胰漏发生。术后7天出院。术后病理报告:胰腺神经内分泌肿瘤,G1(图1D)。术后9个月随访,患者生活质量好,无出汗、心慌、乏力等症状发作。增强CT示胰尾部肿瘤完全消融,局部有少量液体积聚(图1E)。
例2,女性,65岁,因"反复出汗、心慌、乏力3年余"于2016年1月2日入院。查体:心肺及腹部未见阳性体征。化验检查:血尿便常规未见异常,血糖2.33 mmol/L,癌胚抗原6.59 μg/L, CA19-9 67.52 kU/L。上腹部增强CT示胰颈部动脉期见结节状高强化灶,直径约1.3 cm,边缘尚清,延迟期呈近等密度。提示胰岛素瘤。
2016年1月9日在腹腔镜引导下行胰岛素瘤射频消融术。术中于胰颈部下缘见直径约1.5 cm大小的瘤体,与周围胰腺组织分界明显,包膜完整。钳取约0.5 cm的瘤体组织送病理,快速冰冻结果提示为良性,遂决定行胰颈部肿瘤RFA治疗。术中血糖为2.2 mmol/L。消融策略以及所用器械设备均同例1。RFA后血糖逐步升为3.5 mmol/L。消融区置引流管一根。术后安返病房。术后无出汗、心慌、乏力等症状发作,空腹血糖和随机末梢血糖均在正常范围之内。
术后72小时拔除引流管,无胰漏发生,术后6天出院。术后病理报告:胰腺神经内分泌肿瘤,G1。术后6个月随访,无出汗、心慌、乏力等症状发作,生活质量好。增强CT示胰颈部肿瘤完全消融。
适合局部消融治疗的病灶须具备至少以下三方面条件:一是荷瘤器官浅在,易于穿刺,且安全,如肝脏、肺脏、甲状腺和乳腺等。二是病灶局限,且体积小。体积越小,越易获得完全消融,疗效越确定,也越安全。三是病灶与周围重要结构之间有一定的安全距离。当病灶与肝门、胃肠道、胆道、胰管、肺门等重要结构毗邻时,消融时易发生这些结构的穿刺损伤和热损伤,导致严重并发症。
胰腺是位置深在的器官,前方有胃、横结肠等重要脏器,后方有肾、腹主动脉、下腔静脉、脾动静脉等重要结构,胰头的侧方有十二指肠包绕,胰尾侧有脾脏遮挡。从理论上讲,胰腺肿瘤行经皮穿刺消融的路径较长,有一定的困难和风险。本文收集的9例患者中,2例为影像学引导下经皮穿刺射频消融,均获成功,无穿刺相关并发症出现。这说明,对于有经验的医师,经皮穿刺路径可以安全地应用。近十多年来,随着内镜超声(endoscopic ultrasound, EUS)的广泛开展,EUS引导下胰腺细针穿刺消融治疗变得容易且直观,胰颈和胰体尾肿瘤可经胃穿刺,胰头肿瘤则可以经十二指肠穿刺。9例中,4例在该路径下实施,显示了其较好的发展潜力。对于外科团队而言,随着腹腔镜技术的广泛应用和经验积累,腹腔镜下对胰腺的暴露和游离也变得越来越容易[10],加之术中腔镜超声的应用[4],腹腔镜可作为胰岛素瘤局部消融治疗的首选路径。总之,EUS和腹腔镜技术已让胰腺这个传统的"深在"器官变得"唾手可及",胰腺肿瘤穿刺消融治疗变得直接且安全。
主胰管多位于胰腺的后上方,主胰管的偏位为胰岛素瘤的RFA治疗提供了更多的安全保障。从胰腺断面看(图2),胰管常位于胰腺的后上方,与胰动静脉毗邻,胰腺上半部的前1/2和下半部分是RFA治疗的安全区域。另外,胰尾是主胰管的盲端。在主胰管通畅的前提下,如果在胰尾区域发生主胰管的穿刺损伤或热损伤,理论上不会发生顽固性胰漏。所以,整个胰尾都是RFA的安全部位。
文献检索显示,胰岛素瘤局部消融治疗的方法有三:无水酒精注射[11]、RFA和微波消融[12]。依肝癌局部消融治疗的经验可知,无水酒精注射具有穿刺伤发生率低等优点,且无热损伤。但因酒精弥散受组织密度影响大,消融范围不易确定,更适合较小的病灶。微波消融效率高,短时间内可消融较大范围的组织,对于体积大的病灶有优势。RFA消融效率适中,消融范围更加易控,周边重要结构热损伤发生率低。由于胰岛素瘤的解剖组织特点与肝癌有明显不同,这三种消融方式对于胰岛素瘤消融治疗的优缺点尚需进一步观察和总结。
如上所述,胰岛素瘤是RFA治疗的理想适应证。然而,自2009年首例报道以来,跟进者寥寥,累计例数仅有9例。探究其原因主要有三:一是胰岛素瘤发病率本身就低,且病例散在,难以集中;第二,因为局部消融治疗在穿刺和消融两个环节,均存在一定的盲目性。理论上,容易导致胰管损伤等并发症,故该治疗在适应证的选择上更加严格;第三,该病是典型的外科疾病,其局部消融治疗的理念远未确立。
总之,胰腺胰岛素瘤的RFA治疗已经有了一个良好的开端。9例患者的资料初步表明,RFA治疗胰岛素瘤是安全、有效的。对于有选择的患者,可作为首选的治疗方式。随着局部消融理念在外科团队的进一步普及,RFA治疗在胰腺胰岛素瘤的外科治疗中必将占有越来越重要的地位。相信在不远的将来,RFA治疗胰腺胰岛素瘤不再是偶然事件,而能成为一种必然。



























