
重症急性胰腺炎(SAP)并发肠坏死是一种少见而严重的并发症,诊断困难,预后差,专业书籍鲜有记载。本文报道1例47岁男性患者,因SAP住院,CT检查发现肠壁积气并提示肠坏死可能,急诊手术发现胰腺坏死合并回、结肠坏死,行末端回肠切除术+右半结肠切除术+胰尾坏死组织清除胰周引流术+回肠造瘘术,患者术后因多器官功能衰竭死亡。合并肠坏死尤其是结肠坏死是SAP少见的严重并发症,需引起医师的足够重视。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
重症急性胰腺炎(severe acute pancreatitis, SAP)常合并急性呼吸窘迫综合征、休克、凝血功能障碍、急性肾损伤等并发症,死亡率高[1]。在消化道方面,可发生消化道出血、麻痹性肠梗阻、消化道穿孔、消化道瘘等并发症。SAP累及结肠并发症者少见,病死率高,外科学专著却无相关内容描述[2,3],容易被临床医师忽略。
结肠系膜和结肠血管容易受到胰腺炎症的波及,表现为肠梗阻、便血、进行性加重的脓毒血症等多种表现[4]。SAP并发肠缺血坏死的临床诊断和影像学诊断十分困难,结肠缺血坏死和/或反应性结肠炎的各种表现均可能被SAP的症状所掩盖,而日常工作中对CT检查发现的结肠壁异常又重视不足[5]。如果SAP并发肠缺血/坏死未得到及时诊断和恰当治疗,将进一步恶化为多器官功能障碍综合征(MODS),甚至死亡。本文报道1例SAP并发回结肠坏死的病例,并复习文献,以期提高医师对该并发症的认识。
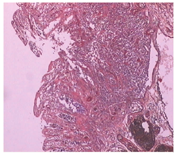
患者男性,47岁,因"持续性腹胀、腹痛3 d,症状加重伴黑便1 d"急诊入院,既往有痛风10余年,长期服用强的松、保泰松、布洛芬治疗,余无特殊病史。入院查体:体温38.5℃,脉搏110次/min,呼吸26次/min,血压90/65 mmHg(1 mmHg=0.133 kPa),意识清楚,稍烦躁,皮肤巩膜无黄染,双肺呼吸音粗,全腹稍膨隆,上腹部压痛明显,轻度肌紧张,肠鸣音1~2次/min。实验室检查:白细胞2.85×109/L,血小板30×109/L,谷丙转氨酶115 U/L,谷草转氨酶419 U/L,血尿素氮16.8 mmol/L,肌酐439 μmol/L,Ca2+ 1.65 mmol/L,淀粉酶2 790 U/L,血糖12.8 mmol/L,降钙素原80.91 μg/L,脑钠肽9 719 pg/ml。入院诊断为急性胰腺炎、休克代偿期、MODS、痛风。积极采取禁食、胃肠减压、解痉镇痛、抑制胰液分泌、补液扩容、营养支持和中药等综合治疗措施,病情无缓解,腹痛、腹胀进一步加重。入院后10 h腹部增强CT报告:小肠不全性梗阻,左中上腹小肠肠壁下积气,肠坏死可能;右中下腹小肠肠壁异常强化,考虑炎性病变;腹腔积液;胰体、尾部强化不均匀伴周围积液,双侧胸腔积液(图1)。诊断性腹腔穿刺抽出暗红色血性液体,考虑SAP合并肠坏死可能。征得家属同意,急诊剖腹探查,术中发现约有100 cm的末端回肠坏死和右半结肠坏死,胰体、尾部坏死。行末端回肠切除术+右半结肠切除术+胰体尾坏死组织清除胰周引流术+回肠造瘘术。术后转ICU进一步治疗,因病情重,术后第3天因多器官功能衰竭死亡。术后病理示肠壁细胞坏死,大量炎性细胞浸润(图2)。
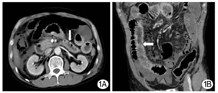

1A:冠状位影像提示小肠不全性梗阻,左、中上腹小肠肠壁下积气,肠坏死可能(箭头所示);1B:矢状位影像提示右中下腹小肠肠壁异常强化,考虑炎性病变(箭头所示),腹腔积液

SAP累及结肠的并发症相对少见,主要有结肠坏死、结肠瘘和结肠狭窄引起的肠梗阻三种类型。一篇回顾1950~2006年43篇关于胰腺炎结肠并发症的文献[6],共收集97例患者,其中急性胰腺炎结肠并发症发生率为3.3%,而SAP组结肠并发症发生率高达15%。Kriwanek等[7]报告SAP的开腹手术中发现结肠坏死发生率为17%。我们认为,SAP结肠并发症的实际发病率可能更高,因为并非所有SAP死亡病例都接受了手术探查或尸检证实结肠发生的损害。
结肠系膜缺血是发生SAP结肠并发症的重要机制[4,6,8]。造成结肠系膜缺血主要有以下原因:(1)胰腺坏死组织感染所产生的酶和炎性介质可波及结肠系膜及其血管造成缺血,另外炎性包块压迫肠系膜血管也可造成其缺血;(2)中老年患者由于存在肠系膜动脉粥样硬化的基础病变,更容易发生结肠系膜缺血;(3)由于低血压、血液浓缩、弥散性血管内凝血等因素导致肠系膜血管血栓而继发缺血亦常见;(4)腹腔间隔室综合征引起的结肠系膜缺血。结肠缺血进一步发展可造成结肠坏死、结肠瘘、结肠狭窄。一般情况下,结肠坏死明显早于结肠瘘和结肠狭窄,因此在临床上当结肠瘘、结肠狭窄获得诊断时,急性胰腺炎可能已明显缓解或治愈。
SAP合并结肠坏死常见于横结肠部位[4],由于该部位毗邻胰腺,结肠中动脉支配的范围最容易受到波及。Abcarian等[9]报告的10例结肠坏死分别是升结肠1例,脾曲降结肠1例,横结肠3例,脾曲4例,全结肠1例。
术前诊断SAP合并结肠坏死十分困难,由于SAP合并结肠坏死发生率很低,临床缺乏特征性表现,而且SAP全身炎症反应综合征和腹腔间隔室综合征可掩盖结肠坏死的征象,因此临床医师不易发现。Mohamed等[6]回顾性分析41例急性胰腺炎合并结肠坏死的资料发现,术前诊断仅1例,尸检诊断2例,情况不明确2例,由于具备SAP手术适应证(脓毒血症、坏死组织清除术、消化道出血、肠梗阻等)而在术中意外发现并获得诊断者36例。
当SAP患者出现如下情况时,要高度警惕发生合并结肠坏死可能:在ICU加强治疗过程中,SAP症状进行性加重,出现严重而难以控制的脓毒血症;消化道出血,尤其是便血。Shiratori等[10]提出当急性胰腺炎患者出现"腹部包块、脓毒血症和便血"三联征,应高度怀疑肠坏死可能。对怀疑合并结肠坏死的患者,进一步增强CT扫描对诊断有一定的帮助,一旦发现结肠壁增厚或后腹膜气体征象,应高度怀疑结肠受累可能;如果出现结肠壁内气体征象,则考虑结肠坏死。结肠中动脉造影也有助于诊断。
一旦发现有SAP结肠受累可能时,需尽早手术探查,切除受累肠段(包括坏死肠管以及疑似缺血和可能穿孔的肠管),并行回肠末端造瘘。手术切除范围宜从宽[5,7],凡是疑似缺血的肠管都应予以切除。因横结肠受累居多,一般采用扩大右半结肠切除术或次全结肠切除术,同时行回肠末端造瘘术。该术式具有如下优点[7]:更充分引流后腹膜间隙的坏死组织;减轻结肠来源的细菌与内毒素移位引起的脓毒血症;通过回肠末端造瘘尽早恢复肠内营养,保护肠黏膜屏障;降低腹腔压力,改善呼吸功能和肾功能。
本例患者经手术确诊为SAP并发末段回肠和右半结肠坏死,属于SAP并发肠坏死的罕见情况。复习病历资料,患者兼具病情进行性恶化、便血和CT肠壁积气等临床特征。虽影像学提示SAP合并肠坏死可能,并及时手术治疗,患者终因病情危重而结局不良。
总之,急性胰腺炎可能合并结肠坏死、结肠瘘、结肠狭窄等结肠相关并发症。结肠坏死是SAP少见的严重并发症,诊断困难,临床医师在诊治过程中务必提高警惕,认识到SAP并发结肠坏死的可能。SAP并发结肠坏死预后差,及时行包括受累结肠在内的扩大右半切除术或次全结肠切除术联合回肠末端造瘘术有助于改善预后。
所有作者均声明不存在利益冲突



























