
孤立性脾转移癌系指恶性肿瘤单纯性转移至脾脏而不伴随其他器官受累的特殊类型脾转移癌,临床上以乳腺恶性肿瘤来源的孤立性脾转移癌甚为罕见,诊疗经验亦鲜有报道。笔者回顾一例大连医科大学附属第一医院肝胆外科收治的乳腺癌术后孤立性脾转移癌患者的临床资料,并结合既往文献,探讨其潜在的转移机制及诊疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,58岁,以"体检发现脾占位1周"于2017年4月12日入院。入院体检示:腹软,无压痛及反跳痛,肝脾未及肿大。辅助检查:血常规、生化及肿瘤标志物等均无明显异常。4年前曾因右乳腺癌于大连医科大学附属第一医院行"右乳癌简化根治术",术后病理示:右乳腺低分化浸润性导管腺癌伴腋窝淋巴结转移(图1A)。免疫组化:ER(+),PR(-),Her-2(+)。诊断:乳腺癌IIB期(pT2N1M0)。术后遵医嘱行6个周期化疗(多西紫杉醇75 mg/m2,表阿霉素70 mg/m2),附加1个周期放疗,辅以长期口服来曲唑防止肿瘤复发。
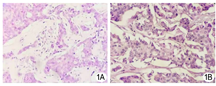

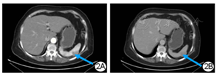
2017年4月7日大连医科大学附属第一医院门诊复查腹部增强CT示:脾脏上极椭圆形稍低密度占位,大小3.0 cm×2.0 cm,增强扫描三期CT值分别为83、78、78 HU,余腹腔脏器均未见异常,腹膜后未见异常淋巴结影(图2)。影像学诊断:(1)脾脏上极肿物,考虑淋巴瘤可能性大;(2)脂肪肝征象。复查胸部CT及全身骨扫描等均未见原位复发及骨转移。鉴于该患者既往乳腺癌病史,影像学仅发现脾脏占位,考虑罕见的孤立性乳腺癌术后脾脏转移,手术指征明确,遂于2017年4月17日全麻下行腹腔镜下脾切除术。手术顺利,术程约2 h,出血少量,常规护理6 d后患者康复出院。术后病理示:脾脏表面一灰黄色结节样肿物,大小3.5 cm×2.5 cm×0.9 cm,切面实性、灰白间灰黄色,与周边分界欠清。镜下见大量异型细胞取代正常脾脏组织,异型细胞大小不一,核大、深染,呈片状或巢状生长。病理诊断:脾脏转移性低分化腺癌,考虑乳腺恶性来源(图1B)。免疫组化:ER(+),PR(-),Her-2(+)。术后随访1年余,患者终因肝转移死亡。

脾转移癌系指转移到脾脏的上皮源性恶性肿瘤,原发病灶以妇科肿瘤为主,临床发病率低,尸体检出率仅为1.3%~4.5%,大部分病例被检出时常合并多器官转移。孤立性脾转移癌是脾转移癌的特殊表现形式,即恶性肿瘤仅转移至脾脏而不伴随其他器官受累,其发病率仅占脾转移癌总数的5.3%,临床上极为罕见[1,2]。孤立性脾转移癌的低发生率可能与脾动脉与腹主动脉的锐角关系、脾脏的淋巴系统发育不完善以及脾脏自身的节律性收缩、免疫清除作用、分泌血管生长因子等有关[3,4]。
既往研究对脾转移癌的转移机制存在一定争议,部分转移途径可能合并某些特殊的临床表现,笔者概括为四条途径。(1)血行转移:以动脉性转移最为常见,但此途径转移通常合并全身多系统转移,临床症状以多器官受累为主,多数病例常伴发恶病质等肿瘤晚期表现。(2)逆行转移:肿瘤细胞沿肠系膜上静脉、门静脉下行,经脾静脉逆行入脾,继发性门静脉高压、脾静脉淤血等加速脾转移癌的发生,临床上以消化系统并发症为表现的脾转移癌患者可能与此种转移途径密切相关[5]。(3)淋巴转移:部分学者通过尸检发现脾被膜或脾小梁的淋巴管内遗留癌栓,而脾实质大部却极少受累[5,6],提示淋巴转移参与早期脾转移癌的形成,而通过这一途径转移的患者一般无显著临床表现。(4)直接侵犯:这一途径主要与腹腔器官的恶性肿瘤直接侵犯、种植有关,如卵巢癌异位种植在脾门、脾被膜等处的腹膜上,而胃癌的肿瘤细胞则突破浆膜层直接侵犯脾脏,在脾脏表面生成转移灶等[7]。本例患者的术前影像学及术后病理检查仅表现为脾上极被膜及被膜下实质少量受累,与淋巴转移途径的病理表现颇为类似,因此笔者认为淋巴转移是早期脾脏孤立性脾转移癌患者最有可能的潜在转移途径。
乳腺癌是女性最常见的恶性肿瘤,肝、肺、骨等靶器官易受累。Her-2(+)乳腺癌恶性程度高,早期极易通过血行转移至肝脏[8],但本例患者入院时仅发现脾脏孤立性转移,术后随访1年后才发现肝脏转移,笔者分析其可能原因如下。(1)低分化浸润性乳腺癌的肿瘤侵袭性高,免疫逃逸及耐药性能突出,早期可能通过淋巴转移至脾脏。(2)肝脂肪变性是乳腺癌肝转移的独立保护因素[9],而乳腺癌术后接受化疗及长期内分泌治疗可引发并加重肝脂肪变性,从而进一步延缓乳腺癌肝转移进程。本例患者的临床追踪过程及长期影像学复查均提示患者长期存在脂肪肝征象,恰好与这一理论相佐证。(3)基于肝内皮基底膜的缺乏,肿瘤细胞易进入肝细胞外基质,并通过有效黏附形成微转移灶[8],而微转移灶在CT影像学上不易被发现。
从临床表现上看,由于脾脏处于膈肌与肋骨包绕的腹腔内,与周围脏器关系密切,因此孤立性脾转移癌临床表现隐匿,大多数病例的发现仅依赖于肿瘤患者复查。随着肿瘤增大,可出现上腹部肿块、左上腹痛等非特异性消化系统症状。脾肿大发生率较高,可能与某些特定恶性肿瘤有关[10]。少数病例压迫胃肠道或发生自发性破裂而出现急腹症,此时临床上需注意追踪患者既往恶性肿瘤病史,警惕脾转移癌可能[11]。本例患者无脾脏肿大及消化系统症状,影像学复查未参考恶性肿瘤史而诊断为淋巴瘤来源。科内讨论鉴于其乳腺癌史,结合术后病理检查才最终确诊为乳腺癌术后孤立性脾转移。
尽管脾转移癌以卵巢癌、黑色素瘤、消化系统肿瘤为主,但部分学者认为,以乳腺癌来源的脾转移癌患者位居所有原发恶性肿瘤的首位[12,13,14],提示临床实际工作中乳腺癌脾转移可能存在大量的误诊和漏诊,也凸显了术前检查的重要性。国内外目前对脾转移癌的诊断仍然依赖于影像学检查,但研究发现,影像检查发现孤立性脾转移癌的患者,在随后的PET-CT成像中发现并存额外的骶骨转移[15],提示影像检查可能是漏诊的潜在因素。基于本例患者并结合既往研究,笔者认为对存在恶性肿瘤病史的患者,如果在同步随访中发现脾脏占位,应高度怀疑脾转移来源;若脾转移与原发病灶同时被发现但又无法确诊时,优先考虑PET-CT检查,以鉴别脾脏原发肿瘤和转移灶。值得关注的是,超声引导下细针穿刺可用于脾脏肿瘤的术前确诊,国外学者证实其阳性率高达98.1 %,该方法术后并发症少,是一种高效安全的确诊手段[2,16,17],但考虑存在瘤体破裂出血的风险且定位技术要求较高,目前国内仍鲜有开展。
孤立性脾转移癌一经确诊,腹腔镜脾切除术是首选治疗方式。有学者对24例肺癌孤立性脾转移癌患者行腹腔镜脾切除术后的生存期进行分析,发现5年生存率可达41%[18]。对于卵巢癌、胃肠道肿瘤的孤立性脾转移癌患者,在脾切除术后的预后亦较好,无瘤生存期可达3~5年,甚至更长[19,20]。笔者总结国内外4例乳腺癌孤立性脾转移癌患者发现,此4例均在确诊后行脾切除术,但仅有1例在术后接受随访,生存期仅为1年,与本例预后相似,表明乳腺癌来源的孤立性脾转移癌的肿瘤生物学进展可能更为迅速,预后也更差。对未施行脾切除术的晚期乳腺癌脾转移患者,接受内分泌治疗后的脾转移灶与原发灶同时缩小[21],但该治疗仅限于个案报告。
综上所述,乳腺癌孤立性脾转移癌患者临床罕见,与之相关的临床治疗方案及预后尚不确切,仍有待进一步研究。
所有作者均声明不存在利益冲突



























