
于2019年12月始发于湖北省武汉市的新型冠状病毒感染迅速流行。以往资料证实,孕产妇是病毒感染的高危人群。为保证孕产妇得到最优化的管理和救治,根据最新新型冠状病毒感染国家管理方案并结合实际情况,特制订妊娠期与产褥期新型冠状病毒感染的专家建议。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019年12月始发于湖北省武汉市的新型冠状病毒感染迅速流行[1,2,3],截至2020年1月29日24时,国家卫生健康委员会(简称卫健委)收到31个省(自治区、直辖市)和新疆生产建设兵团累计报告确诊病例7 711例,现有重症病例1 370例,累计死亡病例170例,累计收到港澳台地区通报确诊25例[4]。东南亚、欧洲、北美洲等地亦发现新型冠状病毒感染病例共68例,全球瞩目。
新型冠状病毒与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)同为β-冠状病毒属,新型冠状病毒与SARS-CoV基因组之间的相似度高达85%。SARS-CoV与MERS-CoV在过去20年累计感染患者在全球多达10 000例,SARS-CoV感染病死率为10%,其中孕妇SARS-CoV感染病死率为25%,而MERS-CoV感染病死率高达37%[5,6,7,8,9]。最新报道新型冠状病毒感染病死率为11%[10]。鉴于新型冠状病毒感染传染性强,有一定致死率,2020年1月我国将此病列为乙类传染病、按甲类传染病管理[11],目前已采取有效的感染控制措施,按国际标准隔离暴露者、疑似病例,不断更新诊疗流程以及开展公共教育[12]。
孕产妇亦为新型冠状病毒的易感人群,有限资料显示孕妇更易出现并发症;孕晚期资料表明不存在母婴传播,但不同阶段感染对胎儿的影响尚不明确。基于有限的资料和其他类似病毒肺部感染的知识,经专家讨论,特制订以下专家意见,旨在指导临床处理。
参照国家卫健委诊断标准第4版[13]。
应注意主要与下列感染及非感染性疾病鉴别。
1.流感病毒、副流感病毒、腺病毒、呼吸道合胞病毒、鼻病毒、人偏肺病毒、SARS-CoV等其他已知病毒性肺炎。
2.肺炎支原体、衣原体及细菌性肺炎等。
3.非感染性疾病,如血管炎、皮肌炎和机化性肺炎等。
4.患者在感染新型冠状病毒的基础上并发的其他病毒感染。
胸部影像学检查,尤其是CT,对新型冠状病毒感染孕妇的病情评估具有重要的参考价值。
X射线与CT检查的原理基本相同,对胎儿的影响与检查时的孕周及暴露的辐射剂量相关[14]。胚胎发育早期,大剂量暴露(>1 Gy)对胚胎是致命的,但诊断性影像检查的暴露辐射剂量远低于1 Gy[15,16]。在暴露辐射剂量<50 mGy时,目前尚无造成胎儿畸形、生长受限或流产的报道[17]。在孕8~15周时受到的暴露辐射剂量对胎儿中枢神经系统的影响最大。有研究提示,造成智力障碍的最小暴露辐射阈值为60~310 mGy,但临床上有记录的此类患者最低暴露辐射剂量都在610 mGy之上[18,19,20,21]。
根据美国放射协会和美国妇产科医师学会的数据,孕妇接受单次胸部X射线检查,胎儿受到的暴露辐射剂量为0.0005~0.01 mGy,而接受胸部CT或CT肺动脉造影(0.1~10 mGy)时,胎儿受到的暴露辐射剂量为0.01~0.66 mGy[16]。CT检查中静脉碘造影剂可以通过胎盘进入胎儿循环和羊水,但动物研究表明,碘造影剂没有致畸或致突变作用[22,23]。理论上游离碘可能对胎儿甲状腺存在不良影响,但尚无人类研究证实[24]。
因此,对于疑似新型冠状病毒感染或感染急性期孕妇,可使用CT或X射线进行胸部检查。但谨慎起见,仅在可以给孕妇带来绝对影响治疗的诊断信息时,方可使用造影剂[14]。此外,建议孕妇在接受胸部CT检查前签署知情同意书并采取必要的腹部防护措施。
疑似及确诊新型冠状病毒感染病例均应在具备有效隔离及防护条件的定点医院隔离治疗。建议疑似病例应隔离治疗,确诊病例有条件时应收入负压病房,出现危重症时应立即转入重症监护病房带负压的隔离间进行加强治疗[12]。有条件收治感染孕产妇的医院建议设立专用的负压隔离手术室和新生儿隔离病房。
卧床休息,保证充足睡眠;保证充分能量摄入;维持水电解质平衡及内环境稳定。
抗病毒药物种类较多,常用药物选择值得进一步探讨。目前针对临床表现严重患者主要使用:(1)α-干扰素雾化吸入(成人每次500万U,加入灭菌注射用水2 ml,每日2次)。早孕期使用该药有阻碍胎儿生长发育的风险,应充分告知[25]。(2)洛匹那韦/利托那韦(200 mg/50 mg,每粒)每次2粒,每日2次。洛匹那韦/利托那韦已用于妊娠合并人类免疫缺陷病毒感染治疗,资料显示其无明显致畸性[26],母乳中浓度很低[27,28,29,30]。
密切监测生命体征和氧饱和度等;行动态动脉血气分析,复查胸部影像学;密切监测血常规、尿常规、生化指标(肝酶、心肌酶、肾功能等)及凝血功能。
尽快完善病原学检测,以明确诊断。若病原学检测阴性(连续2次呼吸道病原核酸检测阴性,采样时间至少间隔1 d),基本上可排除新型冠状病毒感染,转出隔离病房诊治。若病原学检测阳性,即明确诊断新型冠状病毒感染,按新型冠状病毒感染肺炎临床分型诊治。
(1)一般治疗、病情监测与疑似病例相同。是否选用抗病毒治疗应慎重考虑。(2)抗菌药物治疗:加强细菌学监测,有继发细菌感染证据时及时应用抗菌药物。无明确继发细菌感染证据时,避免盲目或不恰当使用抗菌药物。必须使用抗菌药物时,尽量选择对胎儿影响小的抗菌药物。
(1)妊娠合并重症新型冠状病毒肺炎病情发展迅速,有可能导致母胎死亡。推荐在重症监护病房隔离收治后,组成多学科团队共同管理,孕妇尽量采取侧卧位。(2)抗生素联合使用:对于可疑或已证实继发细菌感染的新型冠状病毒感染孕妇,在抗病毒治疗的同时应尽早使用抗菌药物治疗。合理选择有效的抗生素,根据药敏结果调整抗生素[31]。伴有局部脓肿时,需同时充分引流[32]。(3)血压维持与液体管理:无休克的危重症患者应采取保守的液体管理措施[33];出现脓毒症休克时,行容量复苏、去甲肾上腺素维持平均动脉压≥60 mmHg(1 mmHg=0.133 kPa),维持体内乳酸<2 mmol/L[32]。(4)保障供氧:使孕产妇血氧饱和度≥0.95[34,35],合并低氧血症或休克患者立即给予氧疗[36],供氧方式可依据患者情况,选择面罩、高流量鼻导管氧疗或无创通气、有创机械通气等方式[37,38,39]。近年来,临床上有指征地采用体外膜肺氧合可降低肺部感染患者的病死率[40,41,42],但孕期使用应注意防治相关并发症[35]。(5)维持内环境稳定:出现水电解质和酸碱平衡严重紊乱以及严重脓毒症时可采取持续肾脏替代疗法。(6)床旁超声监护:超声可以监测胎儿情况,同时可用来评估危重患者心肺肾功能状况以及指导患者的容量复苏。
疑似感染孕妇应单独隔离;确诊新型冠状病毒感染的孕妇,有条件的医疗机构应即刻收入负压隔离病房或者单独隔离,由多学科团队管理。所有医护人员在进入隔离病房前要穿戴防护服、N95口罩、护目镜和手套[43]。
目前尚无足够数据确定孕妇新型冠状病毒感染对胎儿的影响。以往孕妇罹患病毒性肺炎的资料显示,早产、胎儿生长受限及围产儿病死率增加[44]。与没有肺炎的孕妇相比,患有肺炎的孕妇发生低出生体重儿、早产、胎儿生长受限和新生儿5 min Apgar评分<7分的风险均增加[45]。2003年我国香港报道了10例严重急性呼吸综合征(severe acute respiratory syndrome, SARS)孕妇,其中4例流产[46],值得重视。
对于有可能感染新型冠状病毒的孕妇,建议根据孕周使用电子胎心监护、超声检查评估胎儿情况。目前,尚不确定新型冠状病毒感染孕妇是否存在母胎垂直传播。
新型冠状病毒感染不是终止妊娠的指征,终止妊娠时机宜个体化。终止妊娠的指征取决于孕妇的疾病状况、孕周及胎儿情况。在保障孕产妇安全的前提下,应结合孕周考虑。有终止妊娠指征时,在治疗的同时可考虑积极终止妊娠。终止妊娠前如需促胎肺成熟,推荐使用地塞米松或倍他米松。
有条件时建议尽量在负压隔离病房分娩。分娩方式选择依据产科指征,阴道分娩或剖宫产何种方式更安全尚无定论。区域性硬膜外麻醉或全麻均可用于新型冠状病毒感染孕妇的分娩麻醉,对于已行气管插管的新型冠状病毒感染孕妇,可采取气管插管全麻剖宫产[39]。
新型冠状病毒感染孕妇的流产胚胎/胎儿及胎盘,应按传染性疾病污物处理;当需要行胎盘组织样本检测时,按相关规定进行。
新型冠状病毒感染产妇分娩的新生儿应尽早断脐、尽早清洁,同时进行新型冠状病毒感染的评估,转入隔离病房。既往SARS孕妇的有限资料显示,母胎垂直传播概率小[46,47]。虽迄今为止尚未发现新生儿感染新型冠状病毒的病例,但病毒感染患者存在母胎垂直传播可能,故疑似或确诊新型冠状病毒感染孕妇的新生儿,生后需隔离14 d,并密切观察有无新型冠状病毒感染的临床表现。产妇与新生儿分开隔离,不可同处一室。
目前,尚不确定母乳中是否有新型冠状病毒病毒,因此对于疑似或已确诊新型冠状病毒感染孕妇的新生儿,暂不推荐母乳喂养。但建议定期挤出乳汁,保证泌乳,直至排除或治愈新型冠状病毒感染后方可母乳喂养。
新型冠状病毒感染者常伴发热。既往资料显示,早孕期发热可以导致胎儿神经管、心脏、肾脏等器官的结构畸形[48,49,50,51]。最近有研究对80 321例孕产妇资料进行分析,发现早孕期发热的比例为10.8%,胎儿畸形发生率为3.7%;该研究对资料完整的77 344例单胎活产婴儿随访16~29周,其中早孕期体温>38 ℃、持续时间1~4 d的8 321例孕妇,与早孕期未发热者相比,新生儿总体畸形风险并没有增加(OR=0.99,95%CI:0.88~1.12),但新生儿眼、耳、面部、颈部畸形以及生殖道畸形的发生风险(OR)分别为1.17(95%CI:0.79~1.12)和1.29(95%CI:0.78~2.12),神经系统、呼吸系统、泌尿系统畸形发生风险(OR)分别为0.47(95%CI:0.21~1.08)、0.56(95%CI:0.23~1.29)和0.58(95%CI:0.35~0.99)[52]。孕期感染性发热增加婴幼儿多动症的发生风险[53],中孕期感染性发热患者婴幼儿自闭症发生率升高2倍[54]。新型冠状病毒为新发现的病毒,孕期感染发热是否导致婴幼儿远期影响值得进一步探讨。
根据新型冠状病毒感染患者具体情况,其治疗方案建议酌情短期(3~5 d)使用甲泼尼龙1~2 mg/(kg·d)[13]。甲泼尼龙孕期使用可被胎盘的11β-羟基类固醇脱氢酶灭活,仅少量(10%)进入胎儿。
新型冠状病毒感染孕妇使用糖皮质激素对胎儿的影响值得进一步探讨。2003年我国香港报道的10例SARS孕妇中,有2例使用高剂量糖皮质激素合并耐甲氧西林金黄色葡萄球菌败血症的孕妇死亡[46]。另一项来自我国香港的研究表明,5例中晚孕期SARS孕妇接受了利巴韦林及糖皮质激素治疗,分娩的新生儿均未表现出先天异常,其中3例孕妇在出现呼吸道症状后立即终止妊娠,分娩新生儿的出生体重与孕周相符;另2例感染后未终止妊娠,出现羊水过少及严重的胎儿生长受限[47]。
孕妇发生焦虑和抑郁风险增加,一旦确诊或疑似新型冠状病毒感染,可能会出现不同程度的精神症状,不利于母胎健康[55]。应及时评估包括焦虑、抑郁、睡眠状况、自杀意念及忧虑来源,并及时请精神科医生进行心理干预。
孕产妇为病毒感染的高危人群,目前尚无效果确切的药物以及疫苗可用于预防新型冠状病毒感染,必须做好个人防护工作[11,56]。
1.妊娠期间始终保持良好的个人卫生习惯:孕产妇是病毒感染的高危人群,疾病流行期间自觉避免与他人近距离接触,减少参加大型活动、各种集会及聚餐等,注意勤洗手、戴口罩。有发热、咳嗽等不适时及时就诊。
2.积极了解相关知识:参加妊娠期间的各种形式(如网络教育课程)的宣传教育课程,了解病毒感染相关知识。
3.有疑似症状者及时就医,按症处置。
孕妇疑似新型冠状病毒感染的就诊流程见图1。
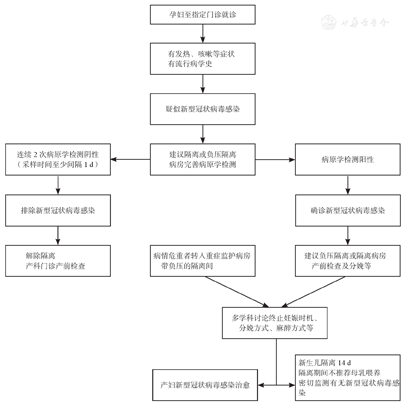

1.新型冠状病毒感染孕产妇,应根据医疗行政管理部门规定集中收治,并告知其不良妊娠结局的风险。
2.在新型冠状病毒感染流行期间,对所有就诊孕妇,应询问是否有流行病学史,并重点筛查新型冠状病毒感染的临床表现。
3.胸部影像学检查,尤其是CT,对新型冠状病毒感染孕妇的病情评估具有重要的参考价值。
4.发现疑似或确诊新型冠状病毒感染的孕产妇,应按传染病疫情上报,并按要求收入隔离病房,有条件者收入负压隔离病房。
5.新型冠状病毒感染孕妇的产前检查和分娩,尽量在负压隔离或隔离病房进行,参与诊治及管理的医护人员须按要求进行防护。
6.分娩时机宜个体化,应综合考虑母儿情况、孕周及分娩条件等具体情况;分娩方式依据产科指征。
7.新型冠状病毒感染孕妇需手术分娩时,麻醉方式可以选择区域性麻醉或全麻,具体麻醉方式依据具体情况选择。
8.目前证据未提示有母胎垂直传播,但感染孕产妇的新生儿应隔离至少14 d,在此期间不推荐直接母乳喂养。建议母亲定期挤出乳汁,保证泌乳,直到排除或治愈新型冠状病毒感染后方可母乳喂养。应由多学科团队联合管理新型冠状病毒感染孕产妇及其分娩的新生儿。
9.推荐产科、新生儿科等相关专业专人管理新型冠状病毒感染孕产妇及新生儿,防止交叉感染。医护人员必须每天监测有无发热、咳嗽等临床表现,若出现新型冠状病毒感染应立即隔离治疗。
10.从事产科相关工作的人员应接受新型冠状病毒感染防控的培训。
执笔专家:
陈敦金(广州医科大学附属第三医院妇产科),杨慧霞(北京大学第一医院妇产科)
参与讨论专家(按姓氏拼音排序):
曹云(复旦大学附属儿科医院新生儿科),陈敦金(广州医科大学附属第三医院妇产科),程蔚蔚(上海交通大学医学院附属国际和平妇幼保健院产科),崔世红(郑州大学第三附属医院妇产科),丁国芳(中国医学科学院北京协和医院儿科),段涛(上海第一妇婴保健院妇产科),范翠芳(武汉大学人民医院妇产科),樊尚荣(北京大学深圳医院妇产科),冯玲(华中科技大学同济医学院附属同济医院围产医学科),封志纯(解放军总医院第七医学中心八一儿童医院新生儿科),高元妹(广州医科大学附属第三医院重症医学科),贺芳(广州医科大学附属第三医院妇产科),贺晶(浙江大学医学院附属妇产科医院产科),胡娅莉(南京大学医学院附属鼓楼医院妇产科),姜毅(北京大学第一医院儿科),孔祥永(解放军总医院第七医学中心八一儿童医院新生儿科),黎毅敏(广州医科大学附属第一医院重症医学科),李家福(武汉大学中南医院妇产科),李笑天(复旦大学附属妇产科医院产科),李雪兰(西安交通大学第一附属医院妇产科),李占魁(西北妇女儿童医院新生儿科),蔺莉(北京大学国际医院妇产科),林康广(广州医科大学附属脑科医院情感障碍科),刘彩霞(中国医科大学附属盛京医院妇产科),刘俊涛(中国医学科学院北京协和医院妇产科),刘兴会(四川大学华西第二医院妇产科),潘兴飞(广州医科大学附属第三医院感染疾病科),庞秋梅(首都医科大学附属北京佑安医院妇产科),朴梅花(北京大学第三医院儿科),漆洪波(重庆医科大学附属第一医院妇产科),时春艳(北京大学第一医院妇产科),施丽萍(浙江大学医学院附属儿童医院新生儿重症监护病房),孙瑜(北京大学第一医院妇产科),孙敬霞(哈尔滨医科大学附属第一医院妇产科),王谢桐(山东大学附属省立医院妇产科山东省妇幼保健院妇产科),王懿春(广州医科大学附属第三医院重症医学科),王子莲(中山大学附属第一医院妇产科),王志坚(南方医科大学南方医院妇产科),辛虹(河北医科大学第二医院妇产科),徐先明(上海交通大学附属第一人民医院妇产科),颜建英(福建省妇幼保健院产科),杨传忠(南方医科大学附属深圳妇幼保健院新生儿科),杨慧霞(北京大学第一医院妇产科),阴怀清(山西医科大学第一医院儿科),赵扬玉(北京大学第三医院妇产科),郑军(天津市中心妇产科医院新生儿科),周乙华(南京大学医学院附属鼓楼医院感染疾病科),邹丽(华中科技大学同济医学院附属协和医院妇产科)


























