新型冠状病毒能否通过宫内垂直传播感染胎儿是关注的焦点,而如何正确评价新型冠状病毒是否存在宫内垂直传播,更是问题的关键所在。病毒学和血清学证据对诊断病毒宫内垂直传播都有价值。单纯将血清学结果用于确定新型冠状病毒宫内传播时,应至少对新生儿随访3~6个月,动态观察IgM和IgG滴度变化,同时随访其母亲,与母亲特异性抗体的滴度进行比较。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒能否通过宫内垂直传播感染胎儿是关注的焦点。较早发表的有关新型冠状病毒宫内垂直传播的研究均通过在分娩即刻和无菌环境中留取胎盘组织、羊水、脐血及新生儿鼻咽拭子进行新型冠状病毒核酸检测,结果均未发现该病毒引起宫内感染的证据[1,2,3]。但这些研究的孕妇病情多为轻型,且均处于妊娠晚期。所以,妊娠早、中期发病,或孕晚期重型新型冠状病毒肺炎(COVID-19)患者是否发生新型冠状病毒宫内传播,尚不明确[4]。
近期发表的2篇病例报道从新生儿血清中新型冠状病毒特异性抗体角度探讨了新型冠状病毒宫内垂直传播的可能性。这2项研究共检测了7例COVID-19孕妇分娩的新生儿,其鼻咽拭子新型冠状病毒核酸均阴性,但其中3例新生儿血清新型冠状病毒特异性IgM阳性。然而在3例新生儿中,2例仅在出生时进行了单次新型冠状病毒特异性IgM和IgG检测,1例分别于出生后2 d和16 d进行了新型冠状病毒特异性IgM和IgG检测。2项研究根据母源性IgM不能通过胎盘这一原理,推测新生儿特异性IgM为新生儿主动产生,并据此认为新型冠状病毒可能存在宫内垂直传播[5,6]。然而,国外专家对这2篇报道的评论提出,需要谨慎解释其结果,前述结果有可能存在错误;且不能仅根据前述结果认为新型冠状病毒存在宫内垂直传播,最终结论的获得还需要更多证据明确[7]。
现从机体对病原体的抗体应答规律、孕期血清学筛查的应用和结果判读,以及现有关于血清学评价新型冠状病毒宫内垂直传播的证据等3个方面阐述如何根据特异性IgM和IgG评价新型冠状病毒宫内垂直传播。
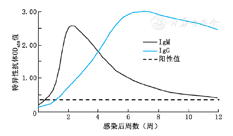
特异性IgM和IgG是机体对病原体引发的特异性体液免疫应答而产生的抗体。特异性IgM在感染后最早产生,感染后3~10 d即可在血液中检测到,并于2~3周达到高峰后下降,多数在感染后2~3个月消失,极少数可持续6个月、甚至1年。因此可将特异性IgM用于早期诊断。特异性IgG通常不是IgM消失后才产生的,而是在特异性IgM产生后1周内即可检测到,然后逐渐升高,并于6~8周达到高峰;病原体清除后,IgG抗体滴度可有所下降,但可持续数年至数十年,甚至终身(图1)[8]。因此单纯检测特异性IgG不能确定现症感染。特异性IgM检测是诊断急性感染的重要手段,但IgM是以五聚体形式存在的,检测时容易出现假阳性,因此需要动态检测,并同时结合IgG抗体滴度的动态变化,才能提高其诊断的准确性[8]。
围产期感染,尤其是病毒感染,是围产儿致残及致死的重要原因。围产期常见的导致胎儿感染的病原微生物包括弓形虫(Toxoplasma gondii)、风疹病毒(Rubella virus)、巨细胞病毒(Cytomegalovirus, CMV)和单纯疱疹病毒(Herpes simplex virus, HSV)及其他病原微生物(Others),统称为TORCH。围产期TORCH感染的筛查主要是通过检测孕妇血清中一些与病原体相关的特异性抗体,以了解孕妇是否存在感染[9]。对于孕妇TORCH特异性抗体检测结果的判读见表1[8]。
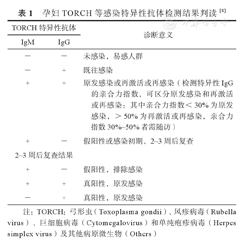
孕妇TORCH等感染特异性抗体检测结果判读[8]
孕妇TORCH等感染特异性抗体检测结果判读[8]
| TORCH特异性抗体 | 诊断意义 | |
|---|---|---|
| IgM | IgG | |
| - | - | 未感染,易感人群 |
| - | + | 既往感染 |
| + | + | 原发感染或再激活或再感染(检测特异性IgG的亲合力指数,可区分原发感染和再激活或再感染:其中亲合力指数<30%为原发感染,>50%为再激活或再感染,亲合力指数30%~50%者需随访) |
| + | - | 假阳性或感染初期,2~3周后复查 |
| 2~3周后复查结果 | ||
| + | - | 假阳性,排除感染 |
| + | + | 真阳性,原发感染 |
| - | + | 真阳性,原发感染 |
注:TORCH:弓形虫(Toxoplasma gondii)、风疹病毒(Rubella virus)、巨细胞病毒(Cytomegalovirus)和单纯疱疹病毒(Herpes simplex virus)及其他病原微生物(Others)
目前仅有2项研究根据血清学评价新型冠状病毒宫内垂直传播,并根据3例新生儿血清中新型冠状病毒抗体IgM阳性即认为新型冠状病毒可能存在宫内垂直传播。然而,这2项研究均存在一些值得探讨的问题,不能依此得出宫内垂直传播的结论。
首先,由于疫情突发,时间紧迫,新型冠状病毒特异性抗体检测试剂的特异性和敏感性尚未得到充分评估[7],检测方法可能有待进一步优化。在这种情况下,根据特异性IgM是否阳性诊断宫内感染尤其需要慎重。特别是仅根据新生儿出生时单次IgM检测阳性,不能确诊宫内感染。先天感染中IgM检测存在固有的假阳性,国外专家学者倾向于认为近期发表的2篇关于COVID-19母亲的新生儿IgM阳性可能不是真正宫内感染的证据,而可能是实验误差[7]。
其次,2项研究中的1项检测了6例新生儿,其中2例新生儿出生时血清中IgG和IgM阳性,仅检测了1次,未进行动态观察[5];另1项研究报道的1例新生儿,IgM滴度出生2 h时为45.83 AU/ml(正常<10 AU/ml),14 d后降为11.75 AU/ml;IgG滴度出生2 h为140.32 AU/ml(正常<10 AU/ml),14 d后降为69.94 AU/ml[6]。该新生儿IgG滴度在2周内下降幅度达50%。由于IgM产生后1周左右就产生特异性IgG,且IgG抗体的半衰期为21~24 d,如果存在宫内感染,新生儿自身就能产生特异性IgG抗体,那么在母体来源的IgG自然衰减的同时,新生儿自身产生的IgG抗体不可能在2周内下降50%。因此,该新生儿体内IgG滴度的快速下降,完全与从母体获得的IgG抗体的自然衰减一致,说明该特异性IgG来自于母亲,而并不是新生儿自身主动产生的,因此提示可能不存在宫内感染。近期研究提示,新型冠状病毒感染为急性感染,特异性抗体IgM产生中位时间为5 d,IgG为14 d[10]。该新生儿出生时IgM即为阳性,且处于较高水平,因此也不存在该新生儿刚产生IgM、还没有产生IgG抗体这种感染处于非常早期的情况。综上分析,也正如国外专家在述评性文章中所指出的,该新生儿的特异性IgM很可能是假阳性[7]。
病毒学和血清学证据对诊断病毒宫内垂直传播都有价值。单纯将血清学结果用于确定宫内传播时,务必对新生儿随访至少3~6个月,动态观察IgM和IgG滴度的变化,同时随访其母亲,与母亲的抗体滴度进行比较。例如,对于出生后咽拭子新型冠状病毒核酸检测阴性,但血清新型冠状病毒特异性IgM和IgG均阳性的新生儿需进行随访。如新生儿在生后6个月内IgG抗体转阴,则可证实新生儿未发生新型冠状病毒宫内感染;但若6月龄IgG抗体仍阳性,需要继续随访,如果转为阴性,排除宫内感染;如果到18月龄持续阳性,且排除产后及婴儿期感染,则可确定其新型冠状病毒感染为宫内垂直传播引起。