
探讨胎儿神经学超声(neurosonogram,NSG)检查发现胎儿大脑外侧裂形态异常对于产前诊断胎儿脑皮质发育畸形(malformation of cortical development,MCD)的意义。
回顾性收集2016年1月至2021年12月在北京大学第一医院行NSG检查发现大脑外侧裂形态异常胎儿的基本资料,以及超声检查、遗传学检查、MRI检查等资料。将其中明确的致病基因联合脑结构异常定义为胎儿MCD。采用描述性分析产前超声发现胎儿大脑外侧裂形态异常与MCD的关系。
研究共纳入13例胎儿遗传学信息完整(发现致病性拷贝数变异或未发现致病性拷贝数变异并进一步行全外显子组测序),其中12例最终诊断为MCD。12例MCD胎儿中,7例为致病性拷贝数变异,5例为致病性基因点突变,涉及6个致病基因及4个遗传综合征;10例产前超声发现双侧大脑外侧裂形态异常且对称,其中6例外侧裂宽大表浅、4例异常成角,另2例双侧形态异常,且形态不对称,均为一侧宽大表浅,另一侧异常成角。12例MCD胎儿产前超声与MRI检查对于胎儿MCD的各种异常征象显示基本一致。
胎儿NSG检查发现胎儿大脑外侧裂形态异常对于MCD具有重要的诊断意义。建议对超声发现大脑外侧裂形态异常的胎儿行遗传学检查,以染色体微阵列分析联合全外显子组测序为宜。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑皮质发育畸形(malformation of cortical development,MCD)是指在脑皮质发育过程中出现异常的一类疾病的总称。MCD会导致智力障碍、孤独症和脑性瘫痪等疾病,也是癫痫、尤其是药物难治性癫痫的重要病因[1]。MCD严重影响患者生命质量,故产前诊断MCD具有重大意义。明确诊断MCD应基于神经病理学检查,但在临床实践过程中,获取大脑病理标本进行诊断比较困难,因此MCD的诊断通常基于神经影像学表现、临床症状以及遗传学检查综合判断[2]。目前,产前诊断MCD仍存在巨大的挑战和困难,其中一个重要原因就是胎儿并无明显的临床表现,只能依靠影像学表现和遗传学检查结果进行诊断。但如果胎儿既没有影像学异常,也没有高危因素,就不可能接受产前基因诊断。尤其很多MCD的致病基因多为基因点突变,通常需要全外显子组测序(whole exon sequencing,WES)才能检出。2018年国际产前诊断学会[3]及2020年美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)[4]制定的WES应用规范明确指出,只有在高度怀疑胎儿畸形的情况下才能进行WES。因此寻找相对明确的产前影像学标志对于MCD产前诊断至关重要。
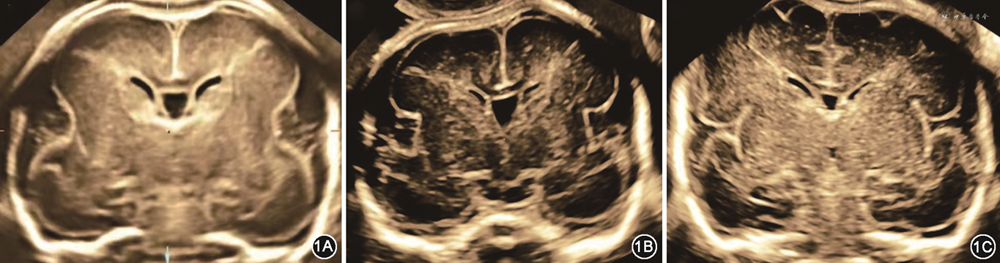
大脑外侧裂是脑皮质发育的一个重要标志,其形态在整个孕期会随着脑皮质发育而改变,是脑皮质发育的里程碑式的标志。根据文献报道[5]及临床观察,孕18周左右冠状切面上大脑外侧裂呈浅弧形;随着孕周进展,弧形逐渐向内加深;孕25周左右呈方形,孕30周左右时呈“π”形;足月时大脑外侧裂逐步完全闭合(图1)。Pooh等[6]在2019年回顾了22例通过尸检、产前MRI或死胎MRI检查证实为MCD胎儿的产前超声表现,提出大脑外侧裂角度较相应孕周的正常胎儿增加是MCD的超声征象。也有研究认为,胎儿大脑外侧裂形态异常是MCD重要的产前影像学征象[7]。目前国内缺乏胎儿大脑外侧裂形态异常与MCD的相关研究。当产前发现胎儿大脑外侧裂形态异常时,胎儿是否有明确的基因异常,是否可以明确诊断MCD,是目前临床亟待解决的问题。本研究收集了本院产前超声发现大脑外侧裂形态异常的胎儿的影像学资料及基因检测结果,拟分析大脑外侧裂异常与MCD的关系,以进一步指导临床实践。

本研究为回顾性研究。收集2016年1月至2021年12月外院转诊至北京大学第一医院或在本院常规产前超声检查发现大脑外侧裂形态异常胎儿的病例。本研究经北京大学第一医院伦理委员会审核批准[(2022)科研第(118)号]。
产前超声发现胎儿大脑外侧裂形态异常时,建议孕妇进行遗传学检查和感染性疾病检查,以及胎儿神经系统MRI检查。当遗传学检查发现致病性或可疑致病性变异时,结合胎儿大脑外侧裂形态异常,临床诊断为MCD;对于接受胎儿MRI检查的病例,将胎儿超声与MRI检查结果比较,进一步证实MCD的诊断。此处MCD的诊断标准参照儿科临床常规,基于神经影像学表现、临床症状以及遗传学检查综合判断。但由于胎儿无明确的临床表现,所以产前诊断MCD只能依据神经影像学表现及致病基因诊断。
1.产前超声检查:产前超声检查应用Voluson E8 或Voluson E10型彩色多普勒超声诊断仪(美国GE公司)。经腹部超声检查采用频率3~5 MHz以及1~7 MHz的凸阵探头;若胎儿为头位,且孕妇无胎膜早破、出血、先兆早产以及先兆流产等高危因素,则采用5~9 MHz和6~12 MHz的腔内探头经阴道进行胎儿神经学超声(neurosonogram,NSG)检查。
本院产前超声常规在胎儿轴切面观察大脑外侧裂,若怀疑胎儿大脑外侧裂异常或其他任何神经系统异常,则参照国际妇产超声学会(International Society of Ultrasound in Obstetrics and Gynecology,ISUOG)发布的指南[8],对胎儿进行多个矢状切面及冠状切面的NSG检查。在经丘脑冠状平面观察胎儿双侧大脑外侧裂形态,将NSG检查发现胎儿大脑外侧裂形态异常(指当胎儿与同孕周正常胎儿大脑外侧裂的形态不同,出现表浅、宽大或异常成角[5])进行报告。
同时对胎儿进行细致的全身超声检查,进行胎儿生物学测量,并仔细检查胎儿有无大脑外侧裂形态异常以外的结构畸形。
2.遗传学检查:包括染色体核型分析、染色体微阵列分析(chromosomal microarray analysis,CMA)及WES。参照2020年ACMG指南[4],并对比在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,https://omim.org)及人类染色体不平衡和表型数据库(Database of Chromosomal Imbalance and Phenotype in Humans Using Ensemble Resources,DECIPHER,https://www.deciphergenomics.org)等数据库,对基因变异的致病性进行评估。
本研究将CMA发现MCD相关致病性拷贝数变异(copy number variation,CNV),以及CMA未发现致病性CNV并进一步行WES的病例定义为遗传学信息完整的病例。
3.资料收集:查询本院超声工作站及病历系统,收集孕妇的基本资料并追踪其妊娠结局,并根据超声检查及遗传学检查结果,分析产前超声发现胎儿大脑外侧裂形态异常与遗传学明确诊断的胎儿MCD的关系。
所有数据录入Excel,采用描述性统计分析。计数资料采用频数及率表示,计量资料采用±s表示。
研究期间,共纳入13例产前超声发现胎儿大脑外侧裂异常且遗传学信息完整的病例。11例为外院转诊,转诊原因包括:胎儿侧脑室增宽(5例)、羊水过多(3例)、胎头小(2例)、疑诊胼胝体缺如(1例);另2例为本院常规产前检查孕妇,1例为常规产前超声轴切面检查怀疑大脑外侧裂异常,进一步行NSG检查发现;1例为孕11周时胎儿颈项透明层增厚,于21周行NSG检查发现。
13例孕妇年龄为(30.8±2.3)岁(24~37岁),产前超声发现大脑外侧裂异常孕周为(27.9±3.0)周(21~33周),均为单胎,均终止妊娠。
13例中,7例经CMA发现与MCD相关致病性CNV(表1);6例未检测到致病性CNV,进一步行WES,其中5例有MCD相关致病性或可疑致病性的基因变异(表2),1例未发现致病性或可疑致病性的基因结果。

7例染色体微阵列分析发现致病性拷贝数变异胎儿的超声表现及遗传学检查结果
7例染色体微阵列分析发现致病性拷贝数变异胎儿的超声表现及遗传学检查结果
| 病例序号 | 产前超声 | 胎儿神经系统MRI | |||
|---|---|---|---|---|---|
| 孕周(周) | 双侧大脑外侧裂形态 及对称性 | 颅内结构异常 | 颅外结构异常 | ||
| 1 | 28+3 | 双侧大脑外侧裂不对称,左侧 整体形态呈锐角改变,右侧 上半部分宽大表浅 | 双侧扣带沟及中央沟发育落后于孕周; 双侧侧脑室增宽 | 无 | 双侧侧脑室轻度增宽,双侧大脑半球脑沟较浅、 多见微小脑回,双侧神经节凸起部位稍厚 |
| 2 | 29 | 双侧大脑外侧裂对称,宽大表浅 | 左侧侧脑室形态不规则,局部成角;胼胝体 发育不良 | 无 | 双侧大脑外侧裂表浅,左侧脑室体前部局限性 外凸,脑白质内灰质异位,胼胝体发育不良 |
| 3 | 26+1 | 双侧大脑外侧裂对称,宽大表浅 | 双侧侧脑室增宽;顶枕沟及距状沟发育 落后于相应孕周;胼胝体发育不良;双侧 神经节凸起部位腔化;Blake's囊肿 | 无 | 大脑内侧面脑沟、中央沟均不明显,额角周围 脑室旁白质见带状分层,神经节凸起部位腔 化;双侧侧脑室增宽,小脑蚓部发育不良 |
| 4 | 27+6 | 双侧大脑外侧裂对称,整体形态 呈锐角改变 | 顶枕沟发育落后于相应孕周 | 无 | 脑沟、脑裂发育均较表浅 |
| 5 | 33+1 | 双侧大脑外侧裂对称,宽大表浅 | 顶枕沟、距状沟及扣带沟发育落后,右侧 侧脑室增宽,头围<2个标准差 | 无 | 双侧大脑外侧裂浅、双侧大脑半球表面无脑沟回、 表面光滑;双侧大脑半球呈“8” 字征、脑实质 分层异常,可见带状T2信号,右侧侧脑室增宽 |
| 6 | 31 | 双侧大脑外侧裂对称,扁平、 狭窄,形态不规则 | 脑表面平滑,各脑沟回均不明显,双侧侧 脑室增宽 | 无 | 未行 |
| 7 | 29+4 | 双侧大脑外侧裂对称,形态不 规则,上半部分呈宽大表浅 的钝角 | 胼胝体发育不良,小脑发育不良,双侧侧 脑室增宽 | FGR | 双侧侧脑室增宽,双侧外侧裂形态不规则,小脑 发育不良 |
| 病例序号 | 染色体 | 位置 | 坐标(hg19) | 变异大小(Mb) | 变异类型 | OMIM收录基因 |
|---|---|---|---|---|---|---|
| 1 | 5号 | q35.2q35.3 | 175,576,602-177,422,760 | 1.5 | 缺失 | 包含NSD1、RAB24、PRELID1、MXD3、RGS14 等20余个基因(5q35微缺失 综合征) |
| 2 | 2号 | p25.3p23.1 | 17,019-31,664,339 | 31.6 | 重复 | 包含ACP1、TMEM18、TPO、PXDN、MYT1L等100余个基因 |
| 9号 | p24.3p23 | 216,640-13,276,052 | 13.1 | 缺失 | 包含DOCK8、KANK1、DMRT1、DMRT3、DMRT2等基因 | |
| 3 | 1号 | q43-q44 | 240,210,001-249,210,000 | 9.0 | 缺失 | 包含AKT3、FH、ZBTB18等9个基因,与1q43q44 terminal region 完全重叠 (1q43q44综合征) |
| 4号 | p16.3p15.1 | 11,323,732-28,223,731 | 31.8 | 重复 | 包含ADD1、ADRA2C、CC2D2A等35个基因,与4p16.3 terminal region完全 重叠 | |
| 4 | 17号 | p13.3 | 2,286,311-2,494,902 | 0.2 | 缺失 | 包含关键基因的5'端:PAFAH1B1 (Miller-Dieker综合征) |
| 5 | 17号 | p13.3-p13.2 | 87,009-2,096,909 | 3.3 | 缺失 | 包含PAFAH1B1、CLUH、OR1D2、ASPA、TRPV3 等40余个基因(Miller- Dieker综合征) |
| 6 | 17号 | p13.3 | 1,537,730-2,537,850 | 1.0 | 缺失 | 包含RILP、PRPF8、MIR22、SERPINF2、PAFAH1B1等10余个基因 (Miller-Dieker综合征) |
| 7 | 6号 | q27 | 168,508,297-170,914,297 | 2.4 | 缺失 | 包含 EMARD 和DLL1 等12个基因(6q27综合征) |
注:FGR:胎儿生长受限(fetal growth restriction);OMIM:在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man)
5例经全外显子组测序发现致病性或可疑致病性基因变异胎儿的影像学表现及遗传学检查结果
5例经全外显子组测序发现致病性或可疑致病性基因变异胎儿的影像学表现及遗传学检查结果
| 病例序号 | 产前超声 | 胎儿神经系统MRI | |||
|---|---|---|---|---|---|
| 孕周(周) | 大脑外侧裂形态及对称性 | 其他颅内结构异常 | 颅外结构 异常 | ||
| 8 | 29+4 | 双侧大脑外侧裂对称,宽大 表浅 | 侧脑室形态不规则;双侧神经节隆起部位增厚 | 轴后多指 | 双侧大脑外侧裂形态异常,大脑半球 多发异常脑沟,双侧神经节凸起 部位增厚 |
| 9 | 29 | 双侧大脑外侧裂不对称,右侧 较相应孕周表浅宽大,左侧 整体形态呈锐角改变 | 双侧侧脑室增宽,右侧侧脑室壁呈波浪状;第三 脑室增宽;顶枕沟及距状沟发育较相应孕周 落后;Blake's囊肿;双侧小脑半球发育不对称, 小脑蚓部上旋 | 无 | 外侧裂形态异常,双侧侧脑室增 宽、形态异常,Blake's囊肿;双侧 小脑半球发育不对称 |
| 10 | 21+2 | 双侧大脑外侧裂对称,宽大 表浅 | 无 | 小下颌 | 未行 |
| 11 | 28+4 | 双侧大脑外侧裂对称,整体 形态呈锐角改变 | 头围<2个标准差 | 无 | 外侧裂表浅,大脑沟回少 |
| 12 | 25+4 | 双侧大脑外侧裂对称,整体 形态呈锐角改变 | 右侧侧脑室增宽,Dandy-Walker畸形 | 无 | 外侧裂形态异常,Joubert综合征 |
| 病例序号 | 变异基因 | 变异位点 | 氨基酸变化 | 合子状态 | 转录本 | 位置 | 来源 | 遗传方式 |
|---|---|---|---|---|---|---|---|---|
| 8 | CCND2 | c.841C>T | p.P281S | 杂合 | NM_001759.3 | chr12:4409146 | 新发变异 | AD |
| 9 | TUBB3 | c.5G>A | p.R2K | 杂合 | NM_006086.4 | chr16:8998814 | 新发变异 | AD |
| 10 | NIPBL | c.7330del | p.E2444Kfs*6 | 杂合 | NM_133433.3 | chr5:37057251 | 新发变异 | AD |
| 11 | ASPM | c.4195dup | p.T1399Nfs*20 | 纯合 | NM_018136.4 | chr1:197074186 | 父母杂合携带 | AR |
| CRB1 | c.2815T>G | p.C939G | 纯合 | NM_201253.2 | chr1:197398717 | 父母杂合携带 | AR | |
| 12 | TCTN1 | c.186delC | p.S63Pfs*67 | 杂合 | NM_001082538.2 | chr12:111052171 | 母源 | AR |
| TCTN1 | c.-44A>C | - | 杂合 | NM_001082538.2 | chr12:111051944 | 父源 | AR |
注:“-”:该变异在起始密码子之前5'非翻译区内,无法预估蛋白表达;AD:常染色体显性遗传(autosomal dominant inheritance);AR:常染色体隐性遗传(autosomal recessive inheritance);chr:染色体(chromosome)
1.超声检查:12例因致病性或可疑致病性基因结果最终诊断为MCD胎儿中,10例双侧大脑外侧裂形态异常且对称,其中6例外侧裂宽大表浅、4例异常成角,另2例双侧形态异常,且形态不对称,均为一侧宽大表浅,另一侧异常成角。大脑外侧裂形态异常胎儿典型NSG检查图像见图2~4。
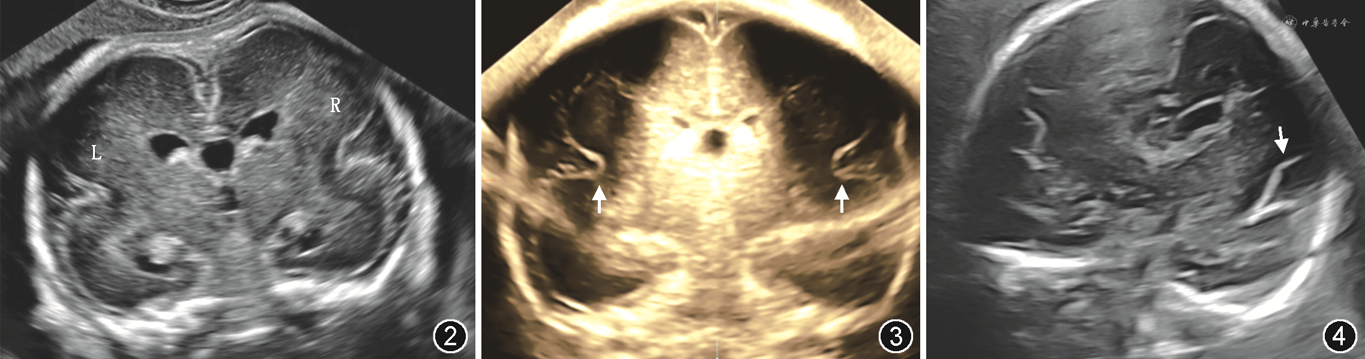

注:L:左侧;R:右侧;NGS:神经学超声(neurosonogram)
12例胎儿均合并其他结构异常。其中,11例除大脑外侧裂形态异常外合并其他颅内结构异常,3例合并颅外结构异常。颅内结构异常最常见的是侧脑室增宽(7例),其次为脑沟回发育落后于相应孕周(5例)、侧脑室形态不规则或脑室壁异常(3例)及胼胝体发育不良(3例)。颅外结构异常呈散发分布,小下颌畸形、轴后多指及胎儿生长受限各1例。而12例中,7例合并侧脑室增宽,另5例未合并侧脑室增宽的胎儿中有1例仅表现为大脑外侧裂形态异常及脑沟回发育落后,未合并其他结构异常。
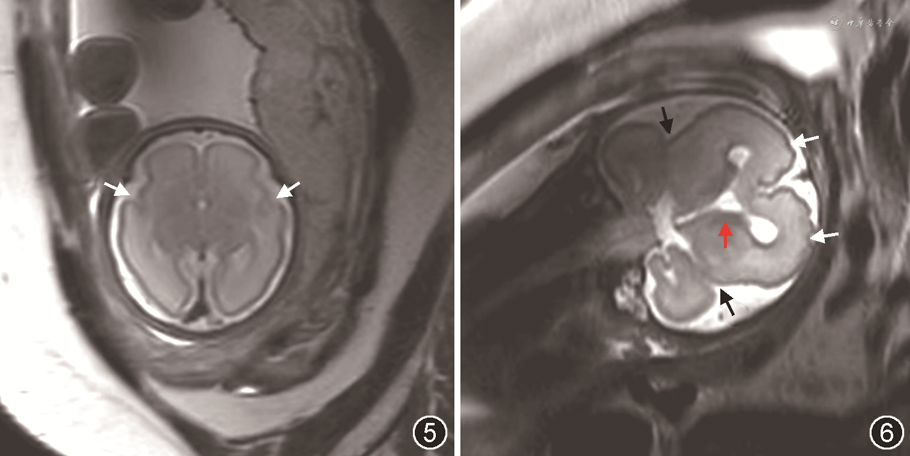
2.神经系统MRI检查:12例中,10例胎儿行神经系统MRI检查,2例拒绝检查而直接选择引产。MRI与超声检查对于胎儿MCD的各种异常征象基本一致(表1和2)。大脑外侧裂异常胎儿MRI图像见图5和6。病例1的MRI显示大脑半球表面多微小脑回,但NSG漏诊。病例3和5的MRI显示胎儿脑实质内异常灰质分层,而NSG漏诊;病例3和7的NSG显示胎儿胼胝体发育不良,但MRI漏诊。

12例中,5例经WES发现胎儿致病性或可疑致病性基因变异,共涉及6种不同的基因。病例10最终诊断为德朗热综合征,病例12诊断为Joubert综合征13型。另7例胎儿发现致病性CNV,共涉及200余个基因,其中5例有明确的遗传综合征,包括Miller-Dieker综合征、6q27综合征、1q43q44 综合征和5q35微缺失综合征。病例2的胎儿2p致病性重复片段31.6 Mb合并9p致病性缺失片段13.1 Mb。进一步对该胎儿的父母进行了染色体核型检查,结果发现胎儿母亲核型正常,其父亲核型为46,XY,t(2,9)(p23;p23)。虽然其父亲染色体核型属于较常见的染色体平衡易位,但遗传至胎儿发生明显的染色体不平衡易位。12例MCD胎儿的产前超声表现均与OMIM中的基因特征对应(表1和2)。
胚胎8~9周时,大脑外侧裂发源于端脑曲的腹侧壁[9]。孕14周时可以在大体标本上观察到大脑外侧裂的形成[10],而产前超声能够在孕18周左右发现胎儿大脑外侧裂[11]。大脑外侧裂是大脑表面出现较早的脑沟回之一,具有相对恒定的位置,且随着孕周增大。大脑外侧裂形成及变化规律是评价大脑皮质发育的重要标志。由于超声在常规轴切面观察胎儿颅脑结构时,超声近场脑组织受颅骨声影遮挡显示较困难,所以常规轴切面往往不能对称显示双侧外侧裂[12]。本研究中,10例MCD的胎儿大脑外侧裂对称性形态异常,包括6例宽大表浅、4例异常成角;2例胎儿双侧大脑外侧裂形态异常,但双侧不一致。所以对称性显示双侧大脑外侧裂形态在胎儿MCD的诊断中非常重要。正如ISUOG指南中提出的[8],本研究采用经阴道行胎儿NSG检查经丘脑冠状切面,以囟门及颅缝为声窗,避开颅骨声影遮挡,对颅内结构显示的清晰程度明显高于普通轴切面,可以更好地对称性显示双侧大脑外侧裂。
本研究中12例大脑外侧裂异常胎儿进行了完整的遗传学检测,发现致病性基因变异,确诊MCD。1例WES未检出致病基因的胎儿除大脑外侧裂发育异常外,还合并侧脑室重度扩张及胼胝体发育不良。既往研究显示,22例MCD胎儿中有21例(95%)的产前超声表现为大脑外侧裂异常[6],但该研究并未说明基因变异与大脑外侧裂形态异常的关系。本研究结果提示,大脑外侧裂发育异常的胎儿脑发育异常的可能性很大,且90%以上经完整的遗传学检测可发现明确的致病基因。2016年,Sarnat和Flores-Sarnat[9]对大脑外侧裂异常与颅脑疾病的关系进行了综述,认为前脑的发育畸形可能会导致端脑曲的发育畸形,进而在影像学上可能表现为大脑外侧裂发育异常。以上均表明大脑外侧裂形态异常是MCD的重要超声指标。
本研究中共有5例胎儿通过WES发现致病性或可疑致病性基因变异,共涉及了6种不同的基因。另有7例胎儿存在致病性CNV,共涉及200余个基因,其中5例有明确的遗传综合征。值得说明的是,病例9为TUBB3基因变异,尽管文献认为TUBB3基因可导致复杂皮质发育不良伴其他脑畸形1型[13],该病例TUBB3基因c.5G>A位点变异并未见文献报道。本研究对TUBB3基因c.5G>A变异进行生物学分析,结合家系WES结果,为新发变异,不排除父母生殖腺嵌合可能(PS2);gnomAD数据库未收录该变异(PM2_Supporting);生物信息分析软件Revel预测不确定,SIFT及MutationTaster软件预测有害,PolyPhen-2 软件预测良性;引产胎儿的产前超声和MRI提示的可能表型与TUBB3基因变异引起的复杂皮质发育不良伴其他脑畸形1型(OMIM:614039)相关表型吻合(PP4);根据上述证据,结合胎儿影像学表现,认为该变异为致病性变异。这些不同的致病基因及遗传综合征都可以引起大脑外侧裂的形态异常,对应的疾病包括无脑回畸形、巨脑回畸形、多微小脑回畸形以及产前不能准确分类的MCD。Sarnat和Flores-Sarnat[9]也阐述了大脑外侧裂发育异常主要涉及的疾病包括原发性小头畸形、无脑回畸形、半侧巨脑症及脑裂畸形等。由此可见,大脑外侧裂形态异常是MCD的超声征象,但无基因特异性。所以对于大脑外侧裂形态异常的胎儿,产前基因诊断仅通过CMA检测并不全面,需要CMA联合WES才能最大限度地检出致病基因。全基因组测序结果复杂,目前暂不适合在产前诊断工作中常规使用。
本研究中,MCD胎儿除了大脑外侧裂形态异常外,还合并颅内及颅外结构异常,包括脑沟回发育落后、侧脑室增宽、侧脑室形态不规则、胼胝体发育不良,以及头围小于相应孕周均值的2个标准差等。有研究提出,脑沟回发育落后和侧脑室形态不规则也是MCD可能的超声征象,可能分别与无脑回畸形和侧脑室旁灰质异位相关[7]。本研究中其他超声征象也可能是MCD的表现,但这些超声征象对于MCD的诊断效能尚未有可靠的研究数据支持,未来需要进一步探索。
本研究12例MCD胎儿中有7例合并侧脑室增宽,另5例不合并侧脑室增宽的胎儿中有1例仅表现为大脑外侧裂形态异常及脑中线结构发育落后。本团队既往研究显示,部分孤立性侧脑室增宽的胎儿会在中孕期出现脑中线部位脑沟回发育落后的现象,但随着胎龄增加,出现发育追赶,脑沟回可在孕期追赶至正常,这类患儿在出生后随访过程中生长发育无明显异常[14]。所以对于这1例仅表现为大脑外侧裂形态异常及脑中线结构发育落后的MCD胎儿,大脑外侧裂形态异常是唯一有效的产前超声征象。另有1例胎儿除大脑外侧裂形态异常外,仅合并单发的颅外结构异常(小下颌)。2020年ISUOG指南提出,小下颌并不是NSG的指征[15]。若仅以侧脑室增宽作为NSG的指征,而忽略了胎儿颅脑结构的观察,可能会漏诊MCD。因此,一方面,临床上要把观察的重点放在颅脑结构上,而不是各项指标的测量上;另一方面,NSG的指征需要在临床工作中不断完善,以及更大样本的病例加以验证。
本研究结果显示,胎儿NSG与MRI不仅显示的大脑外侧裂形态一致,而且同样显示了其他一部分MCD可能的征象,如侧脑室形态异常、神经节隆起增厚或腔化等。但是NSG检查无法完全避开颅骨对于脑组织表面的遮挡,所以漏诊了额叶表面多微小脑回。由于超声无法显示灰质细胞,所以会漏诊白质内异常的灰质异位及分层。但是部分NSG发现的胎儿胼胝体发育不良也被MRI漏诊。2021年ISUOG指南指出经阴道NSG对于评价胼胝体发育不良较MRI准确[8]。提示MRI及NSG检查在MCD的产前诊断中起到互相印证、互相补充的作用,均不可或缺。
目前缺乏MCD明确的发病率数据,但总体而言MCD病例较罕见,产前诊断难度大。本研究虽然仅纳入分析了12例MCD病例,但仍可以说明大脑外侧裂形态异常对于胎儿MCD具有重要的诊断意义。不同种类的MCD预后有所不同,但现有数据尚不能将不同的大脑外侧裂异常形态与不同类型的MCD相对应,也未发现基因特异性。胎儿期可诊断的MCD除大脑外侧裂形态异常外,还有很多其他的影像学特征,如简化脑回、侧脑室形态不规则等。所以尚需更多的病例,探讨大脑外侧裂异常与不同类型MCD的关系及其他影像学指标的诊断意义[7]。
综上,大脑外侧裂形态异常的胎儿大多可以找到明确的致病基因,也是诊断胚系基因致病性变异导致的MCD的重要征象。这类胎儿遗传学检查以CMA联合WES为宜。
祝榕, 马祎楠, 潘虹, 等. 胎儿大脑外侧裂形态异常的产前诊断与胎儿脑皮质发育畸形[J]. 中华围产医学杂志, 2023, 26(2): 89-96. DOI: 10.3760/cma.j.cn113903-20220915-00829.
所有作者声明无利益冲突



























