
陈润森及同事认为,识别生物标志物有助于早期诊断和更好的治疗心境障碍。

版权所有,未经出版人书面同意,不得转载、摘编本刊文章,不得使用本刊的版式设计。严禁以任何形式或途径翻印本刊内容,包括利用电子、机械、影印等方式对本刊文字或插图做全部或部分之抄袭复制或传播,或将本刊储存于任何检索库存系统内。
除非特别声明,本刊刊出的所有文章不代表BMJ出版集团、中华医学会和本刊编委会观点。
心境障碍是各个年龄阶段的人群生活工作能力障碍的主要原因之一。
高质量的脑成像技术有助于更好的理解心境障碍的共病、疾病异质性,以及异常发育的脑机制。
这种高质量的脑成像数据有助于研发出精准的心境障碍生物标志物。
认知神经心理学模型可以用来预测心境障碍的治疗效果。
陈润森及同事认为,识别生物标志物有助于早期诊断和更好的治疗心境障碍。
心境障碍已成为一个全球公共卫生问题。该疾病在人的一生中具有高发病率、慢性和复发性等特点,并且会导致死亡率增加1,2,3。同时,心境障碍作为终身复发性疾病,会导致个人丧失一定工作生产能力并增加社会医疗保健压力,给社会造成了沉重的经济负担4。因此,早期诊断与有效的治疗非常关键。
心境障碍的特征是一个人的情绪状态发生显著变化,主要包括两种亚型:抑郁障碍(重度抑郁发作和心境低落)和双相情感障碍(轻度躁狂、躁狂或躁郁症,即在抑郁和躁狂之间循环发作)。2015年,全球有3亿多人患有重度抑郁症,占全球人口的4.4%5。根据世界心理健康调查倡议报告显示,人群中双相情感障碍的终生患病率和12个月患病率分别为2.4%和1.5%6。
心境障碍与多种认知功能损伤有关,包括高级执行功能7、奖赏处理8和情绪调节(图1,框图1)10。这些损伤与特定脑环路的结构和功能有关系。近来,越来越多的研究基于多维度的数据,包括脑影像、临床症状和认知行为,探究心境障碍的生物学基础,并期望据此研发预测心境障碍患者治疗疗效的精准生物学指标11,12。
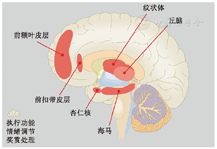

执行功能损伤:指在计划、组织,以及控制思维、集中注意力和控制行为等方面出现的障碍。
奖赏处理功能损伤:学习能力或行为调节能力的降低,是一种强化学习能力的缺失。
情绪调节问题:在抑制负性情绪以及过度的情绪反应时出现的困难。
精准生物标志物:一个通过整合大脑成像、临床症状和认知行为等多维度数据,从而对心境障碍神经基础进行深入理解,而开发的对心境障碍进行诊断和治疗评估的系统。
一般精神病理因素(p-因子):描述多种精神疾病都倾向于涉及一个广泛的临床症状。
高密度功能MRI扫描:是指对一个个体收集长时间的功能MRI时间序列的扫描,比如多个小时的扫描。
认知神经心理学模型:在抗抑郁药物治疗的早期阶段,药物的主要作用是改变情绪信息处理中的负性偏向。
结构与功能磁共振成像(Magnetic Resonance Imaging,MRI)可以检测到脑结构与功能的异常。例如,一项基于来自全球的重度抑郁症患者的结构MRI数据的20多个队列研究表明,与健康对照组相比,重度抑郁症患者的灰质皮层厚度在眶额皮层、扣带和脑岛更小13,而双相情感障碍的患者左侧额下回后部、左侧梭状回以及左侧额中回下部的灰质皮层厚度相比于正常人更小(图1)14。Satterthwaite等15使用静息态功能MRI数据发现重度抑郁症的严重程度与杏仁核与额叶区域(包括:背外侧前额叶皮质和前扣带皮层)的连接减少有关。还有研究使用任务态功能MRI,发现心境障碍患者在执行情绪加工任务时在内侧前额叶皮层、杏仁核以及脑岛都呈现出异常的神经反馈,并且在执行情绪调节任务时在背外侧前额叶皮层呈现出神经反馈弱化16。综上,多模态脑成像在研发心境障碍的生物学指标方面非常有潜力,这也是本文所要阐述的。
当前的诊断指南,包括精神疾病的诊断与统计指南(Diagnostic and Statistical Manual of Mental Disorder,DSM)和国际疾病分类(International Classification of Diseases,ICD),都是基于临床症状表现的。其诊断分类与其依赖的病理学机制没有很好的对应,也不能很好的预测疗效。比如,抑郁症和双相情感障碍的诊断分类在临床症状上都有很多的共同病症,以及类似疾病内部存在很强的异质性17。
多种心境障碍之间以及心境障碍与其他精神疾病之间具有类似的临床症状。比如,重度抑郁患者常常伴随着焦虑症状,并且双相情感障碍与精神分裂症患者之间也有类似的症状。最近的研究使用脑成像与跨诊断方法探究了这类共病的神经基础17,18,19。例如,使用静息态功能MRI,研究表明重度抑郁、双相情感障碍以及精神分裂症患者具有一些类似的脑功能损伤18。近来的研究提出了一个通用的精神病理学因子(称为"p-因子"),以描述多种精神疾病都倾向于涉及一个广泛的临床症状20,并且"p-因子"的升高与完成和执行功能相关任务时额极、前扣带皮层和前脑岛的活动抑制有关19。这些脑回路的异常与心境障碍以及其他精神疾病都有关系。而与快感缺乏等因素相关的其他特定大脑回路可能是重度抑郁症的特异诊断标志。
目前临床诊断指南的另一个问题是异质性。越来越多的人认为,心境障碍不是一种单一的疾病,而是一种包含有明显病理生理缺陷的多个亚型的异质性临床综合征。因此,越来越多研究探究心境障碍的神经生物学异质性17。Drysdale等21使用聚类方法将重度抑郁症细分为4种离散的生物子类型,每一种类型具有特定的边缘系统和额纹状体系统的功能失连接模式。相比将心境障碍细分为离散的类别,维度方法可以利用脑成像将其解析为多个维度,每个维度以一定的概率包含多种症状17。维度方法通过纳入有风险的个体,并将可诊断病例作为一种极端表型,来建立从健康到疾病状态的连续诊断谱。与这些研究一致,美国国家精神卫生研究中心提出的研究领域标准11,12倡导各领域科学团体和临床团体整合脑成像、认知和临床症状,以开发一种新的基于生物信息的疾病分类学和精确的心境障碍生物标志。
精准的生物标志物需要在心境障碍进展的早期阶段识别,以促进早期干预。准确地确定疾病的发病时间对实现这一目标至关重要。既往研究表明,心境障碍的临床症状主要发生在青少年时期,重度抑郁症平均早发年龄为14.9岁22,双相障碍平均早发年龄为20.2岁23。因此,儿童青少年时期(从儿童期到早期成人)是诊断和干预的关键时期。
青少年时期也是脑发育的关键时期,异常的脑发育轨迹与心境障碍患者的临床症状和认知功能障碍有关。例如,使用高分辨率MRI的纵向数据研究表明与健康的青少年相比,双相情感障碍的青少年在发育过程中前额皮质的体积缩小更大,白质扩张更少24。Xia等25发现,情绪症状与额顶叶系统的失连接有关,而失连接从儿童到成人不断恶化。基于这些发现,研究者们越来越多地认为心境障碍是神经发育障碍26。了解青少年时期心境障碍患者的异常脑发育,将有助于确定心境障碍的生物学发病时间,而生物学发病时间可能早于临床症状的发病时间。
为了精确地描述心境障碍患者脑功能组织的异常发育,高密度采样具有其独特的优势。经典的功能MRI采集持续5~10分钟,可能足以描述群体平均的脑功能组织,但远远不足以描述一个个体特异的大脑功能组织的细节27,28。最近的研究表明,每个个体的大脑功能组织呈现特定的形态细节,这些细节在群组水平的功能组织中被抹去了,需要高密度功能MRI扫描来刻画27,29,30。高密度功能MRI扫描是指对一个个体采集长时间的功能MRI数据,可以通过多次重复扫描获得。这类数据揭示了个体特异的功能网络形态的细节,既可靠又可重复;这些可能有助于精确识别心境障碍的生物标志31。
最近,Cui等32使用了远远长于传统扫描时间的27分钟的功能MRI采集,描述了大脑功能网络组织的形态在青少年时期的发育情况。理解青少年典型的大脑发育特征是理解心境障碍中大脑异常发育的先决条件,因为心境障碍是一种偏离典型发育轨迹的情况。结果还证明了大脑功能组织的个体差异可以预测执行功能32,而执行能力障碍是心境障碍的典型特征。这些发现表明高密度功能MRI扫描所揭示的功能组织的形态细节可能有助于理解心境障碍的神经发育机制。然而,高密度的功能MRI数据采集对正常发育的和有心境障碍的儿童青少年都很匮乏,神经科学和精神病学团队都应该在这个方向上努力。
除了对个体进行高密度功能MRI扫描外,大样本量对于描述心境障碍如何偏离典型大脑发育轨迹也至关重要。一些研究团队已经公开了大样本的青少年发育数据集,如费城神经发育队列(Philadelphia Neurodevelopmental Cohort,PNC;见框图2)33。PNC是一个维度队列,包含从健康到患病状态的一个连续的谱系,其中包括从风险个体到诊断为心境障碍患者的过渡,因此,它是一个识别心境障碍发病时间的重要资源。关于健康青少年和精神障碍青少年的数据集清单见框图2。未来大家需要致力于采集大样本的和高密度的功能MRI扫描数据集,以更好地明确心境障碍的发病时间。
费城神经发育队列(Philadelphia Neurodevelopmental Cohort,PNC):https://www.ncbi.nlm.nih.gov/projects/gap/cgi-bin/study.cgi?study_id=phs000607.v3.p2
青少年脑认知发展(Adolescent Brain Cognitive Development,ABCD):https://abcdstudy.org
人类连接组发育项目(Human Connectome Project Development,HCPD):https://humanconnectome.org/study/hcp-lifespan-development
儿科影像、神经认知和遗传学(Pediatric Imaging,Neurocognition,and Genetics,PING)数据库:http://pingstudy.ucsd.edu/ 5
健康大脑网络(Healthy Brain Network,HBN)生物库:https://data.healthybrainnetwork.org/main.php 6
IMAGEN:http://www.imagen-europe.com
识别治疗效果的早期生物标志物对评估心境障碍的治疗策略至关重要。最近研究者提出关于抗抑郁药起效作用机制的理论:认知神经心理学模型,该模型表明药物治疗主要并非对主观情绪症状起作用,而是首先改变了大脑中情绪信息的认知加工过程中的负性偏向34,35(图2)。任务功能MRI研究发现当心境障碍患者和健康志愿者服用抗抑郁药物后,大脑与情绪处理过程中正性/负性偏向相关的信号发生了变化。例如,Godlewska等36发现,与安慰剂相比,服用抗抑郁药物(艾司西酞普兰)7天后,抗抑郁药物通过减弱杏仁核对负性刺激(惊恐面部表情)的反应,纠正了抑郁患者的神经系统反应。重要的是,该研究在抗抑郁药物治疗的早期阶段所发现的神经变化是独立于主观情绪症状变化的。这表明抗抑郁药物在对情绪症状产生影响之前,直接作用于与抑郁症相关的大脑神经功能。
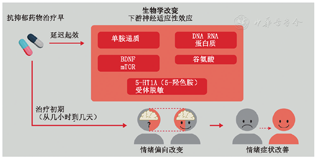

值得注意的是,之前的研究一致表明,抗抑郁药物在作用早期引起的神经系统对情绪加工任务的反应变化预示着治疗的效果37。最近的一项研究中招募了35名未接受过药物治疗的重度抑郁症患者,对他们进行了6周的艾司西酞普兰治疗。在治疗前与治疗后7天,让患者完成了情绪面孔识别任务,并使用任务功能MRI检测神经反应38。根据6周治疗结束时抑郁症状减轻50%为缓解标准,22名患者对治疗有效,13名患者无效。在艾司西酞普兰治疗7天后,与无效的患者相比,有效的患者对惊恐面孔的神经反应减弱,在杏仁核、脑岛、前扣带皮层、后扣带皮层、双侧神经节上回和丘脑均有改变。这些结果表明,神经系统对惊恐面孔的早期反应变化,可以预测抗抑郁药治疗的疗效。
认知神经心理学模型通常使用情绪加工任务以及功能MRI,可以在新型药物疗效预测中作为早期生物标志物发挥作用,包括那些基于新作用机制的药物,如氯胺酮37。药物开发失败的主要原因往往是因为从动物实验到临床应用的转化有效性低。因为新开发的药物通常是在动物模型中进行有效性测试,而非人体试验,这样的筛选预测效度较低39。药物开发中开展的临床实验都需要大量的资金,因此,找到可以在早期明确新药是否会影响情绪加工或认知功能的核心指标可以大大减少临床试验失败的成本。更好了解精神药理学中的认知神经心理模型以及利用神经测评去预测治疗效果,还可能可以在未来指导对心境障碍患者的分层治疗。
在心境障碍的早期诊断和治疗评估方面,研发和验证精准的生物标志物非常重要。然而,心境障碍固有的共病性和异质性阻碍了这一进展。脑成像是解决这一问题的很有前景的方法,因其可以检测大脑结构和功能的变化。它可以针对心境障碍的情绪的多方面问题识别精准生物标志。该研究方向的发展需要结合脑成像、认知神经科学、试验模型和计算技术(未来的研究方向见框图3)。我们提倡各个研究团体为推进这一研究开展密切合作。
使用跨诊断方法去除诊断的边界以探究共病的神经基础。
识别心境障碍的生物学类型,并揭示它们特异的大脑病理机制。
刻画心境障碍患者的大脑发育与青少年正常的大脑发育轨迹的不同。
利用脑成像数据预测心境障碍的出现和治疗效果。
改进实验设计,推进认知神经心理学模型,以更好地评估精神药理学治疗的疗效。
作者贡献(Contributors and sources):GW is the president of Beijing Anding Hospital,Capital Medical University,and the director of National Clinical Research Center for Mental Disorders,China. RC is a mental health researcher,specializing in psychopharmacology,emotion and clinical psychology. ZC is a postdoctoral fellow investigating typical and atypical brain development using brain imaging and computational techniques. LC is a researcher within the Experimental Medicine and Adult Mental Health themes,part of the Oxford Health Biomedical Researcher Centre. TS is an Associate Professor in Psychiatry,and a director of the lifespan informatics & neuroimaging center in the Department of Psychiatry at the University of Pennsylvania Perelman School of Medicine. CH is a Professor of Cognitive Neuroscience,and the director of the Psychopharmacology and Emotional Research Lab based in the Department of Psychiatry at University of Oxford. GW is a guarantor of the article. RC and ZC drafted the article. All authors contributed to critical revision of the article and approved the final manuscript. RC and ZC contributed equally to this article and shared co-first authorship.
患者参与(Patient involvement):No patients were involved.
志谢(Acknowledgement):We thank Yin Wang for help with figures.
利益竞争(Competing interests):We have read and understood the BMJ policy on declaration of interests and have the following interests to declare:GW declares funding from the National Key Research & Development Program of China (2016YFC1307200) and the Capital′s Funds for Health Improvement and Research (2018-1-2121). LP and CH are supported by the NIHR Oxford Health Biomedical Research Centre (OH BRC). The views expressed are those of the authors and not necessarily those of the NHS,the NIHR or the Department of Health. CH receives consultancy fees from p1vital,Lundbeck,Sage Therapeutics and J&J. The funders had no role in the design or conduct of the study,collection,management,analysis,or the interpretation of the data.



























