
患者老年女性,65岁,持续性背部钝痛和腿痛四年余。三个月前行腰椎减压术,但术后仍有疼痛。查体无神经系统受损征象。患者正在接受高血压和慢性肾病的治疗,无法服用非甾体类抗炎药。曾口服扑热息痛、可待因、曲马多和阿米替林镇痛,无明显效果。予普瑞巴林试用,如果出现头晕或不能耐受药物副作用,需继续随访。

版权所有,未经出版人书面同意,不得转载、摘编本刊文章,不得使用本刊的版式设计。严禁以任何形式或途径翻印本刊内容,包括利用电子、机械、影印等方式对本刊文字或插图做全部或部分之抄袭复制或传播,或将本刊储存于任何检索库存系统内。
除非特别声明,本刊刊出的所有文章不代表BMJ出版集团、中华医学会和本刊编委会观点。
普瑞巴林和加巴喷丁,均属于加巴喷丁类药物,主要用于抗惊厥治疗。在过去的十年里,越来越多地被用于止痛1。尽管此类药物被推荐用于成人神经病理性疼痛2,3(表1),但通常说明书用于治疗其他疼痛疾病,如腰痛、坐骨神经痛和偏头痛9,10。普瑞巴林是2017年全球销量最高的药品之一11。2018年,英国医生开出了1 400多万张普瑞巴林和加巴喷丁的处方12。加巴喷丁类药物处方的增加可能是由于人们希望避免使用阿片类止痛药13。

普瑞巴林和加巴喷丁批准的适应证
2019年4月,由于加巴喷丁类药物滥用和成瘾造成的死亡人数增加,英国将普瑞巴林和加巴喷丁重新归为C类药物14。根据英国的滥用药物法,非法占有、生产或供应这些药物会受到处罚和罚款。美国食品与药品监督管理局对加巴喷丁类药物用量的增加表示担忧,尤其是与阿片类止痛药或苯二氮 类药物同时使用时1。另一些人呼吁将这两种药物列为Ⅴ级管制药物15,与阿片类药物属于同一类别,以规范其处方。
类药物同时使用时1。另一些人呼吁将这两种药物列为Ⅴ级管制药物15,与阿片类药物属于同一类别,以规范其处方。
加巴喷丁类药物结合在电压门控钙通道的α2-δ亚基上,减少谷氨酸、去甲肾上腺素和P物质的释放7,8,发挥抗惊厥、镇痛和抗焦虑等作用。
中等质量的证据支持,与安慰剂相比,加巴喷丁类药物可以改善带状疱疹后神经痛或糖尿病周围神经病变患者的疼痛,这一点与Cochrane的系统评价一致。近4/10的人服用普瑞巴林(600 mg/天)和3/10的人服用加巴喷丁(≥1 200 mg/天)持续8周或更长时间,疼痛至少缓解50% 16,17。50%的参与者疼痛减轻了三分之一(表2,图1,图2)。针对其他类型的神经病理性疼痛的证据有限。
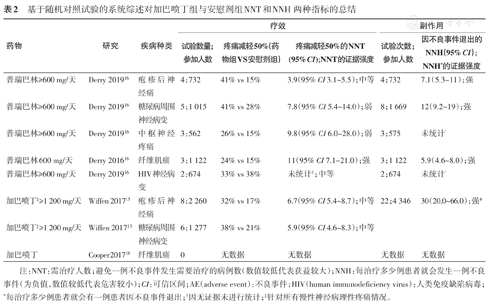
基于随机对照试验的系统综述对加巴喷丁组与安慰剂组NNT和NNH两种指标的总结
基于随机对照试验的系统综述对加巴喷丁组与安慰剂组NNT和NNH两种指标的总结
| 药物 | 研究 | 疾病种类 | 疗效 | 副作用 | |||
|---|---|---|---|---|---|---|---|
| 试验数量;参加人数 | 疼痛减轻50%(药物组VS安慰剂组) | 疼痛减轻50%的NNT (95% CI);NNT的证据强度 | 试验次数;参加人数 | 因不良事件退出的NNH(95% CI);NNH*的证据强度 | |||
| 普瑞巴林≥600 mg/天 | Derry 201916 | 疱疹后神经痛 | 4;732 | 41% vs 15% | 3.9(95%CI 3.1~5.5);中等 | 4;732 | 7.1(5.3~11);强 |
| 普瑞巴林≥600 mg/天 | Derry 201916 | 糖尿病周围神经病变 | 5;1 015 | 41% vs 28% | 7.8(95% CI 5.4~14.0);弱 | 8;1 669 | 12(9.2~19);强 |
| 普瑞巴林≥600 mg/天 | Derry 201916 | 中枢神经疼痛 | 3;562 | 26% vs 15% | 9.8(95% CI 6.0~28.0);弱 | 3;575 | 未统计^ |
| 普瑞巴林600 mg/天 | Derry 201616 | 纤维肌痛 | 3;1 122 | 24% vs 15% | 11(95% CI 7.1~21.0);强 | 3;1 122 | 5.9(4.6~8.0);强 |
| 普瑞巴林≥600 mg/天 | Derry 201916 | HIV神经病变 | 2;674 | 33% vs 38% | 未统计†;中等 | 2;674 | 未统计^ |
| 加巴喷丁‡≥1 200 mg/天 | Wiffen 201715 | 疱疹后神经痛 | 8;2 260 | 32% vs 17% | 6.7(95% CI 5.4~8.7);中等 | 22;4 346 | 30(20.0~66.0);强# |
| 加巴喷丁‡≥1 200 mg/天 | Wiffen 201715 | 糖尿病周围神经病变 | 6;1 277 | 38% vs 21% | 5.9(95% CI 4.6~8.3);中等 | ||
| 加巴喷丁 | Cooper 201718 | 纤维肌痛 | 0 | 无数据 | 无数据 | 无数据 | 无数据 |
注:NNT:需治疗人数;避免一例不良事件发生需要治疗的病例数(数值较低代表获益较大);NNH:每治疗多少例患者就会发生一例不良事件(为负值,数值较低代表危害较小);CI:可信区间;AE(adverse event):不良事件;HIV(human immunodeficiency virus):人类免疫缺陷病毒;*每治疗多少例患者就会有一例患者因不良事件退出;†因无证据未进行统计;‡针对所有慢性神经病理性疼痛情况。
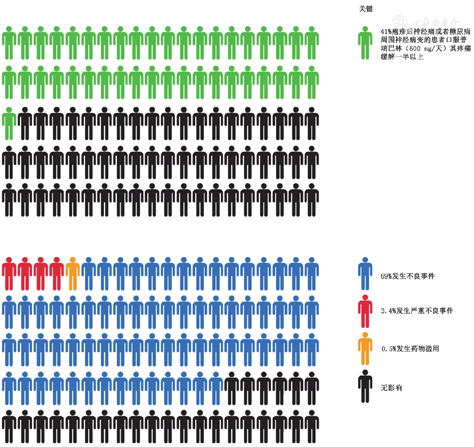
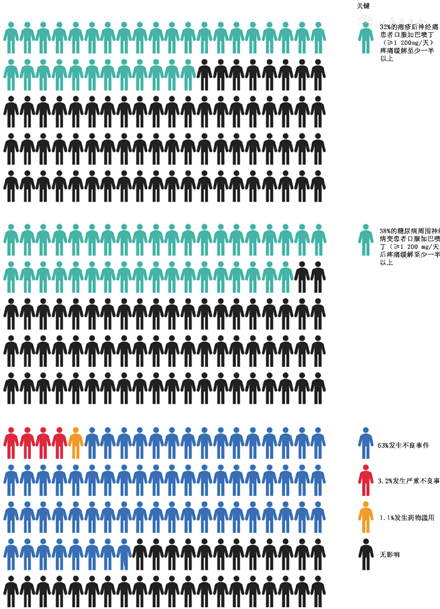

普瑞巴林和加巴喷丁对神经病理性疼痛治疗有效,可以用于一线治疗神经病理性疼痛,如带状疱疹后神经痛、糖尿病周围神经病变等。
对腰痛、坐骨神经痛、椎管狭窄、阵发性偏头痛无效,不建议在这些情况下超说明书使用。
如果患者出现副作用如头晕,困倦和步态不稳等则需要减量或停药。
我们使用"pregabalin(普瑞巴林)""Lyrica(普瑞巴林商品名)""gabapentin(加巴喷丁)"和"Neurontin(加巴喷丁商品名)"等术语检索了PubMed (美国医学图书馆数据库)和循证医学图书馆(the Cochrane Library)2008至2019年3月发表的关于普瑞巴林和加巴喷丁的获益、危害和成本效益的系统综述。此外,还查阅了个人参考文献档案,并在没有发现相关综述的方面咨询了其他专家(例如,有关监管变化的信息)。
另一项关于神经病理性疼痛药物治疗的系统综述报告了加巴喷丁类药物的类似作用2。然而,各种剂量的治疗效果混杂在一起可能会高估治疗效果,尤其是研究质量存在差异的情况下。
表2列出了关于加巴喷丁类药物缓解疼痛的效果和潜在危害的研究结果。
三环类抗抑郁药[需治疗人数(NNT)3.6,95%可信区间(CI)3.0~4.4;中等质量证据]和5 -羟色胺-去甲肾上腺素再摄取抑制剂(NNT 6.4,95%CI 5.2~8.4;高质量证据)也是治疗神经病理性疼痛的一线药物。它们的NNT比加巴喷丁类药物更小,可能会更有效2。其他抗惊厥药物如卡马西平、拉克酰胺和拉莫三嗪对神经性疼痛的疗效尚无定论。
加巴喷丁类药物的副作用很常见,经常因此导致药物停用。服用这些药物来治疗神经病理性疼痛的患者中有近2/3会出现药物不良事件(图1,图2)16,17。
基于Cochrane评价的中等水平证据,加巴喷丁经常出现的不良反应有头晕(19%)、嗜睡(14%)和步态不稳(14%)17。与安慰剂组(8.2%)相比,试验组因药物不良反应退出试验的发生率(11%)更高。
服用普瑞巴林的患者中,头晕(24%)和嗜睡(17%)的发生率也高于安慰剂组(分别为6%和5%)16。一项Cochrane评价(包括三项研究,1 122名参与者)表明服用普瑞巴林(600 mg/天)治疗纤维肌痛症的患者中,91%的实验组患者伴有一种或多种不良反应,安慰剂组为73%18。与安慰剂组(11%)相比,普瑞巴林组因药物不良反应退出研究的发生率更高(28%)。
尽管在系统评价中,加巴喷丁类药物的严重不良事件发生率与安慰剂相似16,17,但是基于人群的研究均显示其具有潜在的严重危害。澳大利亚的一项研究发现在2012至2017年间,普瑞巴林相关的蓄意投毒和死亡人数每年增加57.8%(95% CI 30.0%~91.6%),与普瑞巴林处方的增加一致20。过量服用普瑞巴林者往往同时还服用阿片类药物、苯二氮 类药物和非法毒品20。普瑞巴林与阿片类止痛药合用可以增加阿片类药物过量和死亡的相关风险(比值比为1.49,95%CI 1.18~1.88)21。
类药物和非法毒品20。普瑞巴林与阿片类止痛药合用可以增加阿片类药物过量和死亡的相关风险(比值比为1.49,95%CI 1.18~1.88)21。
根据一个国际不良事件数据库,2004至2015年有11 940份关于加巴喷丁类药物滥用和成瘾的报告,其中2012年以来报告的病例占75%以上。一项对1 500名16~59岁的英国受访者的调查发现,自我报告一生中曾滥用加巴喷丁和普瑞巴林的发生率分别为1.1%和0.5% 22。滥用定义为故意以不当的方式使用药物进行治疗,即不按规定的剂量服用药物22。在滥用阿片类药物的患者中,加巴喷丁类药物滥用的发生率也较高:普瑞巴林占3%~68%,加巴喷丁占15%~22%22。由于纳入的均为回顾性研究,这些数值可能被低估。阿片类药物的使用者倾向于通过加巴喷丁类药物产生亢奋的情绪并减少戒断症状,同时只产生轻度的不良反应。

考虑到不良事件的风险和滥用的可能,建议谨慎开具这些药物的处方。在开处方前应与患者讨论预期存在的副作用和疼痛缓解的可能。澳大利亚、英国和加拿大的指南都推荐将加巴喷丁类药物作为神经病理性疼痛的一线治疗,同样也推荐了阿米替林和度洛西汀(澳大利亚和英国)或5 -羟色胺-去甲肾上腺素再摄取抑制剂(加拿大)3,23,24。不建议将这些药物用于非神经病理性疼痛。目前尚无药物联合治疗的证据。
在临床实践中,可能需要对该药进行6~8周的试用,以明确能否获益及其潜在的危害。需要检查患者正在服用的药物。药物相互作用在药物说明书中并不常见,但该药与阿片类药物合用会增加药物毒性。药品制造商建议给药前评估患者的自杀行为和意图。在给有已知病史及可能药物滥用或依赖的患者开具加巴喷丁类药物处方时要小心谨慎。禁忌证包括已知对此类药物过敏和肾脏清除率降低。
参阅当地药典以获知适用剂量和适应证。制造商建议3至7天内分次逐渐增加剂量,直到疼痛缓解或达到最大剂量。每日2次时普瑞巴林的最大剂量为600 mg /天7,每日3次时加巴喷丁的最大剂量为3 600 mg/天。
随访患者对治疗的反应和不良事件。如果疼痛没有改善,或者患者出现了影响工作和降低生活质量的不良事件,可以考虑停药。应逐渐减少药物剂量1。突然停药可能导致"撤药反应",如激动、烦躁和疲劳25。普瑞巴林每周减量50~100 mg/天,加巴喷丁每周最多减量300 mg/天26。
在哪种情况下,您会考虑使用加巴喷丁来缓解疼痛?
基于本文的阅读,您将如何与患者讨论使用加巴喷丁类药物减轻疼痛及其潜在的不良事件风险?
开始使用这些药物时您会给患者什么建议?
与其他口服药物相比,普瑞巴林和加巴喷丁的价格属于中低档水平2。关于其成本效益的研究很少。一项行业资助的研究报告表明,普瑞巴林与混合的阿片类药物或非甾体类镇痛药相比,在原因不明的难治性神经性疼痛方面更具有成本效益27。另一项观察性研究表明,与加巴喷丁相比,普瑞巴林用于治疗周围神经性疼痛的医疗费用更低28。
利益竞争(Competing interests):No funding was received to conduct this review.BMJ has judged that there are no disqualifying financial ties to commercial companies. The authors declare the following other interests:
普瑞巴林和加巴喷丁对某些类型的神经相关性疼痛有效,例如带状疱疹或糖尿病所致的疼痛。如果您有这种疼痛,您的医生可能会考虑开始使用这些药物进行治疗
持续8周及以上每天服药的患者中,约有40%带状疱疹后神经痛或糖尿病性周围神经病的患者发现疼痛至少减轻了50%
您可能需要持续服用这些药物8周以后才能感觉疼痛症状得到改善
这些药物除在上述情况以外,对缓解疼痛均无效,不建议使用
在开始使用这些药物之前,请咨询您的医生,以便他们可以在开具处方之前评估您的用药史和既往病史
在服用这些药物的患者中,近三分之二会出现诸如头晕、嗜睡、周围水肿和步态异常等副作用
如果您出现了任何不良反应,请报告给您的医生,以便他们对治疗方法的调整做出建议。不要突然停药
如果您已经在服用阿片类药物来缓解疼痛,不建议加服加巴喷丁或普瑞巴林。如果您同时服用这两种药物,死亡的风险会有所增加。如果您已经同时服用这两种药物,请咨询您的医生以减少或停止其中一种或两种药物的使用
我们采访了持续使用加巴喷丁治疗慢性疼痛和在詹姆斯库克大学疼痛门诊主动减小加巴喷丁药量的患者。一些患者认为定期评估药量有助于实现缓解疼痛与药物副作用的平衡,并获知合适的药物剂量。若服药后疼痛未缓解,医生必须就如何停药给出建议。一名曾因腰痛服用普瑞巴林5年后停药的患者评论:"我花了3周完全停掉普瑞巴林,现在我觉得好多了。尽管我的背痛没有太大变化,但我不再昏昏欲睡,也能完成我的工作了。"另一位患者在医生的帮助下,用3年时间停掉了用以治疗坐骨神经痛的加巴喷丁。我们根据他们的反馈再次强调了这些药物的不良反应,并补充了这些药物处方和随访的信息。
SM holds a National Health and Medical Research Council of Australia (NHMRC) Health Professional Research Early Career Fellowship (APP1158463). SM and CL conducted an investigator initiated NHMRC funded trial (PRECISE) published in NEJM in 2017, for which Pfizer Australia provided investigational product only. SE is CI and PI of National Institute for Health Research studies as well as industry sponsored studies. He is chair of the Specialised Pain Clinical Reference Group at NHS England. SE prescribes gabapentinoids as part of his clinical practice. Neither he nor his institution have received funding from the pharmaceutical industry in relation to this or any other work. He consults for manufacturers of neuromodulation devices including Medtronic, Saluda Medical, and Mainstay Medical. SE and MU are co-chief investigator and co-investigator on a UK National Institute for Health Research (NIHR) funded trial of opioid withdrawal ISRCTN49470934. MU is chief investigator or co-investigator on multiple previous and current research grants from the UK NIHR, Arthritis Research UK, and is a co-investigator on grants funded by the Australian NHMRC. He is an NIHR senior investigator. He has received travel expenses for speaking at conferences from the professional organisations hosting the conferences. He is a director and shareholder of Clinvivo Ltd, which provides electronic data collection for health services research. He is part of an academic partnership with Serco Ltd related to return to work initiatives. He is a co-investigator on two NIHR funded studies that receive additional support from Stryker Ltd. He has accepted honorariums for teaching/lecturing from a consortium for advanced research training in Africa. He was an editor of the NIHR journal series, and a member of the NIHR Journal Editors Group, for which he received a fee. Further details of The BMJ policy on financial interests are here: https://www.bmj.com/about-bmj/resources-authors/forms-policies-and-checklists/declarationcompeting-interests.
知情同意(Patient consent):The case in this article was fictious and therefore no consent was needed.
来源和同行评议(Provenance and peer review):commissioned; externally peer reviewed.
贡献声明和承诺人(Contribution statement and guarantor):article was conceived by CL, planning conducted by SM, and all authors contributed to the proposal and manuscript.



























