
随着全国新型冠状病毒肺炎(COVID-19)疫情防控工作的逐步推进,疫情防控进入了关键时期。核酸检测作为明确COVID-19病因的重要手段,其弊端逐渐显露。作为机体抵抗病毒感染的重要免疫应答产物,血清特异性抗体迅速被应用于2019新型冠状病毒的实验室检测中,与核酸检测结合用于COVID-19患者的快速诊断和筛查工作。本文从抗体产生规律、临床常用检测方法、抗体检测在临床的应用及抗体检测的局限性等方面进行探索讨论,有助于血清抗体检测在COVID-19诊断中的应用与发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒肺炎(COVID-19)是由2019新型冠状病毒(2019 novel coronavirus,2019-nCoV)感染引起的一种新发传染病。2019-nCoV主要通过实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, RT-PCR)进行核酸检测。但在临床工作中,由于标本类型、标本质量、患者病情等因素的差异可导致核酸检测出现假阴性结果,严重影响疾病的诊断和治疗。因此迫切需要一种准确、快速的方法对其进行补充检测,协助核酸检测快速识别COVID-19患者,防止2019-nCoV的进一步传播[1]。2020年3月3日,国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[2]指出2019-nCoV特异性IgM和IgG抗体阳性;IgG抗体由阴性转为阳性或恢复期较急性期4倍及以上增高可作为COVID-19的临床诊断标准。抗体检测操作简单快速,标本稳定且易于保存,对实验人员及条件要求较低,但同时也存在不可避免的"假阳性"可能。本文就2019-nCoV特异性抗体检测现状及应用进行分析。
通常病毒感染机体后,机体免疫系统能产生特异性抗体。2019-nCoV是一种新发冠状病毒,对其特异性抗体的产生规律还未见相关报道。由于2019-nCoV与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)同属β属冠状病毒,且基因组序列相似度达79.6%[3]。推测2019-nCoV抗体产生过程与SARS-CoV相似。SARS-CoV感染人体后,免疫球蛋白M(immunoglobulin M,IgM)是最先产生的抗体,在感染后3~6 d内即可在患者血液中检测到,但抗体浓度较低,持续时间短,感染后15 d左右达到高峰,之后很快下降直至消失,IgM抗体通常提示现症或新近感染。而免疫球蛋白G(immunoglobulin G,IgG)出现时间相对较晚,在感染8 d后才能检测到,但抗体浓度较高,可达IgM的4~8倍,抗体出现后持续上升,在感染后20 d左右达到高峰,之后长时间在体内保持较高水平[4,5]。
GICA是以胶体金为示踪标志物,用于抗原抗体快速检测的一种免疫标记技术,具有简单、方便、快速、经济等优点,广泛用于现场快速检测及危急重症的快速检测[6]。基于GICA对2019-nCoV特异性抗体的检测已在临床得到应用,目前国家药监局已批准上市的胶体金法抗体检测试剂盒有5种,其详细信息见表1。基于GICA的试剂盒仅需一滴血即可在15 min内通过肉眼判读结果,与其他常见的抗体检测方法相比,其优势在于检测时间短、成本低、无需借助仪器即可判读结果,但只能对抗体进行定性检测,无法实现精确定量。其次,由于其需要肉眼观察颜色深浅来判断结果,因此存在个体判断的差异。
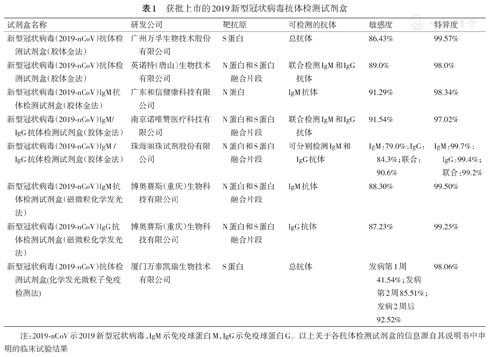
获批上市的2019新型冠状病毒抗体检测试剂盒
获批上市的2019新型冠状病毒抗体检测试剂盒
| 试剂盒名称 | 研发公司 | 靶抗原 | 可检测的抗体 | 敏感度 | 特异度 |
|---|---|---|---|---|---|
| 新型冠状病毒(2019-nCoV)抗体检测试剂盒(胶体金法) | 广州万孚生物技术股份有限公司 | S蛋白 | 总抗体 | 86.43% | 99.57% |
| 新型冠状病毒(2019-nCoV)抗体检测试剂盒(胶体金法) | 英诺特(唐山)生物技术有限公司 | N蛋白和S蛋白融合片段 | 联合检测IgM和IgG抗体 | 89.0% | 98.0% |
| 新型冠状病毒(2019-nCoV)IgM抗体检测试剂盒(胶体金法) | 广东和信健康科技有限公司 | N蛋白 | IgM抗体 | 91.29% | 98.34% |
| 新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂盒(胶体金法) | 南京诺唯赞医疗科技有限公司 | N蛋白和S蛋白融合片段 | 联合检测IgM和IgG抗体 | 91.54% | 97.02% |
| 新型冠状病毒(2019-nCoV)IgM /IgG抗体检测试剂盒(胶体金法) | 珠海丽珠试剂股份有限公司 | N蛋白和S蛋白融合片段 | 可分别检测IgM和IgG抗体 | IgM:79.0%;IgG:84.3%;联合:90.6% | IgM:99.7%;IgG:99.4%;联合:99.2% |
| 新型冠状病毒(2019-nCoV)IgM抗体检测试剂盒(磁微粒化学发光法) | 博奥赛斯(重庆)生物科技有限公司 | N蛋白和S蛋白融合片段 | IgM抗体 | 88.30% | 99.50% |
| 新型冠状病毒(2019-nCoV)IgG抗体检测试剂盒(磁微粒化学发光法) | 博奥赛斯(重庆)生物科技有限公司 | N蛋白和S蛋白融合片段 | IgG抗体 | 87.23% | 99.25% |
| 新型冠状病毒(2019-nCoV)抗体检测试剂盒(化学发光微粒子免疫检测法) | 厦门万泰凯瑞生物技术有限公司 | S蛋白 | 总抗体 | 发病第1周41.54%;发病第2周85.51%;发病2周后92.52% | 98.06% |
注:2019-nCoV示2019新型冠状病毒,IgM示免疫球蛋白M,IgG示免疫球蛋白G。以上关于各抗体检测试剂盒的信息源自其说明书中申明的临床试验结果
CLIA是将高敏感度的化学发光测定技术与高特异度的免疫反应相结合的检测分析技术。具有特异性高、线性范围宽、结果稳定、操作自动化、速度快等优点,临床上广泛用于对各种抗原、抗体、激素、酶等的检测[7,8]。目前,博奥赛斯(重庆)生物科技有限公司研发的2019-nCoV IgM抗体检测试剂盒(磁微粒化学发光法)和2019-nCoV IgG抗体检测试剂盒(磁微粒化学发光法)已经获批上市,见表1。值得注意的是,试剂盒说明书中申明的临床试验结果显示两试剂盒联合使用时,检测效能大大提升,敏感度和特异度可分别达94.33%和99.50%。厦门万泰凯瑞生物技术有限公司研发的2019-nCoV抗体检测试剂盒(化学发光微粒子免疫检测法)随后也获批上市,该试剂盒用于检测2019-nCoV总抗体[包括IgM、IgG和免疫球蛋白A(immunoglobulin A,IgA)等各种抗体类型]。基于CLIA的试剂盒能够实现对抗体的定量检测,国内还有多家生物公司研发出了基于CLIA检测2019-nCoV IgM和IgG抗体的试剂盒,获批上市后将大大缓解临床的诊断压力。
ELISA是将可溶性的抗原或抗体包被到聚苯乙烯等固相载体上,利用酶标记的抗体或抗原与待测抗原或抗体特异性结合的原理,根据酶催化底物产生的有色产物颜色的深浅进行分析的一种定性或半定量检测方法[9]。该方法敏感度较高,但检测速度慢、操作繁琐、干扰因素较多。
ICA是基于荧光标记的抗原或抗体与待测抗体或抗原特异性免疫反应的新型膜检测技术。该方法具有敏感度高、稳定性好、受自然荧光干扰低等优点,用于荧光免疫分析的标记物主要包括荧光素、量子点等[10]。ICA既保留了传统胶体金层析技术的样本无需特殊处理,所需样本量少等优点,又融入了荧光检测技术的高敏感度特点,一定程度上弥补了胶体金免疫层析技术的不足。但其需要大型免疫分析仪的辅助,无法实现床旁检测,检测过程中需要外加光源,特异性较化学发光法差。
基于不同方法的2019-nCoV特异性抗体检测试剂盒各有特点,对于不同情况的患者其检测能力也有所差异。唐鹏等[11]纳入了191例具有明确的流行病学接触史及典型临床症状和(或)肺部影像学特征的COVID-19疑似和确诊的患者,将其分为2019-nCoV持续阳性组(入院核酸检测结果阳性,至血清采集时持续阳性)、2019-nCoV阳转阴组(入院核酸检测结果阳性,至血清采集时核酸转阴)和2019-nCoV疑似组(入院核酸检测结果阴性,至血清采集时持续阴性)。分别用胶体金法和化学发光法检测各组IgM+IgG总抗体,比较两种常用方法检出率的差异。研究显示,2019-nCoV持续阳性组胶体金法和化学发光法在抗体检出率上没有表现出显著性差异;而2019-nCoV阳转阴组和疑似组化学发光法检测总抗体的阳性检出率明显优于胶体金法。徐云云等[12]用胶体金免疫层析和荧光免疫层析两种方法对80例处于不同病程的COVID-19确诊患者进行IgM抗体检测。结果显示,发病0~3 d和22~30 d的患者用两种方法检测IgM的阳性率无差别;对于发病4~21 d的患者,荧光免疫层析法检测IgM的阳性率高于胶体金免疫层析法;而对于发病时间大于30 d的患者,胶体金免疫层析法检测IgM的阳性率高于荧光免疫层析法。这些研究提示在COVID-19的临床诊疗过程中,可根据患者病程和核酸检测结果等具体情况选择相应的检测方法,以尽可能提高抗体检测的阳性率。
在将抗体检测纳入《新型冠状病毒肺炎防控方案》之前,临床上常采用RT-PCR对2019-nCoV核酸进行检测,用于明确COVID-19的病因。据统计,COVID-19确诊患者的核酸阳性率仅有30%~50%,且核酸检测结果受到样本类型、采样方式、采样时间、样本保存等多种因素的影响[13]。因此,仅依据核酸检测会漏诊部分COVID-19患者。沈利华等[14]的研究评估了3种2019-nCoV核酸检测试剂盒的临床诊断效能,发现有2种核酸检测试剂盒的检测敏感度在90%以下,特异度在85%左右。对比获批上市的抗体检测试剂盒临床试验数据可以看出,2019-nCoV特异性抗体的检测能在一定程度上弥补核酸检测的缺陷,尤其是IgM和IgG抗体的联合检测,能大大提高检测的敏感度和特异度。Zhao等[15]通过对COVID-19患者体内抗体应答情况的深入研究发现在感染早期,总抗体检测的敏感度就超过了核酸检测。联合核酸和血清总抗体检测的敏感度可达99.4%,比单独检测核酸的敏感度提升了32.3%。Li等[16]应用测流免疫层析技术,对397例确诊病例和128名健康对照进行2019-nCoV特异性抗体检测。研究结果显示,IgM和IgG抗体联合检测的敏感度高于IgM和IgG抗体单独检测。因此,血清2019-nCoV抗体检测特别是总抗体的检测(IgM和IgG抗体联合)在COVID-19诊断中具有重要价值,能对核酸漏检问题起到显著的补充作用,可作为核酸检测阴性的疑似患者的补充检测或与核酸检测协同用于疑似患者的确诊。由于2019-nCoV是一种新发病毒,在本次疫情中由于人体内缺乏2019-nCoV特异性抗体而普遍易感,因此,笔者认为在本次疫情中,结合核酸检测结果,在排除抗体检测"假阳性"的干扰后,IgM和(或)IgG抗体检测阳性可帮助临床对疑似患者进行确诊,而在本次疫情过后或判断复发感染时,则需考虑IgG抗体滴度的变化,恢复期IgG抗体滴度较急性期升高4倍及以上才可诊断。
2019-nCoV特异性抗体检测虽能弥补核酸检测阳性率低、耗时长、风险高等缺点,但由于外周血中抗体产生需要一定时间,其检测存在"窗口期"。研究报道表明,32%的SARS-CoV感染患者在发病后3 d左右即可在呼吸道中检测到病毒核酸,在10 d左右可以达到峰值;超过90%的SARS-CoV感染患者在发病后2周左右可在粪便中检测到病毒核酸,15~17 d可以达到峰值。而SARS-CoV感染患者发病10 d左右抗体才开始产生,个别感染患者甚至到21 d才可检测出抗体[17]。因此笔者认为,监测患者的病程进展尤其是在患者起病初期进行监测,需要联合核酸检测进行,见表2。

抗体联合核酸检测结果对患者病程的判断
抗体联合核酸检测结果对患者病程的判断
| 核酸检测 | 抗体检测 | 病程时期 | 备注 | |
|---|---|---|---|---|
| IgM | IgG | |||
| 阳性 | 阴性 | 阴性 | 可能处于"窗口期",即感染的极早期 | 此时抗体可能未产生或已经产生但未达到试剂检测下限 |
| 阳性 | 阳性 | 阴性 | 可能处于感染早期,提示现症或新近感染 | 此时IgM已经产生但IgG尚未产生或产生量未达到试剂检测下限 |
| 阳性 | 阳性 | 阳性 | 可能处于感染进展期 | 此时病毒复制活跃,但机体已经对病毒有了一定的免疫力 |
| 阳性 | 阴性 | 阳性 | 可能处于感染中后期(恢复期) | 此时IgM逐渐下降至检测不出,IgG则长期保持较高浓度 |
| 阴性 | 阴性 | 阳性 | 可能是既往感染,已经康复 | 病毒已被机体自身的免疫系统清除,但仍需对患者进行抗体监测,以防感染复发 |
| 阴性 | 阳性 | 阳性 | 可能处于感染进展期或恢复期,但需要继续监测抗体进行确认 | ①对患者进行抗体监测,若IgG滴度持续升高可确认感染且可能处于进展期;②体内病毒被清除,IgM已经下降,但仍能检出,若后续监测结果显示IgM转阴可确认感染且处于恢复期;③核酸检测假阴性,需进一步复查确认 |
| 阴性 | 阳性 | 阴性 | 可能处于感染早期或进展期,但需要继续监测抗体进行确认 | ①对患者进行抗体监测,若IgG转阳可确认感染且可能处于进展期,若结果不变考虑IgM假阳性情况;②核酸检测假阴性,需进一步复查确认 |
| 阴性 | 阴性 | 阴性 | 本次可报告阴性 | 疑似患者需结合CT等其他相关检查与流行病学史进一步判断,隔离观察期仍需定时进行核酸与抗体检测 |
《新型冠状病毒肺炎诊疗方案(试行第七版)》[2]指出同时满足"体温恢复正常3 d以上;呼吸道症状明显好转;肺部影像学显示急性渗出性病变明显改善;连续两次痰、鼻咽拭子等呼吸道标本核酸检测阴性(采样时间至少间隔24 h)"4个条件的患者可以出院。随着治愈出院患者越来越多,多地区陆续报道了出院患者出现病毒核酸"复阳"的现象,Lan等[18]发表在JAMA上的研究发现4例符合出院标准的患者在出院后5~13 d后咽拭子标本核酸检测结果全为阳性。
符合出院标准的患者虽然相关临床症状已经消失但体内可能仍有病毒残余,因其数量少,活性差,现有的病毒核酸检测试剂无法将其检出,出院后若患者免疫力较低则残余的病毒可继续复制,即可检测到病毒核酸。目前虽然未见此类患者其具有感染性的报道,但这一现象依然给疫情防控工作带来了新的挑战。
通过对IgM和IgG的检测可以判断出院后病毒核酸"复阳"患者有无发生复发感染。众所周知,处于感染恢复期的患者IgM处于较低水平,检测试剂不易检出,而IgG则一直处于较高浓度且可以持续较长时间。对符合出院标准的患者进行IgM和IgG的定期监测,若仅有IgG阳性说明患者已有一定的免疫能力,复发的可能性较小;若出现IgM由阴性转为阳性则需警惕患者复发的可能性。若监测过程中IgG显著上升达4倍以上,则也需要警惕感染复发。目前尚未有关于核酸"复阳"患者血清抗体检测结果的具体报道和研究,有待进一步研究后通过抗体变化情况判断核酸"复阳"患者是否具有传染性,从而对防控工作提供参考和帮助。
有研究表明,SARS-CoV感染患者的病情严重程度与外周血中IgG抗体的滴度有关,需要接受吸氧治疗的患者和重症监护室(intensive care unit, ICU)的重症患者外周血IgG抗体的滴度显著高于轻症患者[19]。另外,一些关于中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)的研究也表明,抗体滴度在一定范围内与疾病的严重程度相关。有一项研究比较了4例重症中东呼吸综合征(Middle East respiratory syndrome,MERS)患者和5例轻症患者的免疫反应,发现在发病第2周和第3周,重症患者的分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)滴度相对高于轻症患者。在恢复期,重症患者的IgG滴度呈现3倍上升,而轻症患者的IgG滴度则仅有轻微升高[20]。还有一项纳入了3例无症状MERS-CoV感染者、10例MERS-CoV感染轻症患者、18例伴发肺炎症状患者和11例伴发呼吸衰竭患者的研究发现,无症状的MERS-CoV感染者在6个月内没有表现出血清学反应,血清转换率随疾病严重程度的增加而增加[21]。因此,笔者推测,COVID-19重症患者较轻症患者来讲,可能更早地开始产生特异性抗体,且重症患者的外周血IgM和IgG抗体浓度在一段时间内可能高于轻症患者。这提示在对COVID-19患者的抗体浓度和病情严重程度的关系进行进一步研究之后,可通过监测患者IgM和IgG抗体浓度的变化对患者病情进展进行预警。例如,制定抗体预警值,当抗体浓度达到该值时应警惕患者的病情恶化,以便及时采取有效的治疗措施。
2019-nCoV特异性抗体检测虽能弥补核酸检测阳性率低、耗时长、风险高等缺点,但由于抗体的产生规律及免疫学方法其固有的干扰问题。特异性抗体的检测存在一定局限性。
前文已经提到,病毒对人体的感染存在一个"窗口期",是指病毒感染人体后尚未产生抗体或者抗体产生量较少的一段时间,在该时段内现有检测手段无法检测到抗体,造成检测的"假阴性",从而导致漏诊。此外,标本、试剂保存不当或操作失误等可控因素也会在一定程度上导致抗体检测的"假阴性"。
在临床检测中,CLIA和ELISA检测方法均需要设定阳性判断值来判断检测结果的阴阳性。理想状态下,阴性样本的检测结果分布与阳性结果不存在重叠区域。但在实际检测过程中,检测大量阴性样本与阳性样本后,会有少量样本检测值存在重叠,这一部分样本的检测结果存在争议。采用受试者工作特征(receiver operating characteristic,ROC)曲线或其他统计学方法设定的阳性判断值,通常对应为假阳性和假阴性均较低的最佳临界点。因此,一部分位于阳性判断值附近的被判为弱阳性的检测结果可能为"假阳性"[22]。这一部分"假阳性"是检测方法固有的,因此无法避免。GICA虽不存在阳性判断值的问题,但因其结果需要肉眼判断,存在个体判断差异,一定程度上也可能造成最终结果的偏差。
患者自身的因素也可能造成检测结果的"假阳性"。最常见的内源性干扰物质是类风湿因子(rheumatoid factors, RF)。它是一种以变性IgG为靶抗原的自身抗体,通常为IgM型,也有IgG和IgA型。类风湿、系统性红斑狼疮等自身免疫病、一些感染性疾病(细菌性心内膜炎、结核、麻风等)患者及1%~5%的正常人血清中含有不同浓度的RF,其可以与检测系统中的捕获抗体及被标记的二抗的Fc段直接结合,从而导致假阳性[23]。特别是对IgM抗体的检测,RF的影响最为明显。此外,血清中的嗜异性抗体、补体及其他自身抗体等的存在也可能造成抗体检测的"假阳性"。另一方面,虽然各公司研发的抗体检测试剂盒所选择的靶抗原有所不同,但大多都以S蛋白和(或)N蛋白为靶抗原。据报道不同冠状病毒N蛋白或S蛋白之间存在免疫交叉反应[24,25],因此,2019-nCoV抗体检测可能受其他冠状病毒的影响,而出现一定的假阳性。此外,标本凝集不全或离心不充分、标本贮存时间过长、标本被细菌污染、标本溶血及操作不当等外源性因素也会导致抗体检测的"假阳性"[22]。
IgM和IgG抗体检测的"假阳性"在临床检测中比较常见。尽管通过一些措施能够减少抗体检测的"假阳性",但无法完全避免。"假阳性"的出现可能会造成不必要的隔离和恐慌,影响正常的医疗秩序。因此,2019-nCoV特异性抗体检测仅用作对核酸检测阴性的疑似病例的补充检测,辅助核酸检测对疑似病例进行确诊,不能作为COVID-19确诊和排除的依据,也不适用于一般人群的筛查工作。
随着COVID-19实验室诊断工作的不断完善,2019-nCoV抗体检测被应用于临床。抗体检测一方面能有效弥补核酸检测的缺陷,协助核酸检测对疑似患者进行确诊。另一方面能监测在院患者的病情进展,判断出院患者的恢复情况,对临床诊疗工作具有一定的指导作用。但因其无法避免的"假阳性"干扰,抗体检测仅可作为已有病毒核酸检测试剂的补充,不能独立用于COVID-19的确诊和排除。因此,对COVID-19的实验室检测应提倡多种检测手段互相结合,协同使用,从而提高对病毒的诊断速度和鉴别诊断的能力。
所有作者均声明不存在利益冲突



























