
分析女性睾酮测定结果假性升高的病例特点并回顾文献,为临床实验室识别假性睾酮升高提供参考依据。
回顾性分析北京协和医院3例睾酮假性升高患者的病例特点,比较不同检测平台与方法测定睾酮水平的结果;通过PUBMED、中国知网检索国际和国内与睾酮假性升高、睾酮检测方法相关文献进行综合分析。
3例女性患者免疫法测定睾酮水平升高,经质谱法测定睾酮水平均正常,排除高雄激素血症诊断。共检索到38篇与睾酮检测相关文献,9篇为假性高雄激素血症的病例报道,其中国内于2021年共有2篇文献报道假性高雄激素血症共12例,所有案例均用液相色谱串联质谱法确认睾酮水平。既往研究明确提示临床实验室常规应用的免疫法测定女性睾酮结果与质谱法相关性差,存在不同程度偏差。
免疫法检测女性睾酮易受干扰导致结果假性升高,建议临床实验室对所用检测方法进行评估并建立鉴别方案,对于可疑睾酮假性升高的样本采用其他免疫平台或LC-MS/MS法进行确认。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
高雄激素血症是女性月经紊乱的主要原因,临床表现包括闭经、多毛、痤疮等,大多数与多囊卵巢综合征或特发性多毛症相关,少数会有更严重的内分泌疾病(肾上腺或卵巢肿瘤、库欣综合征或迟发性先天性肾上腺增生症等)[1],血清睾酮的检测是诊断女性高雄激素血症的依据。
目前多数临床实验室采用免疫法测定血清睾酮。免疫法灵敏度较低、系统性偏差以及异嗜性抗体干扰等因素都会影响睾酮检测结果准确性[2],严重者甚至导致临床采用错误的诊疗措施。
本研究通过回顾性分析睾酮水平异常升高的3例患者诊治经过及文献复习,分析干扰免疫法测定女性睾酮的影响因素,探究改进措施以提高女性高雄激素血症诊断准确率。
纳入北京协和医院2020―2021年3例因“睾酮水平升高”来院就诊的患者,就医过程中反复检测睾酮水平均升高。本研究经北京协和医院伦理审查委员会批准(HS-2722)。
病例1:女,36岁,发现雄激素升高4年。2016年因月经量少就诊,检查发现睾酮水平升高,但患者月经周期规律,无体毛增长、面部痤疮等高雄激素表现。行中剂量地塞米松抑制试验,对照日睾酮1.99 ng/ml,服药日睾酮1.71 ng/ml,抑制率14.1%,地塞米松不能抑制睾酮,妇科超声提示子宫肌瘤,余无异常,2017年进行基因测序也未见异常,此后多次检查睾酮均升高,患者无宠物、大型动物接触史,未服用中药、保健品等药物,近期也未接种疫苗。
病例2:女,44岁,月经稀发3年,2018年于外院检查时发现睾酮2.74 ng/ml(参考区间0.10~0.75 ng/ml),2020年7月在另一家医院复查结果为2.46 ng/ml,服用中药治疗。2020年8月因月经稀发、高雄激素血症于我院就诊,常规化学发光法检测睾酮为2.03 ng/ml。行中剂量地塞米松抑制试验,对照日睾酮2.13 ng/ml,服药日睾酮1.52 ng/ml,抑制率28.6%,地塞米松不能抑制睾酮;行双侧肾上腺B超未见明确占位;抗核抗体检测显示散点型1∶160。患者自诉无宠物、大型动物接触史,未服用中药、保健品等。
病例3:女,49岁,2019年因“月经不规律8月”入院,检测睾酮2.55 ng/ml,盆腔超声提示子宫多发肌瘤,右侧卵巢囊肿,不排除患者高雄激素血症可能与卵巢囊肿有关,行“腹腔镜检查+双侧附件切除+子宫肌瘤切除+宫腔镜检查”手术,术后睾酮水平未见明显降低,高雄激素血症持续存在,后患者反复多次就诊内分泌科和妇产科查找睾酮升高原因。
液相色谱串联质谱法(liquid chromatography tandem mass spectrometry,LC-MS/MS)检测睾酮:分析平台为Waters TQS 液相色谱串联质谱仪。操作步骤:取血浆样本于1.5 ml离心管中,加入同位素内标,再加入蛋白沉淀剂,充分涡旋混合后,离心取上层清液至Oasis PRIME HLB Elution 96孔提取板上进行固相萃取,收集洗脱液,混匀上机。以含0.5 mmol/L氟化铵的纯水为流动相A、甲醇为流动相B,采用梯度洗脱,进样10 μl,柱温为50 ℃。质谱检测采用正离子电喷雾离子化的多离子反应监测模式,定量离子通道为289.296➝97.055。去溶剂气压力为1 100 psi,碰撞气为8 psi,喷雾电压:-4 500V,去溶剂温度:550 ℃。
免疫法测定睾酮采用Beckman Coulter DXI800全自动免疫分析仪及配套试剂、Roche Cobas e801全自动电化学发光免疫分析仪及配套试剂,所有操作严格按照北京协和医院检验科标准化操作规程(SOP)进行,试验期间仪器运行稳定,质控在控。
以“Testosterone”“Immunoassay”“Interference”为关键词在PUBMED数据库检索,以“睾酮”“检测干扰”为关键词在中国知网数据库检索,查阅相关文献,总结睾酮免疫法干扰案例,探讨免疫法测定睾酮水平假性升高的原因以及实验室对于假性高雄激素血症的筛查流程。
采用不同检测平台分别检测了3例患者的睾酮水平,结果如表1所示。结果显示3例患者的睾酮在WatersTQS 液相色谱串联质谱平台检测均在正常水平,不存在高雄激素血症,DxI800因为测定当日质控在控,且患者多次就诊免疫法测定结果均升高,故不是检测系统误差或偶然误差导致,睾酮升高为检测干扰所致。
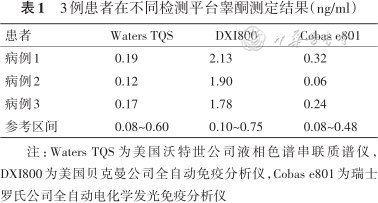
3例患者在不同检测平台睾酮测定结果(ng/ml)
3例患者在不同检测平台睾酮测定结果(ng/ml)
| 患者 | Waters TQS | DXI800 | Cobas e801 |
|---|---|---|---|
| 病例1 | 0.19 | 2.13 | 0.32 |
| 病例2 | 0.12 | 1.90 | 0.06 |
| 病例3 | 0.17 | 1.78 | 0.24 |
| 参考区间 | 0.08~0.60 | 0.10~0.75 | 0.08~0.48 |
注:Waters TQS为美国沃特世公司液相色谱串联质谱仪,DXI800为美国贝克曼公司全自动免疫分析仪,Cobas e801为瑞士罗氏公司全自动电化学发光免疫分析仪
共检索到36篇英文文献,2篇中文文献。关于质谱法方法学研究文献15篇,免疫法与质谱法结果比较8篇,睾酮假性升高案例及综述共13篇,睾酮检测指南2篇。
1.质谱法检测睾酮方法学研究:关于质谱法睾酮测定方法学文章15篇,主要包括同位素稀释气相色谱-质谱法、LC-MS/MS法等,2005年Cawood等[3]建立了LC-MS/MS法测定血清睾酮,相比于免疫法具有更低的检测下限,灵敏度高,特异性强,不受异嗜性抗体等干扰的优点。此后方法学文章均围绕LC-MS/MS展开,包括同时测定多种性激素以及前处理自动化提升检测通量等。
2.免疫法与质谱法结果比较:2013年Taieb等[4]通过10种实验室常用的免疫分析方法与同位素稀释气相色谱-质谱法进行比较就发现免疫法和质谱法测定男性睾酮相关性较好,但各免疫平台测定女性睾酮结果差异大,和质谱法相比相关性差,偏差可达2~5倍。2018年,La′ulu等[5]对雅培ARCHITECT、西门子Centaur、贝克曼DxI、罗氏E170和西门子IMMULITE 5种常用的全自动免疫分析法检测睾酮的分析性能与LC-MS/MS法进行比较发现:因女性样本睾酮水平较低,免疫法测定易受干扰、结果准确性差。
3.睾酮假性升高案例与分析:2011―2021年共9篇病例报道报道了21例患者血清睾酮水平假性升高,均使用LC-MS/MS法证实患者睾酮水平正常。其中5例患者明确为服用药物造成干扰,其余16例患者未明确干扰原因。
4.睾酮检测相关指南:2018年,英国哥伦比亚省临床实践指南中心发布睾酮检测指南中指出,对于可疑高雄激素血症的女性应进行睾酮水平测定,但巴比妥酸、克罗米芬、雌激素和丙戊酸的使用可能会造成女性睾酮结果测定值增加,临床应注意评估[6]。美国临床内分泌学会在指南中也提出对于女性睾酮水平的检测方法进行评估和改进[7]。
使用免疫法检测女性睾酮导致假性高雄激素血症的案例近10年来在国际国内均有报道[8, 9, 10, 11, 12, 13, 14, 15, 16],可导致患者不必要的检查或治疗。我们在实验室一线检验工作及与临床沟通中发现,该问题并未引起实验室与临床的重视。因此,我们选择3个典型案例进行分析以及文献复习,以期引起实验室、临床以及厂商重视。
目前常规实验室多采用免疫法测定血清睾酮。该方法采用竞争结合原理,样本睾酮与标记睾酮竞争结合固相载体表面的抗睾酮单克隆抗体,经过分离清洗后加入发光底物,信号值与测定值成反比。本研究3例女性患者均因睾酮水平升高多次反复就诊,时长几个月到数年,且进行了不同程度的检查和/或治疗。病例1进行了两次中剂量地塞米松抑制试验,病例2因高雄激素血症服用中药治疗,病例3进行了“腹腔镜检查+双侧附件切除+子宫肌瘤切除+宫腔镜检查”术后仍未明确睾酮升高病因。我们通过应用参考方法及不同的免疫检测确认为假性升高,排除了“高雄激素血症”的诊断。
干扰免疫法测定睾酮的可能原因有以下几方面,一是基质效应,外周循环中66%的睾酮与性激素结合球蛋白(sex hormone binding globulin,SHBG)结合,30%与白蛋白相结合,只有2%~4%的是游离形式的,被认为是它的活性形式[17]。目前免疫法测定血清中的总睾酮,没有提取步骤。因此,血清中存在的某些脂质和蛋白质,特别是SHBG,可能会干扰免疫分析。甲亢、慢性肝炎等很多疾病都会引起SHBG升高,从而导致睾酮水平的假性增加。在免疫分析法中,结合蛋白升高引起的检测干扰可高达80%[18]。二是抗体的交叉反应性,免疫测定法通常使用特异性多克隆或单克隆抗体,但抗体的特异性具有局限性。有研究显示,与类固醇激素相似或与血清中SHBG相互作用的治疗药物在睾酮的检测中存在交叉反应[19],因此,与睾酮结构相似的抗体可能是睾酮免疫测定的干扰源,导致了睾酮水平的假性升高。本文3例病例中患者均无宠物、大型动物接触史,未服用中药、保健品等药物,近期也未接种疫苗,无法明确干扰因素。病例1患者自诉牛羊肉进食较多,怀疑可能受到异嗜性抗体干扰;病例2患者抗核抗体检测显示散点型1︰160,不排除自身抗体干扰睾酮免疫法检测;病例3患者未见明显干扰原因。当前国内临床实验室普遍应用免疫法测定睾酮,但国内对于假性高雄激素血症和睾酮检测受干扰的报道很少,说明此问题未引起实验室与临床的重视。
近年来,质谱检测成为睾酮检测的“金标准”,LC-MS/MS法测定睾酮基本原理为:待测样品进样后在流动相的携带下进入色谱柱,经过色谱柱分离后,进入质谱仪进行检测。质谱法根据被测物的质荷比进行检测,具有灵敏度高,选择性强,准确性好等特点[20]。该技术与免疫法相比具有更低的检测下限,灵敏度高,特异性强,不受异嗜性抗体等干扰,检测变异较小[21]。但是质谱法检测睾酮步骤繁琐,时间较长,自动化程度低,检测通量较低,且成本较高,对检测人员要求较高,目前还无法替代免疫法常规使用[22]。因此,实验室应建立制度和流程以保证女性睾酮水平得到准确测定。我们结合工作实践提出如下建议:(1)实验室检测人员与报告审核人员应得到培训,充分知晓免疫法测定睾酮存在的不足以及当前实验室可行的解决办法;(2)女性患者测定睾酮的检验报告按年龄或绝经前后设定参考区间,并标识检测仪器与方法;(3)临床实验室应结合自身条件建立女性睾酮假性升高的识别方法与确认流程;(4)有条件开展质谱检测的实验室,可设置雄激素相关的组合项目,将免疫法测定睾酮作为一个初筛试验,用于阴性排除。对于初诊主诉为高雄激素血症的患者建议临床直接申请质谱法测定睾酮或相关组合项目;(5)没有条件开展质谱法测定睾酮的实验室,当遇到免疫法测定睾酮结果升高可能影响临床决策时,可建议临床送检第三方实验室,使用不同的免疫检测平台或质谱法进行确认;(6)与临床进行沟通,尤其是重点科室包括内分泌科、妇产科、皮科等,使临床大夫充分知晓免疫法测定女性睾酮存在的不足以及当前实验室可提供的解决办法。
综上所述,免疫法测定女性睾酮易受到干扰造成睾酮水平假性升高。临床实验室应根据各自检测平台的特点,建立免疫法测女性睾酮假性升高的排除流程,避免误诊误治。
所有作者声明无利益冲突



























